Chronická onemocnění plic
(přesměrováno z Chronická plicní onemocnění)
Bronchopulmonální dysplázie
Bronchopulmonální dysplázie (BPD), nověji chronická plicní nemoc (CLD) je novorozenecká forma chronického postižení plic. BPD je definována jako přetrvávající závislost původně nezralého novorozence na kyslíku nebo ventilační podpoře po dobu delší než 28 dní po porodu. BPD se projevuje příznaky dechové tísně. Podstatou potíží je restrikce dýchacího povrchu plic se zmnožením intersticiálního vaziva. RTG korelátem je fibrotizace plic s fokálním emfyzémem. Na rozvoji BPD se podílí anatomická a funkční nezralost plicní tkáně a působení nepříznivých vlivů infekce, aspirace plodové vody, umělé plicní ventilace, podávání kyslíku atd. Léčba zahrnuje kromě ventilační podpory a oxygenoterapie také adekvátní výživu a udržování rovnováhy vnitřního prostředí. Důležitá je ochrana před respiračními infekty. BPD/CLD má tendenci k postupné regresi.[1]
„Nová“ forma bronchopulmonální dysplázie postihuje novorozence s extrémně nízkou porodní hmotností, kteří zpočátku neměli žádnou nebo jen mírnou ventilační podporu a minimální kyslíkové nároky.[2]
BPD je definována jako přetrvávající závislost na kyslíku nebo ventilační podpoře ve 28 dnech života. Závažnost respiračních potíží v časném dětství v důsledku BPD lze přesněji určit podle závislosti na kyslíku ve 36 týdnech postkoncepčního věku u dětí narozených před 32. týdnem těhotenství a ve věku 56 dní u dětí narozených po 32. týdnu těhotenství. Právě v tomto období se proto určuje tíže BPD. Rozděluje se podle ventilační podpory potřebné k udržení saturace nad 89 %:
- mírná BPD – bez nutnosti oxygenoterapie (při dosažení 36 týdnů postkoncepčního věku nebo 56 dní);
- středně těžká BPD – při nutnosti oxygenoterapie do 30 % kyslíku;
- těžká BPD – při potřebě > 30 % kyslíku a/nebo nutnosti CPAP (continuous positive airway pressure) či umělé plicní ventilace.[2]
Incidence BPD stoupá s klesající porodní hmotností. Postihuje asi 30 % dětí s porodní hmotností pod 1000 g.[2]
Mezi hlavní rizikové faktory pro rozvoj BPD patří:
- nezralost (stoupající počet přežívajících extrémně nezralých novorozenců), bílá rasa, mužské pohlaví,
- chorioamniitida, kolonizace trachey ureaplazmaty.
Dalšími rizikovými faktory jsou:
- RDS, excesivní časné podávání i.v. tekutin, symptomatický PDA, sepse, oxygenoterapie, deficit vitaminu A, výskyt atopie v rodině.[2]
Patofyziologie
Na rozvoji BPD se podílí:
- zánět – zvýšená zánětlivá odpověď v prvních dnech života (influx prozánětlivých cytokinů, makrofágů a leukocytů do alveolů);
- umělá plicní ventilace – volumotrauma a barotrauma;
- oxygenoterapie – hyperoxie způsobuje proliferaci alveolárních buněk II. typu a fibroblastů, změny v surfaktantovém systému, zvyšuje koncentraci zánětlivých buněk a cytokinů, zvyšuje ukládání kolagenu a snižuje alveolarizaci a mikrovaskulární denzitu.
Poškozené plíce se hojí abnormálně, dochází ke strukturálním změnám, jako je zpomalená alveolarizace a dysgeneze plicních cév. Plíce postižené BPD mají méně sept, menší počet alveolů, větší alveoly, zredukovanou plicní kapilarizaci, která může vést k sekundární plicní hypertenzi.[2]
Klinický obraz
- Progresivní idiopatické zhoršení funkce plic – nutnost oxygenoterapie a/nebo ventilační podpory po prvním týdnu života. Zvýšená dechová práce (zatahování mezižeberních prostor a jugula), epizody apnoe a bradykardie, pískoty, prodloužené exspirium. Edém plic, hyperreaktivní dýchací cesty.
- Neprospívání a růstová retardace.
- Cor pulmonale, zvětšená játra v důsledku pravostranného srdečního selhávání nebo posun jater kaudálně v důsledku hyperinflace plic.[2]
Diagnostika
- anamnéza;
- charakteristický klinický obraz;
- ABR: retence oxidu uhličitého, pH obvykle subnormální (≥ 7,25);[2]
- elektrolyty – změny v důsledku chronické hyperkapnie (kompenzatorně zvýšený bikarbonát), léčby diuretiky (hyponatremie, hypokalemie, hypochloremie) a restrikce tekutin (zvýšená urea a kreatinin);[2]
- typický RTG nález – objevují se difúzně drobné infiltráty, známky hyperinflace plic
- RTG stadia BPD:
- I. difuzní retikulogranulární plicní kresba s pozitivním aerobronchogramem,
- II. pokračující zastínění plic,
- III. tvorba četných cyst,
- IV. zvětšující se velikost jednotlivých bulosních cyst a atelektáz (= dystelektázy) s rozvojem kardiomegalie,
- RTG stadia BPD:
- Funkční vyšetření plic – prokazuje obstrukci (částečně reverzibilní po podání bronchodilatancií).
- Rozvíjí se chronická hypoxie, plicní edém a cor pulmonale.[3]
Prevence
- prevence prematurity a RDS (dobrá prenatální péče, indukce plicní zralosti kortikosteroidy);
- minimalizace rizikových faktorů (optimalizace oxygenoterapie, šetrná ventilace, přesná kalkulace podávaných tekutin, uzávěr PDA, optimalizace výživy);
- vitamin A je důležitým faktorem pro diferenciaci a opravu epiteliálních buněk; extrémně nezralí novorozenci mají nízkou hladinu vitaminu A; lze jej suplementovat i.m.;
- kofein snižuje frekvenci apnoe a tím umožňuje časnější extubaci;
- vdechovaný oxid dusnatý (iNO) snižuje plicní cévní rezistenci a nutnost mechanické ventilace.[2]
Terapie
Minimalizace ventilační podpory
Adekvátní oxygenace a ventilace s akceptováním permisivní hyperkapnie; monitorace saturace. Velmi důležité je co nejdříve dosáhnout odpojení od ventilátoru.
Zlepšení funkce plic
- Restrikce tekutin (obvykle na 120 ml/kg/den) a zvýšení kalorické denzity výživy.
- Diuretika: furosemid (NÚ: porucha rovnováhy elektrolytů, interference s vazebnou kapacitou albuminu pro bilirubin, kalciurie a nefrokalcinóza, demineralizace kostí, tvorba ledvinných kamenů, ototoxicita); bumetanid; chlorothiazid a spironolakton (vhodnější k chronické terapii než furosemid pro méně časté nežádoucí účinky).
- Bronchodilatancia: inhalační β2-agonisté k léčbě akutních exacerbací (NÚ: tachykardie, hypertenze, hyperglykemie, arytmie), inhalační anticholinergika (ipratropium bromid), teofylin – dilatace hladké svaloviny dýchacích cest, zlepšení kontraktility bránice, stimulace dechového centra (prevence apnoe) a mírný diuretický efekt. NÚ: dráždivost, gastroesofageální reflux, dráždění trávícího traktu.
- Kortikosteroidy: dexamethason (NÚ: narušení vývoje mozku a tělesného růstu, vyšší incidence dětské mozkové obrny, dále riziko infekce, hypertenze, žaludečních vředů, hyperglykémie, adrenokortikální suprese, zhoršení růstu plic a hypertrofická kardiomyopatie), methylprednisolon, nebulizované kortikosteroidy (beclomethason – méně NÚ, menší efekt).[2]
- Fyzioterapie hrudníku. [3]
Optimalizace růstu a výživy
Pokrytí zvýšených energetických nároků (120–150 kcal/kg/den).[2]
Prevence respiračních onemocnění
Sezónní očkování proti RSV (palivizumab – humanizovaná monoklonální protilátka).[2]
Indikační kritéria pro Českou republiku (2014):
- Novorozenci s BPD narození v gestačním věku 28+6 a dříve. Pro tyto pacienty plati věkový limit 12 měsíců nebo 12 měsíců od propuštění z perinatologického centra.
- Novorozenci narození v gestačním věku ≤ 28 + 6 nebo s porodní hmotností ≤ 1000g, bez BPD, narození maximálně 6 měsíců před začátkem nebo propuštění v průběhu RSV sezóny.
- Novorozenci narození v gestačním věku 29 + 0 - 31 + 6, bez BPD, s porodní hmotností ≤ 1500 g, narození maximálně 6 měsíců před začátkem RSV sezóny nebo propuštění v průběhu RSV sezóny (1.11. - 31.3.).
- Všichni novorozenci s BPD, bez ohledu na gestační týden, kteří vyžadovali léčbu BPD/CLD (oxygenoterapii, bronchodilatační terapii, kortikoidy, diuretika) ještě 6 měsíců před začátkem RSV sezóny. Tito novorozenci mají nárok na imunoprofylaxi do 2 let věku.
- Hospitalizovaní nezralí novorozenci, ohrožení nozokomiální RSV infekcí mají nárok na aplikaci 1 dávky Synagisu.[4]
K preskripci Synagisu jsou autorizována pouze perinatologická centra.
Domácí oxygenoterapie
V současné době je možná dlouhodobá domácí oxygenoterapie, která umožňuje zkrátit pobyt v nemocnici a tím rizika nozokomiální infekce, dále umožňuje vytváření rodinné vazby a podporuje psychomotorický vývoj dítěte. Využívá se mobilní jednotka s tekutým kyslíkem, která umožňuje volný pohyb dítěte. BPD/CLD má tendenci k postupné regresi, většina dětí přestane být závislá na oxygenoterapii již v průběhu prvého roku.[5]
Komplikace
- Obstrukční bronchitidy, PPHN (perzistující plicní hypertenze novorozence), cor pulmonale, systémová hypertenze, GERD.[3]
Prognóza
Prognóza BPD závisí na tíži onemocnění a na případných komorbiditách. Během prvního roku života bývají časté rehospitalizace pro pískoty a respirační infekce, může dojít ke smrti v důsledku kardiorespiračního selhání, sepse, respirační infekce a SIDS. Většina dětí se zbaví závislosti na kyslíku do prvních narozenin, po zlepšení funkce plic dochází často k růstovému spurtu („catch-up“). Většina adolescentů a mladých dospělých, kteří měli v dětství středně těžkou či těžkou BPD, mají nějaký stupeň plicní dysfunkce – obstrukci, hyperreaktivitu dýchacích cest a hyperinflaci.
BPD často provází zhoršení neuromotorických a kognitivních funkcí, dále je vyšší riziko poškození sluchu a retinopatie nedonošených, problémů s učením, poruchy pozornosti a poruchy chování.[2]
Bronchiektázie
Bronchiektázie charakterizuje rozšíření bronchů, které je obvykle provázeno jejich chronickým zánětem. Nejčastěji se vyskytují v předškolním a časném školním věku.
Patogeneze
Roli hrají dva důležité faktory: obstrukce cest s nedostatečnou drenáží sekretu a poškození stěny bronchů infekcí nebo při aspiraci.
- Dělení dle tvaru:
- cylindrické;
- vřetenovité;
- varikózní;
- vakovité.
- Dělení dle etiologie:
- idiopatické;
- vrozené – na podkladě nedostatečného vývoje chrupavek (Williamsův-Campbellův syndrom), vrozená tracheobronchomegálie aj.
- zánětlivé – při zákl. onemocnění jako CF, syndrom ciliární dyskineze, imunodeficity a další;
- postinfekční – u TBC, po spalničkách, pertusi, po virových infekcích;
- postobstrukční – nepoznaná vdechnutá tělesa, zevní komprese bronchu, bronchiální tumor.
Klinický obraz
Typickým obrazem je chronický kašel s produkcí sputa[6], zvláště ráno. Během dne se množství sputa zmenšuje. Poslechově – chropy nad postiženou oblastí (nález je proměnlivý dle toho, jak jsou ektázie naplněny sekretem). Později se rozvíjí chronická hypoxie a cor pulmonale, paličkovité prsty. V anamnéze časté respirační infekce, námahová dušnost. Na možnost bronchiektázií by měl lékaře upozornit – chronický kašel, přetrvávající atelektáza, nelepšící se rentgenový nález na plicích po respiračním infektu.
Diagnostika
- Rtg plic – zvýšená peribronchiální kresba nebo též oblasti atelektáz.
- Mohou být cystické změny v plicích.
- Dobře se to posoudí pomocí HRCT, v dnešní době by měly být všechny bronchiektáze nezpůsobené cystickou fibrózou diagnostikované na podkladě CT vyšetření[7]
- Funkční vyšetření – obraz obstrukce.
Komplikace
- Opakované pneumonie, hemoptýza, cor pulmonale;
- vzácně abscesy.
Terapie
Terapie spočívá v kontrole infekce a bronchiální sekrece. Odstranění části plic nebo arteriální embolizace snižuje možné komplikace. Dále se využívá polohovací drenáž. K odstraňovaní hlenu se používají mukolytika.
Primární ciliární dyskineze
- Starší název: syndrom nepohyblivých řasinek; OMIM: 244400
- Patogeneze – AR dědičné onemocnění, generalizovaná porucha pohyblivosti řasinek a bičíků všech buněk;
- pohyb chybí úplně nebo je pohyb nekoordinovaný;
- původně byla popsána u Kartagenerovy trias (bronchiektázie, sinusitida, situs viscerum inversus).
Klinický obraz
- Porucha samočistící schopnosti epitelu, dochází k produktivní expektoraci a k tvorbě bronchiektázií.
- Další symptomy – sinusitida, chronická rýma, rinorea, nosní polypy, opakované otitidy, převodní porucha sluchu, perforace bubínku, obstrukce DC, opakované pneumonie, infertilita.
- Situs viscerum inversus je asi jen u 50 %.
- Diagnóza – potvrzení komplikované, nutno znát výsledek elektronové mikroskopie a vysokorychlostní videomikroskopie (HSVM).
Terapie
- Symptomatická, podobná jako u jiných bronchiektázií.
Idiopatická plicní fibróza
Jedná se o difúzní, primárně fibrotizující plicní proces.
Patogeneze
Pravděpodobně se jedná o uniformní patologickou odpověď plicní tkáně na infekční i neinfekční agens. Tato způsobují poškození výstelky alveolů, a tak vyúsťují v progredující a nekontrolovatelné jizvení. Zánětlivá reakce jako taková se může vyskytnout až sekundárně.
Epidemiologie
- Pacienti jsou nejčastěji ve věku mezi 40 a 70 lety.
- Incidence u žen je 7,4/100 000 a u mužů 10,7/100 000.
- Vyskytuje se sporadicky, je stejně rozšířená ve všech lokalitách, familiární případy jsou vzácné.
- Onemocnění je prakticky neléčitelné, i při adekvátní léčbě obvykle přežití nepřesahuje 3–5 let.
Klinický obraz
- Začátek – protrahovaný neproduktivní kašel s v čase se zhoršující námahovou dušností, únava, úbytek na váze, tachypnoe;
- U 2/3 pacientů se vyskytují paličkovité prsty s nehty ve tvaru hodinového sklíčka.
- Obraz CHOPN bez obstrukční vady, v pozdější fázi restrikční poškozeni plic – snížení FVC.
- Přes typicky vleklý postupně se zhoršující průběh se u některých pacientů mohou vyskytnou akutní exacerbace:
- náhlé klinické zhoršení;
- pokles plicních funkcí;
- radiologický obraz tzv. mléčného skla (svědčí pro alveolitidu).
Diagnostika
Zde jsou rozhodující HRCT a typický klinický nález, pokud jsou vyloučeny systémové choroby pojiva a exogenní příčina, není nutná biopsie.
- HRCT obraz plic: plicní fibróza s obrazem voštinaté plíce v bazích plic a minimální okrsky aktivních změn.
- Histologie z plicní biopsie.
- U pacientů neschopných podstoupit chirurgickou biopsii musíme vystačit s RTG obrazem a bronchoskopií.
- RTG: zmnožená plicní kresba až retikulace – voštinovitá plíce.
- Funkční vyšetření: restriktivní ventilační porucha, porucha plicní poddajnosti.
Terapie
- Protizánětlivé a imunosupresivní léky jsou málo účinné, protože hlavním patologickým mechanismem je zde patologická fibroprodukce, dnes se tedy v léčbě nepoužívají.
- Pirfenidon
 – inhibuje fibrózu, indikován u pacientů s FVC 50–80%. Dávkování 3x3cps – celkově 2403 mg.
– inhibuje fibrózu, indikován u pacientů s FVC 50–80%. Dávkování 3x3cps – celkově 2403 mg. - Nintedanib
 – inhibitor tyrozinkinázy na VEGFR, FGFR a PDGFR
– inhibitor tyrozinkinázy na VEGFR, FGFR a PDGFR - Časné alveolární léze: N-acetylcystein 3krát 600 mg (antioxidační působení).
- Akutní exacerbace: vysoké dávky kortikoidů, antikoagulační léčba a antibiotika. Jako prevence exacerbací se podávají PPI (blokátory protonové pumpy).
- Pokročilá onemocnění s hypoxemií: dlouhodobá domácí oxygenoterapie a zvážení transplantace plic.
- Kortikoidy v dlouhodobé terapii jsou neefektivní, protože fibrotizace není navozena zánětlivou reakcí.[9][10][11]
Souhrnné video
Exogenní alergická alveolitida
Exogenní alergická alveolitida (nebo též hypersenzitivní pneumonitida, farmářská plíce, holubářská plíce) zahrnuje skupinu imunologicky podmíněných chorob (přecitlivělost III. typu) s granulomatózním zánětem v bronchiolech + alveolech. Jedná se o intersticiální plicní fibrózu podmíněnou opakovaným kontaktem s určitým alergenem. Nejohroženější skupinou jsou pracovníci v rostlinné a živočišné výrobě po opakovaných expozicích plesnivému senu, slámě a zrní. Exogenní alergická alveolitida vzniká i při práci s plesnivým sladem, s kožešinami, plesnivými sýry, s peřím a exkrementy ptáků. U dětí je vzácná, vzniká nejčastěji inhalací organických prachů z ptáků (holubi, papoušci, andulky).
Diagnostika
- Anamnéza, laboratorní známky zánětu, precipitující protilátky (specifické IgG) v séru proti vyvolávajícímu antigenu,
- RTG hrudníku: retikulonodulární kresba se skvrnitými prchavými infiltráty,
- BAL: bývá lymfocytární alveolitida, ↓ CD4/CD8,
- chronická fáze: na RTG + HRCT obraz intersticiální plicní fibrózy / voštinové plíce; restrikce, porucha difúzní kapacity plic, hypoxémie; plicní biopsie.
Klinický obraz
- Akutní
Akutní forma je reverzibilní a rozvíjí se během asi 6 hodin po intenzivní expozici antigenu. Odeznívá do 48 hodin. Fyzikálně je prokazatelný krepitus nad plicními bazemi. Charakteristické jsou tyto projevy:
- Chronická
Pokud expozice antigenu přetrvává, vyvíjí se chronická forma exogenní alergické alveolitidy. Při opakované expozici také stačí nižší koncentrace příslušného antigenu. Dochází k ireverzibilnímu onemocnění intersticiální plicní fibróze (restrikční porucha). Příznaky:
- ztráta na váze, únava, kašel, dušnost a cyanóza, cor pulmonale, paličkovité prsty, nakonec respirační selhání.
Terapie
- Eliminace antigenů – nutné trvalé vyřazení pracovníka z expozice (u nemoci z povolání),
- kortikoidy,
- oxygenoterapie.[12][13][14]
Cystická fibróza
Cystická fibróza neboli mukoviscidóza je multisystémové autozomálně recesivní geneticky podmíněné onemocnění, které se v klasické formě projevuje chronickým progredujícím onemocněním dýchacích cest a plic, insuficiencí zevní sekrece pankreatu, vysokou koncentrací elektrolytů v potu a poruchou reprodukce mužů.
Výskyt a dědičnost
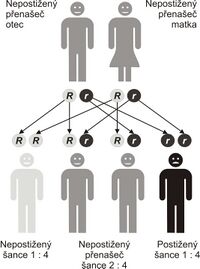
Cystická fibróza je nejčastější život ohrožující dědičné onemocnění europoidní populace (bílé rasy). Výskyt v ČR je odhadován na 1:2 500, ročně se tedy narodí 35–45 dětí s CF (všechny případy ale nejsou diagnostikovány).
Jedná se o autosomálně recesivně (AR) dědičné onemocnění. Defektní gen CFTR (cystic fibrosis transmembrane conductance regulator) se nachází na dlouhém raménku 7. chromosomu . Tento gen kóduje chloridový kanál. Je známo asi 2015[15] mutací tohoto genu (v 68 % je mutace ΔF508).
Patogeneze
Příčinou onemocnění je porucha transportu iontů apikální membránou buněk (chloridový kanál regulovaný pomocí cAMP). Následkem mutace CFTR genu je v potu velká koncentrace chloridů a sodíku. V dýchacích cestách, GIT a reprodukčním systému vede zvýšená koncentrace chloridových aniontů k excesivní reabsorbci sodíku. Sodík je pasivně následován vodou a tím dochází k dehydrataci hlenu a tedy ke zvýšení jeho viskozity. Zahuštěním hlenu lze zjednodušeně vysvětlit většinu klinických projevů CF. Periciliární tekutina má být normálně hypotonická, u CF je izotonická, což porušuje schopnost baktericidie a působení antimikrobiálních peptidů (defenzinů). Tímto se vysvětluje iniciální bakteriální kolonizace. Infekce stimuluje buňky k další tvorbě hlenu, a tím zhoršuje obstrukci dýchacích cest.
Další roli hrají mastné kyseliny – v těle je nepoměr mezi kys. arachidonovou (je jí více) a dokosahexanovou. Toto hraje roli hlavně v regulaci zánětu.
Klinický obraz
Klinický obraz závisí na věku, ve kterém se objeví první příznaky:
- U novorozenců je typický mekoniový ileus, protrahovaný
ikterus a fakt, že do 1 měsíce nedosáhnou své porodní hmotnosti. Dále také hypoproteinémie s
edémy a metabolický rozvrat – metabolická alkalóza.
- U kojenců je charakteristické
neprospívání při velké chuti k jídlu,
steatorea, která budí dojem intolerance kravského mléka nebo céliakie a prolaps rekta.
- Větší děti mívají
poruchu růstu, opakované sinusitidy (často chybně léčeny na astma) a
paličkovité prsty.
- V dospělém věku se objevuje azoospermie, která může být u některých mutací i jediným příznakem. Mezi nejčastější respirační obtíže patří chronický kašel,
tachypnoe,
hemoptýza, bronchiektázie, nosní polypy a hvízdání.
Respirační projevy
se mohou manifestovat v každém období života. U kojenců to bývá kritické, s těžce probíhající bronchiolitidou. Vyskytuje se i atelektáza a pneumonie. V pozdějším věku je nejčastějším projevem kašel (suchý, dráždivý nebo produktivní, spojený s hnisavou expektorací). Je dán exacerbacemi plicních infekcí. Malé děti sputum polykají a zvracejí. Někteří kašlou stále, jiní mají období bez kašle. Jen vzácně provází exacerbace zvýšená teplota. Citlivý ukazatel horšícího se poškození dýchacích cest je tachypnoe.
Původci infekce dýchacích cest jsou nejčastěji S. aureus, Hemofilus, Pseudomonas event. Burkholderia (velmi rezistentní k ATB). Pseudomonas se běžně vyskytuje v zevním prostředí a pacienty osidluje hlavně její mukózní forma. Prevalence pseudomonádových infekcí stoupá s věkem. Často se přenášejí z jednoho CF pacienta na druhého, a proto se doporučuje striktní separace nemocných s CF. Pro zdravé jedince není pseudomonáda nebezpečná. Některé kmeny Burkholderia cepacia vyvolávají tzv. cepacia syndrom (septický s disperzní pneumonií), který vede rychle k úmrtí na abscedující pneumonii a sepsi. Vzácné nejsou ani mykotické komplikace (Aspergillus). Tyto infekce vyvolávají závažné chronické změny – trvalé poškození kapilár i stěny dýchacích cest.
Chronickou bronchitidu komplikují bronchiektázie, atelektázy a emfyzém či chronická pansinusitida, často provázena nosní polypózou. Časně se vyvíjejí paličkovité prsty.
Mezi závažné respirační komplikace CF patří pneumotorax, hemoptýza, globální respirační insuficience. Parciální dechová nedostatečnost je jinak celkem častá, vede k plicní hypertenzi a vývoji cor pulmonale. Rozvoj globální insuficience s hyperkapnií je varovným znamením.
Postižení GIT
se manifestuje hlavně neprospíváním a to následně nepříznivě ovlivňuje průběh respiračních infekcí. Hlavní příčinou je insuficience zevní sekrece pankreatu, tedy že potrava není dostatečně štěpena. Děti mají balónovitě vzedmuté bříško, které kontrastuje s hůlkovitými končetinami. Stolice jsou objemné, mastně a nápadně páchnou. Děti mají dobrou chuť k jídlu, ale nepřibývají (neúměrně tomu, co snědí). Nejčastěji to vzniká při přechodu na umělou výživu, ale pankreatická insuficience nemusí být přítomna a projeví se později nebo při velké chuti k jídlu může být neprospívání kompenzováno.
Dále jsou deficity vitaminů A, D, E, K, minerálů a stopových prvků.
Prolaps rekta může někdy být prvním projevem choroby. Později je přítomen hlavně u dětí se špatnou léčbou nebo při úporném kašli. Časté bolesti břicha mohou mít mnoho příčin, jako například roztažení kliček obsahem, plynatostí, svalové bolesti od úporného kašle atp. Syndrom distální intestinální obstrukce, tedy ucpání střeva zahuštěným obsahem, tzv. ekvivalent mekoniového ileu může probíhat jako NPB, na níž se podílí dehydratace aj. Asi 10–15 % pacientů s CF se rodí s mekoniovým ileem (střevní neprůchodnost v prvních hodinách života).
Hepatobiliární komplikace
se projevují různě závažně. Jsou způsobené obstrukcí žlučových kanálků. Mohou vyústit v cirhózu a portální hypertenzi. Někdy se manifestuje jako cholestatická žloutenka, častá je cholelitiáza a GER. Recidivující pankreatitida se popisuje zejména u pacientů bez defektu sekrece.
Sekrece slin
Chloridový kanál kódovaný CFTR genem kromě Cl– iontů může skrze sebe propouštět i HCO3– ionty. Tohoto se využívá při sekreci slin, kdy buňky vývodů slinných žláz (duktální buňky) obsahují na svém apikálním povrchu právě CFTR kanály a využívají je pro sekreci bikarbonátu do slin. Důsledkem této sekrece je vyšší pH slin (až 8), díky kterému mají sliny antibakteriální účinky. Pri cystické fibróze však tento kanál není funkční ani zde, a tak jsou sliny méně alkalické a nemohou tak dostatečně plnit svou antimikrobiální funkci.[16]
Další projevy
- Diabetes mellitus spojený s CF je asi v 10 %.
- Dilatační kardiomyopatie.
- Chronické infekce, které se pokládají za příčinu vzniku mnoha autoimunitních procesů.
- Osteoporóza, která je přítomna téměř u čtvrtiny dospělých nemocných.
- 98 % mužů je neplodných pro obstrukci vas deferens (obstruktivní azoospermie).
Diagnóza a diferenciální diagnóza
Diagnóza se opírá o:
- klinické podezření,
- stanovení koncentrace chloridů v potu,
- molekulárně-genetické vyšetření.
Klinické podezření vzniká na základě přítomnosti hlavních příznaků CF, které musí vzbudit podezření:
- chronický sinopulmonální syndrom,
- paličkovité prsty,
- průkaz pseudomonády,
- typický obraz rtg,
- trávicí problémy,
- CF v rodinné anamnéze,
- průkaz azoospermie.
Principem potního testu je stimulace pocení pilokarpinovou iontoforézou, sběr potu a kvantitativní stanovení chloridů. Normální hodnoty chloridů v potu jsou 10–30 mmol/l, u CF jsou hodnoty nad 60 mmol/l. Při pilokarpinové iontoforéze se využívá stejnosměrného proudu o intenzitě 4 mA. Pomocí tohoto proudu pronikne pilokarpin (parasympatomimetikum) kůží k potním žlázám, kde stimuluje pocení. Pot se získává po ukončení iontoforézy v místě pozitivní elektrody (anody).[17] U všech nemocných s pozitivním testem je třeba udělat analýzu genotypu.
Genetické vyšetření se provádí nejčastěji z leukocytů z žilní krve u dětí a dospělých osob, případně z buněk plodové vody či choriových buněk v rámci prenatální diagnostiky. Je nezbytné pro potvrzení diagnózy, umožní odkrýt nosiče v rizikové rodině, na základě čehož jim je možné nabídnout cílenou prenatální diagnostiku.
Vyšetření funkce pankreatu není nezbytné pro diagnostiku CF, ale je potřeba pro rozhodnutí o substituční léčbě. Používá se kvantitativní vyšetření ztrát tuků stolicí. Vyšetření stolice na přítomnost elastázy pomocí ELISA.
Sledování stavu výživy – výška, hmotnost, poměr hmotnosti k výšce a obvod paže (v percentilech).
Mikrobiologie sekretu dýchacích cest by měla být provedena při každé kontrole, abychom včas odhalili infekci.
Rtg plic je charakteristický, dělá se při podezření na infekční komplikaci a pravidelně jednou ročně. Bronchovaskulární kresba je zmnožená, hily zvětšené. Hnisem naplněné bronchiektázie a emfyzematózní buly ukazují na závažné poškození. Významné jsou známky emfyzému (především na bočním snímku) vyskytující se zejména retrosternálně a retrokardiálně. Pro lepší diagnostiku bronchiektázií lze využít HRCT.
Vyšetření funkce plic – časný projev je obstrukce periferních dýchacích cest, později narůstá hyperinflace a obstrukce centrálních cest.
Dále pravidelně provádíme vyšetření krevních plynů pro včasné odhalení respirační insuficience. Orientačně se osvědčuje i pulzní oxymetrie (při poklesu saturace pod 92 % indikujeme Astrupa).
Jinak se pravidelně sledují zánětlivé markery, 2× ročně jaterní testy, jednou ročně EKG, hladina vitaminů A a E. U dětí nad 10 let vyšetřujeme glukózovou toleranci oGTT, kostní věk a USG jater.
Diferenciálně diagnosticky zvažujeme recidivující záněty dýchacích cest, sinobronchiální syndrom, event. asthma bronchiale. Při gastrointestinálních projevech céliakii.
Od října roku 2009 je v ČR test na cystickou fibrózu součástí novorozeneckého screeningu.
Terapie
Léčba musí být intenzivní a komplexní, dítě musí být dispenzarizováno (ideálně jednou měsíčně, min. čtvrtletně).
Léčba respiračních projevů spočívá hlavně v boji s infekcí a péči o průchodnost dýchacích cest. Důležitá je prevence, jako například očkování, zvláště proti chřipce, a podpora vykašlávání např. pomocí "Flutteru", což je „kulička“, která při výdechu vibruje a tím zlepšuje pohyb hlenu v bronchu.
Při exacerbaci respiračního infektu zahajujeme cílenou, intenzivní antibiotickou terapii. K docílení terapeutické koncentrace v séru potřebuje CF pacient větší dávky. Při prvním záchytu pseudomonády nasazujeme per os ciprofloxacin (30 mg/kg/den) a inhalačně kolistin. Fluorochinolony se užívají v pediatrii jen výjimečně, protože poškozují růstové chrupavky. Jsou indikovány pouze u CF a z vitální indikace. U dětí chronicky infikovaných pseudomonádou dáváme 3–4× ročně po dobu 14 dní i. v. ATB bez ohledu na klinický stav (kombinace – aminoglykosid + betalaktam, příp. kotrimoxazol). Zásadně se vyhýbáme monoterapii, protože ta často vede k rezistenci.
Protizánětlivá léčba spočívá hlavně v podávání NSA (kortikoidy jsou účinné, ale mají mnoho NÚ). Podává se ibuprofen v dávce 20–30 mg/kg 2× denně.
Průchodnost dýchacích cest, tedy zřeďování sekretu, se zajišťuje pomocí inhalace mukolytik (N-acetylcystein, bromhexin, ambroxol). Hnisavý sekret velmi dobře rozpouští rekombinantní lidská deoxyribonukleáza (rozpouští DNA z rozpadlých PMN), podávaná inhalačně.
Bronchodilatancia se uplatňují méně než u jiných chronických obstrukčních nemocí, protože někdy mohou vyvolat kolaps bronchů. Indikují se výhradně nemocným s pozitivním bronchodilatačním testem.
U pacientů s trvalou hyposaturací se využívá domácí kyslíková léčba.
Transplantace plic je krajním řešením u pacientů, kteří nemají naději, že budou žít víc jak 2 roky. Indikována je při nemožnosti ovlivnit průběh klasickou léčbou, poklesu FEV1 pod 30 a na přání nemocného. Většinou se provádí bilaterální sekvenční transplantace plic od kadaverózních dárců. Začíná se transplantovat plicní laloky od žijících příbuzných (2 dárci – vždy půl plíce od každého). 70–80 % přežívá první rok po transplantaci, 50–55 % přežívá 5 let. Většině pacientů se po transplantaci výrazně zlepší kvalita života.
Důležitá je péče o dobrý stav výživy, a to jíž od prvních dnů stanovení diagnózy. Nemocný potřebuje o cca 40 % více energie (z toho 35–45 % mají hradit tuky, hlavně rostlinné). Důraz je kladen na vydatné snídaně a svačiny, druhé večeře, dostatečný přívod tekutin a solí. Pokud se stav neupravuje perorálně, volíme nazogastrickou sondu nebo perkutánní gastrostomii. Podáváme vitaminy rozpustné v tucích (vitamin K – do jednoho roku věku podáváme 2–5 mg týdně). Pankreatická substituce v podobě mikrotablet obalených acidorezistentní vrstvou, které se rozpouštějí až v distálním duodenu – obsahují různé koncentrace pankreatických enzymů (hlavně lipázu). Léky podáváme před každým jídlem (s výjimkou ovoce).
Prognóza se v posledních desetiletích výrazně zlepšila. Délku přežití určuje rychlost progrese plicního postižení. Dnes narození mají naději přežít 40 let.
V posledních letech je velmi významná léčba pomocí CFTR modulátorů !
Zajímavost
Relativně vysoký výskyt mutací G551D a CFTRdel21kb genu CFTR u pacientů s cystickou fibrózou v České republice může souviset se zastoupením potomků slovanského respektive keltského etnika v současné české populaci.[18] [19] Mezi lingvisty a historiky, kteří nenacházejí oporu pro takovou interpretaci genetických výzkumů ve svých disciplínách, vládne vůči výše popsaným interpretacím spíše skepse.[20]
Odkazy
Reference
- ↑ DORT, Jiří, et al. Neonatologie : vybrané kapitoly pro studenty LF. 1. vydání. Praha : Karolinum, 2005. ISBN 80-246-0790-5.
- ↑ a b c d e f g h i j k l m GOMELLA, TL, et al. Neonatology : Management, Procedures, On-Call Problems, Diseases, and Drugs. 6. vydání. Lange, 2009. s. 416-421. ISBN 978-0-07-154431-3.
- ↑ a b c HAVRÁNEK, Jiří: Respirace
- ↑ KANTOR, L. DOPORUČENÁ INDIKAČNÍ KRITÉRIA PRO RSV PROFYLAXI (SYNAGIS) U NOVOROZENCŮ [online]. Česká neonatologická společnost, ©2014. [cit. 2020-10-18]. <http://www.neonatology.cz/upload/www.neonatology.cz/soubory/synagis-kriteria-2014.pdf>.
- ↑ DORT, J a E DORTOVÁ. Dlouhodobé zkušenosti s využitím domácí oxygenoterapie v léčbě nedonošených dětí s bronchopulmonální dysplázií. Pediatrie pro praxi [online]. 2009, roč. 10, vol. 2, s. 114-117, dostupné také z <http://www.solen.cz/pdfs/ped/2009/02/13.pdf>. ISSN 1803-5264.
- ↑ MCSHANE, Pamela J, Edward T NAURECKAS a Gregory TINO, et al. Non-cystic fibrosis bronchiectasis. Am J Respir Crit Care Med [online]. 2013, vol. 188, no. 6, s. 647-56, dostupné také z <https://www.ncbi.nlm.nih.gov/pubmed/23898922>. ISSN 1073-449X (print), 1535-4970.
- ↑ HILL, Adam T, Mark PASTEUR a Charles CORNFORD, et al. Primary care summary of the British Thoracic Society Guideline on the management of non-cystic fibrosis bronchiectasis. Prim Care Respir J [online]. 2011, vol. 20, no. 2, s. 135-40, dostupné také z <https://www.ncbi.nlm.nih.gov/pubmed/21336465>. ISSN 1471-4418 (print), 1475-1534.
- ↑ KOLEKTIV, Marek. Farmakoterapie vnitřních nemocí - 4. zcela přepracované a doplněné vydání. - vydání. Grada Publishing a.s., 2010. 777 s. s. 170. ISBN 9788024726397.
- ↑ BENEŠ, Jiří. Studijní materiály [online]. [cit. 2010]. <http://jirben.wz.cz>.
- ↑ ČEŠKA, Richard, et al. Interna. 1. vydání. Praha : Triton, 2010. 855 s. ISBN 978-80-7387-423-0.
- ↑ VAŠÁKOVÁ, Martina. Léčba idiopatické plicní fibrózy. Remedia [online]. 2012, roč. 2012, vol. 2, s. 398-402, dostupné také z <http://www.remedia.cz/Clanky/Farmakoterapie/Lecba-idiopaticke-plicni-fibrozy/6-L-1oN.magarticle.aspx>. ISSN 0862-8947.
- ↑ BENEŠ, Jiří. Studijní materiály [online]. [cit. 11.3.2010]. <http://jirben.wz.cz>.
- ↑ DÍTĚ, P., et al. Vnitřní lékařství. 2. vydání. Praha : Galén, 2007. ISBN 978-80-7262-496-6.
- ↑ TUČEK, Milan, Miroslav CIKRT a Daniela PELCLOVÁ. Pracovní lékařství pro praxi : Příručka s doporučenými standardy. 1. vydání. Praha : Grada Publishing, 2005. s. 69-70. ISBN 80-247-0927-9.
- ↑ http://genet.sickkids.on.ca/cftr/StatisticsPage.html
- ↑ prof. HAMPL Trávení, sekrece a abropce https://youtu.be/RcxrMK1cZsE?t=1572
- ↑ [1]
- ↑ MACEK, Milan, Milan jr MACEK a Alice KREBSOVÁ, et al. Relativně vysoký výskyt mutací G551D a CFTRdel21kb CFTR genu v České republice u pacientů s cystickou fibrózou objektivně prokazuje, že naše populace je slovanského a keltského původu [online]. [cit. 2011-02-05]. <http://www.lf2.cuni.cz/Ustavy/ublg/pdf/kelticz99.pdf>.
- ↑ MACEK, Milan jr, et al. Population study of the CFTR gene mutations in Bohemia and Moravia: hypothesis on the historical spread of the G551D and F508 mutations in Europe. American Journal of Human Genetics. 1991, roč. 49, vol. Suppl. A 2703, s. -, ISSN 0002-9297.
- ↑ VENCLOVÁ, Natalie a Petr DRDA, et al. Archeologie pravěkých Čech : 7, Doba laténská. 1. vydání. Praha : Archeologický ústav AV ČR, 2008. 164 s. ISBN 978-80-86124-80-3.


