Stopové prvky
Stopové prvky (mikroelementy) se ve tkáních nacházejí v koncentraci nižší než 50 ppm (<50 × 10−6 g/g). Jejich potřebný denní příjem je menší než 50 mg denně.[1] Hlavní prvky – Fe, I, Cu, Zn, Co, Cr, Mo, Se, F, Mn, Ni, As, Sn, Si, V.
- jsou esenciální – tělo si je nedokáže samo vytvořit a je závislé na jejich příjmu potravou;
- jejich nedostatek nebo nadbytek způsobuje zdravotní problémy.
Hlavní biochemickou úlohou stopových prvků je katalytické působení v enzymech a modulace enzymových aktivit. Také mají velký význam v ochraně před oxidačním stresem (SOD potřebuje Mn, Cu a Zn).
Při reakci akutní fáze IL-1 a IL-6 způsobí redistribuci stopových prvků (pokles Zn a Fe v séru).
Toxicita − u zdravých jedinců je velká tolerance v koncentračním rozmezí. U renálních poruch se může hůře vylučovat Se a Cr, Cu a Mn zase u jaterních chorob.
Stanovují se metodou atomové absorpční spektrofotometrie.
Železo
Železo je jedním z nejdůležitějších prvků v lidském organismu. V těle dospělého člověka je obsaženo více než 70 mmol (4,0–4,5 g) železa. U žen je toto množství nižší než u mužů, což se přičítá ztrátám krve při menses.
| Forma | Funkce | Protein | Množství v g |
|---|---|---|---|
| Aktivní železo | transport kyslíku | hemoglobin | 2,5–3,0 |
| myoglobin | 0,3 | ||
| přenos elektronů | cytochromy, cytochromoxidáza | 0,2 | |
| rozklad peroxidu vodíku | kataláza, peroxidáza | ||
| Zásobní železo | feritin, hemosiderin | 0,8–1,0 | |
| Transportní železo | transferin | 0,003 | |
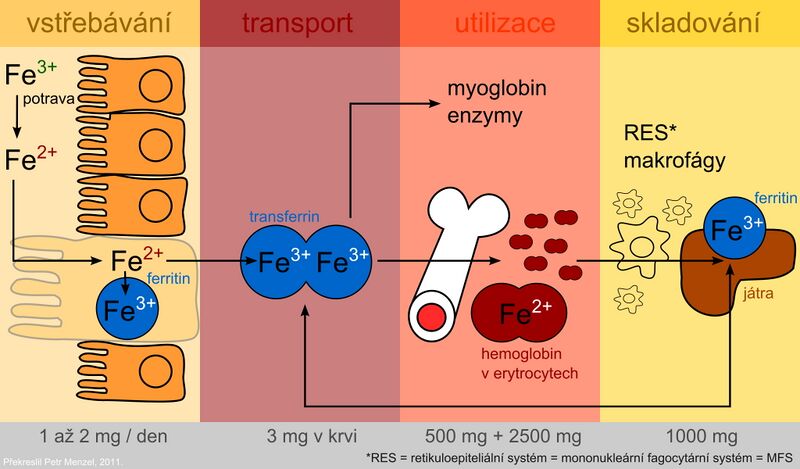
Metabolismus železa
Přítomnost železa je nezbytná pro funkci buněk. Jako součást hemu se účastní transportu kyslíku a jako součást cytochromů podmiňuje přenos elektronů v dýchacím řetězci. Nežádoucím účinkem železa jako přechodného a velmi reaktivního prvku je účast v radikálových reakcích, při nichž vznikají tzv. reaktivní formy kyslíku. Ty mohou poškozovat buněčné membrány, proteiny a DNA.
Železo se absorbuje jako Fe2+ aktivním transportem v duodenu a v horní části jejuna, a to dvěma způsoby:
- na porfyrin vázané Fe ve formě stabilního lipofilního komplexu;
- FeII+ – cheláty rozpustné ve vodě.
Jen nepatrná část se vstřebává v ionizované formě.
Ve stravě bývá průměrně 10–50 mg železa za den, ale vstřebá se pouze 10–15 %. Ve sloučeninách hemu (maso) se absorbuje lépe, nehemové Fe v rostlinné stravě mnohem hůře. Kromě toho rostliny obsahují oxaláty, fytáty, taniny a jiné fenolické sloučeniny, jež tvoří s Fe nerozpustné nebo chelátové komplexy, které se těžko vstřebávají. Askorbová kyselina na druhé straně absorpci železa zlepšuje.
Po vychytání střevní mukózou se část železa inkorporuje do zásobní formy – feritinu v intestinálních buňkách. Část absorbovaného železa přestupuje do plazmy, kde je transportováno ve vazbě na transferin. Důležitou roli při přenosu železa přes bazolaterální membránu enterocytů má protein ferroportin (nachází se i v membráně makrofágů a hepatocytů). Je to hlavní místo regulace homeostázy železa v organismu. Klíčovým faktorem regulace je protein hepcidin, který je syntetizován v játrech. Vazbou na ferroportin inhibuje transport železa z buněk a tím přispívá k jeho sekvestraci v nich. Hladina hepcidinu se zvyšuje při zánětu. Hepcidin je částečně zodpovědný i za anémii chronických chorob. Mutace genu pro hepcidin vedou k juvenilní hemochromatóze typu 2B.
Plazmatické železo je zachycováno buňkami cílových tkání prostřednictvím receptoru pro transferin a buď je zabudováno do hemu nebo uloženo do zásoby ve formě feritinu. Využití specifické transportní bílkoviny transferinu a zásobního proteinu feritinu pro uskladnění železa představuje ochranné mechanismy, které mají zamezit toxickému působení oxidoredukčně aktivního železa.
Při deskvamaci odumřelých slizničních buněk odchází nezužitkované železo stolicí spolu s nevstřebaným železem.
Metabolismus železa - YouTube video
Vyšetření metabolismu železa
V praxi se běžně setkáváme s onemocněními spojenými se změnami metabolismu a utilizace železa. Laboratorní vyšetření metabolismu železa zahrnuje následující vyšetření:
- železo v séru
- sérový transferin a vazebná kapacita pro železo
- sérový feritin
- transferinový receptor
Uvedené parametry jsou důležitými diagnostickými ukazateli pro průkaz poklesu či nárůstu zásob železa ještě ve stádiích, která nejsou doprovázena výraznými klinickými projevy.
Stanovení železa v séru
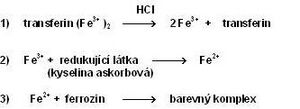
Pro stanovení železa v séru se používají kolorimetrické metody, atomová absorpční spektrofotometrie a další speciální techniky. Nejužívanější jsou fotometrické metody, založené na reakci železa s komplexotvornou látkou. Všechny postupy zahrnují následující kroky:
- Uvolnění Fe3+ z vazby na transferin pomocí kyselin nebo tenzidů (např. HCl).
- Redukce Fe3+ na Fe2+, která je nezbytná pro reakci s komplexotvorným činidlem. K redukci se používá např. kyselina askorbová.
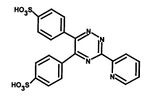
- Reakce Fe2+ s komplexotvorným činidlem obsahujícím reaktivní skupiny –N=C–C=N– za vzniku barevného komplexu. Ionty kovu vytvářejí cheláty s dvěma atomy dusíku. V současnosti se využívají především dvě komplexotvorné látky – bathofenentrolin a ferrozin (3-(2-pyridyl)-5,6-bis(4-sulfofenyl)-1,2,4-triazin – PST, chráněný název FerroZine®), který má vyšší absorpční koeficient a je lépe rozpustný ve vodě.
- Hodnocení
- Koncentrace sérového železa podléhají cirkadiánnímu rytmu a jsou ovlivněny i dalšími faktory. To omezuje diagnostický význam tohoto parametru. Je špatným ukazatelem tkáňových zásob železa a je nutné ho vždy posuzovat v kombinaci se sérovým transferinem a vazebnou kapacitou pro železo. Snížené koncentrace doprovázejí nedostatek železa, způsobený např. velkými nebo opakovanými krevními ztrátami, nedostatečným příjmem železa potravou nebo narušenou absorpcí. Nález není specifický, neboť se sníženými hladinami se setkáváme rovněž u akutní infekce nebo chronických zánětlivých onemocněních (přesun železa do tkání). Vysoké hladiny železa se vyskytují u hemochromatózy (viz níže), při předávkování nebo intoxikaci železem, při zvýšeném rozpadu erytrocytů a u některých jaterních onemocnění.
- Referenční hodnoty
- muži: 9–29 μmol/l
- ženy: 7–28 μmol/l
Sérový transferin a vazebná kapacita pro železo
Železo je transportováno krví ve vazbě na specifický protein s β1-elektroforetickou pohyblivostí – transferin, který je syntetizován v játrech. Rychlost jeho tvorby je nepřímo úměrná zásobám železa v organismu; zvyšuje se při nedostatku železa a při nadbytku klesá. Biologická funkce transferinu spočívá ve schopnosti snadno tvořit netoxické komplexy se železem a přenášet Fe absorbované sliznicí tenkého střeva do kostní dřeně nebo do zásobních forem (feritinu nebo hemosiderinu). Každá molekula transferinu váže dva atomy Fe3+ (1 g transferinu váže 25,2 μmol železa). Transferin může být stanoven přímo pomocí imunochemických metod nebo nepřímo jako schopnost transferinu vázat železo – tzv. vazebná kapacita pro železo. Celková vazebná kapacita pro železo (TIBC – total iron binding capacity) je množství železa, které je transferin schopen vázat v případě, že všechna vazebná místa jsou obsazena. Obvykle je železem nasycena pouze 1/3 transferinu – vázaná kapacita. Volný transferin bez navázaného železa představuje volnou vazebnou kapacitu (2/3 transferinu), která je k dispozici pro transport železa při zvýšených požadavcích.
Přepočet mezi koncentrací transferinu a celkovou vazebnou kapacitou:
- Celková vazebná kapacita [μmol/l] = transferin [g/l] · 25,2.
Referenční rozmezí pro koncentraci transferinu v séru (S-transferin) je 2,0–3,6 g/l a pro celkovou vazebnou kapacitu je 50–70 μmol/l.
Saturace transferinu
Z hodnot koncentrace železa a transferinu můžeme vypočítat saturaci transferinu (TfS), která je definována jako poměr sérové koncentrace železa k celkové vazebné kapacitě transferinu pro železo. Jedná se o citlivý parametr pro odhalení latentního nedostatku železa.
- Hodnocení saturace transferinu
- fyziologické hodnoty: 25–50 %
- snížení saturace při nedostatku železa: < 15 %
- zvýšení saturace při nadbytku železa: > 50 %
Feritin a hemosiderin
Feritin je nejdůležitější zásobní protein pro železo. Molekula feritinu je přizpůsobena vázat velké množství Fe3+ v rozpustné a netoxické formě pro organismus. Feritin je tvořen vnějším proteinovým obalem z 24 podjednotek – apoferitinem (Mr 440 000), ohraničujícím dutinu, ve které může být soustředěno až 4500 atomů železa ve formě oxyhydroxidu železitého (FeO·OH)n v mikrokrystalické podobě s fosfáty (FeO·OPO3H2). Vstup a výstup atomů železa umožňují póry mezi jednotlivými podjednotkami obalu molekuly feritinu. Normálně je jeho kapacita využita asi z 20 %. Ukládá se do buněk v játrech, slezině a střevní sliznici.
V krevním séru se feritin nachází ve velmi nízké koncentraci. Sérové koncentrace feritinu jsou měřítkem zásob železa v organismu. Nízké koncentrace indikují vyčerpání celkové tělesné rezervy železa a slouží k časnému odhalení anémie z nedostatku železa ještě v prelatentní fázi. Zvýšené koncentrace feritinu jsou doprovodným jevem vysokých tkáňových zásob železa. Dále se s nimi setkáváme u mnohých pacientů s onemocněním jater, některými maligními nádory (nádorový marker) nebo zánětlivými onemocněními (pozitivní reaktant akutní fáze).
Referenční rozmezí pro koncentraci feritinu v séru (S-feritin) je pro muže 30–300 μg/l a pro ženy 20–120 μg/l.
Hemosiderin je dalším zásobním proteinem pro železo. Vzniká agregací denaturovaného feritinu s dalšími komponentami. Vytváří partikule o velikosti 1 až 2 μm, které jsou při použití barvení na železo viditelné ve světelném mikroskopu. Hemosiderin obsahuje větší množství železa než feritin, ale vzhledem ke špatné rozpustnosti ve vodě je obtížně dostupné. Tvoří se za situace, kdy množství železa v organismu převýší skladovací kapacitu feritinu.
Transferinový receptor
Železo transportované krví transferinem je zachycováno buňkami prostřednictvím specifického transferinového receptoru (TfR). V určitém stádiu vývoje se nachází na povrchu všech buněk, nejvíce je však exprimován na povrchu prekursorů buněk červené řady v kostní dřeni. TfR je transmembránový protein, který je tvořen dvěma identickými podjednotkami, spojenými disulfidovou vazbou. Oddělením extracelulárních domén receptoru se do cirkulace uvolňuje tzv. solubilní (rozpustná) frakce transferinového receptoru (sTfR), který může být v podobě dimeru nebo monomeru. Buňky reagují na snížení zásob železa syntézou zvýšeného množství transferinových receptorů.
Zvýšení sTfR je spolehlivým ukazatelem nedostatku železa pro krvetvorbu. Se zvýšenými hladinami sTfR se setkáváme u anemií z nedostatku železa nebo u hemolytických anemií. Cenné je stanovení sTfR u anemických pacientů, u nichž je zvýšen feritin z důvodů reakce akutní fáze. Stanovení koncentrace sTfR je možno využít i u pacientů s transplantovanou kostní dření pro sledování průběhu erytropoézy.
Ke stanovení se používají imunochemické metody.
Poruchy metabolismu železa
Nedostatek železa (sideropenie)
Nedostatek železa v organismu bývá zpravidla způsoben jeho nedostatečným vstřebáváním ze střeva nebo chronickými ztrátami krve. Může vyústit v sideropenickou anémii (hypochromní mikrocytární anémie), která patří mezi nejčastější hematologická onemocnění. Anémie je však zpravidla pozdní příznak postupně se vyvíjející sideropenie. V krevním obraze se projeví až po téměř úplném vymizení železa. Proto je potřebné odhalit nedostatek železa v časném stádiu, které ještě není doprovázeno anémií.
Na základě stanovení základních parametrů metabolismu železa rozlišujeme tři stupně nedostatku:
- Prelatentní nedostatek železa je označení pro stav, kdy dochází k postupnému poklesu zásob, ale ještě není ovlivněna dodávka železa do erytroblastů kostní dřeně. Asi u poloviny nemocných jsou hladiny feritinu v séru snížené pod 12 μg/l.
- Při latentním nedostatku železa jsou jeho zásoby v podstatě vyčerpány. Feritin je snížen pod dolní hranici normy a je v tomto stádiu již doprovázen i snížením hladiny železa v séru a sníženou dodávkou do erytroblastů kostní dřeně. Zvyšuje se vazebná kapacita pro železo. Citlivým ukazatelem latentního nedostatku železa je pokles saturace transferinu pod 15 %. Nerozvíjí se však ještě anémie.
- Při manifestním nedostatku železa dochází k rozvoji anémie s poklesem hodnot hemoglobinu pod dolní hranici normy. U anémie z nedostatku železa je typický nález nízkého sérového železa a feritinu, je zvýšená koncentrace transferinu (vazebná kapacita pro železo). U hemolytických anémií nebo při nadbytku železa je naopak sérové železo zvýšené, současně je snížená celková vazebná kapacita pro železo.
| Prelatentní nedostatek železa | Latentní nedostatek železa | Manifestní nedostatek železa |
|---|---|---|
| snižování zásobního železa – pokles feritinu | nedostatek zásobního železa – pokles feritinu | nedostatek zásobního železa – pokles feritinu |
| snížení sérového železa | snížení sérového železa | |
| pokles saturace transferinu pod 15 % | pokles transferinu pod 10 % | |
| zvýšení celkové vazebné kapacity pro železo | zvýšení celkové vazebné kapacity pro železo | |
| zvýšení sTfR | zvýšení sTfR | |
| snížení koncentrace hemoglobinu – anémie |
Nadbytek železa
Organismus není vybaven exkreční cestou pro železo, a proto se za určitých okolností může přebytečné železo hromadit ve tkáních. Včasná diagnostika může zabránit poškození tkání nadbytkem železa. Přetížení železem se rozvíjí většinou velmi pomalu. Rozlišujeme 3 stádia:
- Ve stádiu prelatentního nadbytku železa se zvyšuje jeho obsah v orgánech, ale bez překročení jejich zásobní kapacity.
- V období latentního stádia přetížení železem je překročena zásobní kapacita buněk, ale ještě není poškozena funkce orgánů, zvyšuje se hladina feritinu i hladina železa v séru a stoupá saturace transferinu nad 55 %.
- Ve fázi manifestního nadbytku železa jsou již poškozeny některé orgány.
| Prelatentní nadbytek železa | Latentní nadbytek železa | Manifestní nadbytek železa |
|---|---|---|
| zvyšování zásob železa – zvýšení feritinu | zvyšování zásob železa – zvýšení feritinu nad 300 μg/l | zvyšování zásob železa – zvýšení feritinu (při těžkém postižení nad 2000 μg/l) |
| zvýšení železa v séru | výrazné zvýšení železa v séru | |
| zvýšení saturace transferinu nad 55 % | zvýšení saturace transferinu (při těžkém postižení může převýšit 90 %) |
Hemochromatóza
Hromadění železa v tkáních souvisí s onemocněním, které označujeme jako hemochromatóza.
- Primární hemochromatóza je dědičné onemocnění způsobené zvýšenou resorpcí železa ze střeva. Přebytečné železo se ukládá v parenchymatózních orgánech jako jsou játra, srdce, pankreas, nadledviny. V postižených orgánech působí toxicky a narušuje jejich funkci tím, že může katalyzovat chronické reakce vedoucí k tvorbě volných radikálů. Hlavními klinickými projevy jsou hyperpigmentace kůže, hepatosplenomegalie a diabetes mellitus.
- Sekundární hemochromatóza se může vyvinout jako následek např. opakovaných transfúzí, nadbytečného příjmu přípravků obsahujících železo nebo hemolytické anémie. V biochemickém obraze nalézáme zvyšující se hladiny feritinu a železa v séru, stoupá saturace transferinu při jeho současném poklesu.
Otrava železem
Náhodné požití většího množství přípravků hrozí dětem (tablety podobné lentilkám). Smrtelná dávka pro dítě je 600 mg. Pro dospělého je příjem železa 40 mg/ kg toxikologicky závažný, příjem 60 mg/kg je smrtelný[2].
Příznaky zahrnují nevolnost, zvracení (i zvracení krve), bolesti břicha, průjem (někdy krvavý). Velké ztráty tekutin jsou příčinou šoku, selhání ledvin a smrti. Pokud nemocný přežije tuto fázi otravy, může po 12 hodinách upadnout do bezvědomí, křečí a jaterního selhání. Přežije-li i tuto druhou fázi, otrava může zanechat trvalé následky (poškození střeva).
- Léčba akutní otravy
- Výplach žaludku.
- Nasogastrální sondou podat chelační činidlo deferoxamin
 (5–10 g do 50–100 ml vody).
(5–10 g do 50–100 ml vody). - Zvážit intravenózní podání desferoxaninu k vyvázání vstřebaného železa. V moči se objeví růžově červený komplex deferoxaminu se železem. Léčbu je třeba opakovat do té doby, než se barva moči vrátí k normě[2].
Jód
Jód se podílí na tvorbě hormonů štítné žlázy.
Zdroj
Zdrojem jódu jsou hlavně mořské ryby a jejich produkty a jodidovaná sůl. V ČR se jodiduje sůl v množství 20–34 mg/kg soli ve formě jodidu nebo jodičnanu. Obsah jódu v rostlinných a živočišných potravinách závisí na obsahu jódu v půdě a jeho dodávkách hospodářským zvířatům. Mléko a vejce bývají dobrým zdrojem jódu. Část jódu se kuchyňskou úpravou ztrácí.
Doporučená denní dávka pro dospělé se pohybuje mezi 150 a 200 μg (liší se podle země a věku).[1]
Na vzniku onemocnění z nedostatku jódu se mohou rovněž podílet strumigeny, které patří mezi antinutriční látky. Strumigeny můžeme dělit podle druhu jejich působení:
- Strumigeny I. řádu – znemožňují uchycení jódu (thiokyanid, dusičnany, polysulfidy ze zelí).
- Strumigeny II. řádu – blokují peroxidázy, které přeměňují jód (ředkvičky, cibule, hrách, rajčata, špenát).
- Strumigeny III. řádu – blokují tvorbu tyroxinu (sulfonamidy).
- Strumigeny IV. řádu – kompetitivně vytěsňují tyroxin, inhibují sekreci TRH.
Nedostatek jódu
Projevy, kterým lze zabránit dostatečným příjem jodu označuje WHO jako poruchy z nedostatku jódu. (Iodine deficiency disorders – IDD). Tento termín byl zvolen ke zdůraznění, že tento problém je daleko širší než pouhá struma a kretenismus, klasické a nejvíce viditelné příznaky deficitu jódu. Spektrum poruch z nedostatku jódu se liší podle jeho závažnosti a podle věku. Patří mezi ně mírnější poruchy mentálních funkcí, opoždění fyzického vývoje, snížení plodnosti, zvýšení mrtvorozenosti a perinatální úmrtnosti.[3].
Nejkritičtější perioda je od 2. trimestru těhotenství do koncem 3. roku života. Pro rozvoj mozku je potřebná normální hladina hormonů štítné žlázy, aby došlo ke správné myelinizaci axonů. V oblastech s deficitem jódu, kde je hladina hormonů štítné žlázy nízká, je vývoj mozku poškozen. Důsledkem nejzávažnějšího poškození je rozvoj kretenismu, ale na úrovni populace jsou daleko závažnější méně vážné stupně postižení a snížená kognitivní kapacita, která postihuje celou populaci. Jako výsledek jsou mentální schopnosti „normálních“ dětí i dospělých žijících v oblastech s deficitem jodu nižší než tam, kde se deficit nevyskytuje – až o 13,5 bodů IQ stupnice.[3]
Ve světě patří poruchy z nedostatku jódu mezi nejrozšířenější malnutrice.
Hodnocení stavu zásobení populace jódem
Do 90. let minulého století se jako primární indikátor výskytu deficitu jódu v populaci užívala prevalence strumy. Později se stalo metodou volby hodnocení a monitorování stavu zásobení populace jódem exkrece jódu močí – citlivý ukazatel nedávného příjmu jódu. Pokud je potřeba detailnější informace, zjišťují se hladiny TSH. Koncentrace plasmatické TSH a thyroidálních hormonů: TSH a plasmatický trijódothyronin (T3) se u deficitu typicky zvyšují, zatímco plasmatický tyroxin (T4) klesá. Nicméně tyto změny se mohou projevit až při závažném deficitu. Nejčastěji se hodnotí školní děti, jejichž stav obvykle odráží stav celkové populace.[3]
Nadbytek
Struma vyvolaná nadbytkem jodu, thyreotoxická krize nebo akné byly popsány po překročení doporučené dávky příjmu jodu o několik řádů. I chronicky vysoký příjem jodu, např. z léků obsahujících jod nebo desinfekčních látek, může vést k vývoji strumy.
Tolerovatelná horní hranice dlouhodobého příjmu jodu pro dospělé je podle EU 600 μg/den.[4]
Zinek
Zinek je potřebný k aktivitě více než 200 Zn-dependentních metaloenzymů (karboanhydráza, alkoholdehydrogenáza, LDH, ALP, superoxiddismutáza aj.), nutný pro syntézu DNA a pro funkci některých bílkovin, které se na DNA váží (viz zinkové prsty) → deficit postihuje růst, hojení, nedostatek u plodu způsobuje např. rozštěp páteře. Zinek je součástí superoxiddismutázy, tvoří strukturální i funkční složku biologických membrán, stabilizuje struktury RNA, DNA a ribosomů. Zn je nutný pro buněčnou proliferaci, buněčné imunitní reakce, stabilizaci komplexu hormon-receptor. Je potřebný pro správnou funkci gonád mužů.
Zdroj
Zinek je hojně zastoupen v mase a jiných potravinách bohatých na bílkoviny, celozrnných obilovinách, luštěninách, kořenové zelenině. Je lépe využitelný z živočišných než z rostlinných potravin, ze kterých se hůře vstřebává pro obsah fytátů, vlákniny a některých dalších látek [5].
Absorpce zinku závisí na jeho příjmu a zásobení těla zinkem – při jeho vysokém příjmu se absorpce snižuje a zvyšuje se exkrece do střeva a naopak, při nízkém příjmu se zvyšuje absorpce a snižuje exkrece do střeva. Zn není na rozdíl od Cu a Fe skladován v játrech. Asi 10 % je vylučováno močí, ostatní část se dostává prostřednictvím pankreatického sekretu do žluče.
Doporučená denní dávka pro dospělé muže je 10 mg a pro ženy 7 mg [1]
Deficit
Nedostatek Zn může být podmíněn geneticky nebo získán primárně (tj. nevhodnou dietou) nebo sekundárně (tj. podmíněn určitou chorobou vedoucí kupř. k nedostatečnému vstřebávání).
Deficit zinku může být způsobený jeho nedostatečným příjmem. Zinek se také špatně vstřebává z potravy bohaté na fytáty, vlákninu a další látky, protože tyto látky brání jeho využití. K deficitu zinku mohou také přispívat ztráty během průjmových onemocnění, malabsorbční syndromy a parazitární onemocnění. Nedostatek Zn patří mezi nejrozšířenější malnutrice ve světě.
Pro hodnocení stavu zásobení populace zinkem je nejrozšířenější metodou stanovení koncentrace zinku v plasmě. Tento ukazatel ale může být ovlivněn řadou faktorů. Za dostatečnou je řádově považována koncentrace 10 μ/l.
Příznaky nedostatku[6]
Acrodermatis enteropathica [7] (Danboltova choroba) je geneticky podmíněná porucha absorpce Zn, pravděpodobně pro defekt ligandu, který normálně usnadňuje absorpci Zn ve střevě. Vyvíjí se po narození, krátce po přechodu na umělou výživu. Klinickými projevy jsou progresivní bulózně-pustulózní dermatitida ve spojení s paronychií a generalizovanou alopecií; často jsou přítomny i oční příznaky (blepharitis, fotofobie a rohovkový zákal). Gastrointestinální příznaky zahrnují chronický průjem, malabsorpci, steatoreu, intoleranci laktosy. Dále jsou příznaky neuropsychické, opožděný růst, hypogonadismus a zvýšená náchylnost k infekcím. Biochemický nález vykazuje sníženou resorpci Zn ve střevě, ale normální vylučování ve faeces, moči a potu. V plazmě je výrazné snížení Zn. Terapeuticky je účinné podávání dijodhydroxychinolinu, který se Zn tvoří dobře vstřebatelný komplex.
Již mírný nedostatek zinku vede k poruše imunity a vyšší morbiditě a mortalitě na infekční onemocnění. Projevuje se také opožděním růstu, neprospíváním, hypogeusií (porucha chuti) a patrně atrofií thymu. Deficit zinku je častý u seniorů, zvláště hospitalizovaných a může se projevovat špatným hojením ran.
Výrazný deficit zinku by popsán v roce 1961 v Iránu u mladých mužů a projevoval se opožděním růstu, hypogonadismem, opožděním sexuálního zrání, hepatosplenomegalií a anemií.
Výrazný deficit zinku se také může vyskytnout u pacientů na parenterální výživě bez zinku a projevuje se alopecií, diarrhoeou, kožními lésemi a anorexií. Pokud není podán zinek, pacienti umírají na interkurentní infekci (např. diarrhoea).
U těhotných žen je výrazný deficit zinku spojen s vrozenými vadami jejich dětí a spontánními potraty. Mírný deficit je spojen s opožděním růstu plodu, nízkou porodní hmotností a porodními komplikacemi.
Deficit zinku u matek a v časném kojeneckém věku může mít negativní vliv na neuromotorický vývoj dítěte.
Léčba zinkem
Kontraindikace léčby zinkem – autoimunitní onemocnění, poruchy ledvin, gravidita, laktace.
Toxicita
Akutní otrava Zn způsobuje průjem, zvracení, nevolnost, svalové bolesti a horečku. Může být způsobena iatrogenně (infúze, kontaminace během hemodialýzy). Perorální podávání Zn může vést ke gastrointestinálním obtížím, ulceracím žaludeční sliznice. Vysoké dávky Zn mohou způsobit deficienci Cu, protože při absorpci ve střevě Zn kompetuje s Cu. To může vést k anemii z nedostatku Cu.
Otravy:
- choroby z povolání – horečka ze zinkových par u slévačů kovů – kovová chuť v ústech, dráždivý kašel, bolesti svalů
- podráždění dýchacích cest, bronchopneumonie až edém plic
- kožní ulcerace
- po požití – letargie
- při poklesu v plazmě nemusí jít o snížení jeho zásob v těle
Měď
Měď je nezbytná pro správnou funkci každé buňky v organismu, hlavní funkce je v oblasti krvetvorby (ceruloplasmin), ceruloplasminová oxidázová aktivita v plasmě je esenciální pro oxidaci Fe2+ na Fe3+ → mobilizace Fe a zabudování do hemu.
- Je součástí dýchacích a antioxidačních enzymů;
- má význam při tvorbě vlasů a pigmentů;
- je důležitá pro správný průběh imunitních reakcí;
- lysyloxidáza je nutná k zesíťování kolagenu a elastinu.
Měď se resorbuje, váže se na albumin a v játrech je vestavěna do ceruloplasminu. Hlavní vylučování – žlučí. Nutriční deficit je vzácný, spíše jako součást malnutricí. Funkce mědi je úzce spjata s funkcí zinku (optimální poměr Zn:Cu = 7:1, kdy oba stopové prvky působí synergicky). Zdrojem mědi jsou vejce, maso, luštěniny. Doporučená denní dávka měď je 2–2,5 mg.
Příznaky nedostatku
Získaný deficit
- Mikrocytární, hypochromní anémie, leukopenie, osteoporóza;
- anémie nereaguje na podání Fe, snížen ceruloplasmin;
- citlivější ukazatel – pokles aktivity Zn, Cu-SOD v erytrocytech;
- poruchy imunity;
- poruchy růstu vlasů a nehtů.
Vrozený deficit
Menkesova choroba (trichopoliodystrophia, „kinky-hair“ syndrom) je dědičně založené onemocnění vázané na chromosom X, které je způsobeno mutací genu kódujícího Cu2+-transportující ATPázu. To vede k neschopnosti buněk střevní sliznice přenášet Cu přes serózní membránu do krevní cirkulace. Projeví se u kojenců mužského pohlaví už v prvních několika týdnech; postižení umírají většinou do tří let po narození. Onemocnění je charakterizováno těžce opožděným mentálním vývojem a růstem, zvláštním vzhledem vlasů (drobné kudrlinky na krátkém jemném šedavém vlasu – „kinky“ nebo „steely“ hair), skorbutickými změnami na kostech, mozkovou gliózou s cystickou degenerací, teplotní instabilitou a arteriální tortuozitou (zkrouceností). Klinické příznaky jsou následkem snížené aktivity enzymů obsahujích Cu, jako je ceruloplasmin, cytochrom c oxidáza, superoxiddismutáza, lysyloxidáza, dopamin-β-hydroxyláza (DBH). V biochemickém nálezu je výrazné snížení hladiny mědi v plasmě, snížení S-ceruloplasminu, snížení obsahu Cu ve tkáních i ve vlasech, výjimkou je duodenální sliznice, která obsahuje abnormálně zvýšené množství Cu. Vzniká anémie, obvykle hypochromní a normocytová, je neutropenie; dále osteoporóza a fraktury kostí, nepravidelnosti v tvorbě metafýzy. V patogenetickém mechanismu choroby hraje pravděpodobně hlavní úlohu snížená aktivita Cu-metaloenzymů: lysyloxidázy (porušená biosyntéza kolagenu a elastinu vede ke změnám na kostech a cévní stěně), a dále cytochrom c-oxidázy, dopamin-β-hydroxylázy a superoxiddismutázy, což vede k degeneraci neuronů a demyelinizaci mozkové tkáně. Parenterální podání Cu (hned po narození) může zabránit těžkým změnám. Snížení aktivity DBH způsobuje též rozdílnou koncentraci katecholaminů v plasmě a mozkomíšním moku: vysoká hladina DOPA, DOPAC a dopaminu, nízká hodnota dihydroxyfenylglykolu (DHPG). Zvýšený index DOPA/DHPG a DOPAC/DHPG je vhodným diagnostickým markerem Menkesovy choroby.
Toxicita a nemoci
- Měď je relativně toxická, vdechovaná – „horečka kovů“ – jako u Zn;;
- v séru – ikterus, poškození jater, ledvin, často fatální;
- Wilsonova choroba .
- Omezení inkorporace Cu do ceruloplasminu a omezené vylučování játry.
- Akumulace mědi v játrech, stoupá nevázaná měď, více jde ven ledvinami, ukládá se – do rohovky (Kayser-Fleischerův prstenec), do mozku (hlavně bazální ganglia).
- Příznaky připomínají cirhózu, je také rigidita, tremor.
Selen
Enzymy obsahující Se jsou velmi důležitými antioxidanty (glutathionperoxidáza, fosfolipidohydrogenperoxid-glutathionperoxidáza), účinkují při metabolismu hormonů štítné žlázy.
Zdroj
Zdrojem selenu jsou cereálie pěstované na půdách bohatých na selen, mořské produkty. Doporučená denní dávka selenu je: 1 mg/kg; 50–200 μg/den. Působí pozitivně na imunitní systém (při nedostatku selenu se snižuje stimulace lymfocytů, klesá aktivita NK-buněk, klesá tvorba interferonu).
Má antikancerogenní účinky (je součástí antioxidačního enzymu glutathion-peroxidázy, která se uplatňuje v prevenci poškození vyvolaných volným kyslíkem a peroxidovými radikály viz oxidačný stres). Podporuje zrání a motilitu spermií.
Selen je absorbován v duodenu, snižuje jí přísun vláknin, methioninu, Zn a Cd. Je resorbován nezávisle na jeho obsahu v organismu a vylučován především ledvinami. Není ukládán v játrech; jeho hladina v séru velmi rychle klesá, když je přísun nedostatečný.
Deficit
Deficit Se je u nás velmi častý.
Příznakem nedostatku je kardiomyopatie, vyšší výskyt kardiovaskulárních chorob, poškozená imunita, zvýšené riziko nádorového onemocnění, myopatie aj.; nedostatek selenu může mít za následek tzv. Keshanskou chorobu, což je juvenilní endemická kardiomyopatie popsaná v některých oblastech Číny. Jde o mnoholožiskovou kardiomyopatii postihující hlavně malé děti v oblastech s nedostatkem Se v půdě a pitné vodě. Kromě svalové ztuhlosti, slabosti a bolesti, dochází k depigmentaci vlasů, kůže a nehtů, k zeslabení těchto tkání.
Dlouhodobá parenterální výživa bez Se může vést k fatální kardiomyopatii. Hladina Se bývá velice snížena už dlouho před klinickými příznaky.
Hladina v těhotenství bývá nízká, protože plod kumuluje Se.
Toxicita
Toxicita Se je vzácná:
- Akutní otrava se projevuje česnekovým zápachem z úst a potu pro přítomnost dimethylselenidu.
- Chronická selenóza se projevuje vypadáváním vlasů a nehtů, kožními puchýřky, poškozením dentice.
Chrom
Biologicky aktivní je Cr3+, Cr6+ je toxický
Funkce
Trojmocná forma chromu se uplatňuje jako glukozotoleranční faktor. Stimuluje účinek inzulínu a zvyšuje glukozovou toleranci. U zdravých lidí zvyšuje hladinu HDL.
Naopak profesionální expozice šestimocnému chromu má alergizující účinky a je kancerogenní.
Zdroj
Zdrojem chromu mohou být:
- kvasnice (pivovarské);
- maso;
- sýry, pšeničné klíčky a ořechy.
Doporučená denní potřeba
Doporučená denní dávka chromu je 150–200 μg.
Nedostatek
Nedostatek chromu může mít za následek:
- snížení glukozové tolerance až diabetes mellitus 2. typu;
- hyperlipidémii;
- urychlení vzniku aterosklerotických změn.
Toxicita
Toxický je hlavně šestimocný – snadno prochází membrány a pospojuje DNA → DNA-DNA crosslinks – přispívající k mutagenezi. Do organismu jde z ovzduší emisemi a poškozuje dýchací cesty, spojivku, ledviny.
Mangan
Mangan je důležitý pro strukturu kostí, funkci CNS a celé řady enzymů (pyruvátkarboxylasy, SOD, kinázy, dekarboxylázy…).
Funkce
Podílí se na procesu oxidační fosforylace, čímž zasahuje do tukového metabolismu → nejvyšší koncentrace v buňkách – v mitochondriích.
Zdroj
Zdrojem manganu jsou ovesné vločky, celozrnný chléb, čaj a kakao. Odhadovaná denní potřeba (doporučenou dávku nelze určit) je 2-3 mg[8]. Vylučuje se žlučí.
Deficit
Deficit je výjimečný, může způsobovat zvýšení hladiny krevních lipidů a s tím spojenou předčasnou aterosklerózu. Může se vyskytnout také dermatitida či trávící poruchy.
Toxicita
V 19. století se projevila u horníků – „manganové šílenství“ – psychické poruchy, parkinsonismus.
Molybden
- prvek flavoenzymů (xantinoxidáza – metabolismus purinů).
- Odhadovaná denní potřeba (doporučenou dávku nelze určit) pro dospělé je 50–100 μg. [1]
- Deficit – stoupá methionin, klesá kys. močová, nízké sulfáty v moči; z potravy se nevyskytuje – dosud byl popsán pouze po prolongované parenterální výživě.[1]
- Toxicita – málo toxický.
Kobalt
- Součást B12, je hlavně v listové zelenině, v játrech;
- má přímou úlohu při tvorbě EPO, inhibuje oxidace v kostní dřeni → po podání Co – polycytémie;
- příznaky deficitu – anémie, hubnutí, únavnost, nechutenství, zpomalení růstu.
- Toxicita
- polycytémie, hyperplázie štítnice, městnavé srdeční selhání;
- dříve se Co dával do piva kvůli pěnivosti – po delší konzumaci KMP.
Fluor
- tvorba zubů, kardiostatický, význam pro metabolismus kostí;
- zdrojem v potravě jsou mořské ryby, černý čaj;
- Adekvátní denní příjem (doporučená dávka není určena) pro dospělé je 3,2 mg pro muže a 3,1 mg pro ženy[9]
- Nedostatek fluoru zvyšuje kazivost zubů a ovlivňuje proces ukládání vápníku do kostí.
- Nadbytek:
- akutní intoxikace – spasmy, křeče, slinění, pocení.
- chronická intoxikace – mottled teeth, osteofyty, kalcifikace.
Odkazy
Související články
- Druhy potravin
- Tuky v potravě
- Sacharidy v potravě
- Bílkoviny v potravě
- Minerální látky v potravě
- Výživová doporučení
Reference
- ↑ Skočit nahoru k: a b c d e Deutsche Gesellschaft für Ernährung, Österreichische Gesellschaft für Ernährung, Sweizerische Gesellschaft für Ernährungforschung, Sweizerische Vereinigung für Ernährung. . Referenzwerte für die Nährstoffzufuhr (DACH). 1. vydání. Frankfurt am Main : Umschau/Braus, 2000. 216 s. ISBN 3-8295-7114-3.
- ↑ Skočit nahoru k: a b ŠEBKOVÁ, Sylva. Otrava železem [online]. ©2003. Poslední revize 2003-10-06, [cit. 2021-08-16]. <http://medicina.cz/clanky/5819/34/Otrava-zelezem/>.
- ↑ Skočit nahoru k: a b c ANDERSSON, M, et al. Iodine Deficiency in Europe: A continuing public health problem [online] . 1. vydání. 2007. 70 s. Dostupné také z <http://www.who.int/nutrition/publications/micronutrients/iodine_deficiency/9789241593960/en/>. ISBN 978 92 4 159396 0.
- ↑ Opinion of the Scientific Committee on Food on the Tolerable Upper Intake Level of Iodine. SCF/CS/NUT/UPPLEV/26 Final 7 October 2002 http://ec.europa.eu/food/fs/sc/scf/out146_en.pdf
- ↑ World Health Organization. . Trace elements in human nutrition and health [online] . 1. vydání. Geneva : WHO, 1996. 160 s. Dostupné také z <http://apps.who.int/iris/bitstream/10665/37931/1/9241561734_eng.pdf>. ISBN 9241561734.
- ↑ (EDITOR), Richard D. Semba. Nutrition and Health in Developing Countries. 2. vydání. Totowa : Humana Press, 2008. 931 s. ISBN 978-1-934115-24-4.
- ↑ MASOPUST, Jaroslav a Richard PRŮŠA. Patobiochemie metabolických drah. 2. vydání. Univerzita Karlova, 2004. 208 s. s. 189−190.
- ↑ BENCKO, Vladimír, et al. Hygiena – učební texty k seminářům a praktickým cvičením. 2. vydání. Praha : Univerzita Karlova, 2002. 204 s. ISBN 80-7184-551-5.
- ↑ Deutsche Gesellschaft für Ernährung, Österreichische Gesellschaft für Ernährung, Sweizerische Gesellschaft für Ernährungforschung, Sweizerische Vereinigung für Ernährung. . Referenzwerte für die Nährstoffzufuhr (DACH). 1. vydání. Frankfurt am Main : Umschau/Braus, 2000. 216 s. ISBN 3-8295-7114-3.
Použitá literatura
- BENCKO, Vladimír, et al. Hygiena – učební texty k seminářům a praktickým cvičením. 2. vydání. Praha : Univerzita Karlova, 2002. 204 s. ISBN 80-7184-551-5.
- SCHNEIDERKA, Petr, et al. Kapitoly z klinické biochemie. 2. vydání. Praha : Karolinum, 2004. ISBN 80-246-0678-X.
- MASOPUST, Jaroslav a Richard PRŮŠA. Patobiochemie metabolických drah. 2. vydání. Univerzita Karlova, 2004. 208 s.



![{\displaystyle {\mbox{Saturace transferinu}}[\%]={\frac {{\mbox{S-}}{\check {\mbox{z}}}{\mbox{elezo}}[\mu {\mbox{mol/l}}]}{{\mbox{ S-transferin }}[{\mbox{g/l}}]\times 25,2}}\times 100}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d5561698408db44cd3fac37bce267b80cb6c8529)