Aminokyseliny, peptidy, bílkoviny (1. LF UK, NT)
Aminokyseliny mají:
Peptidy
- 2-100 aminokyselin
Bílkoviny (proteiny)
- > 100 aminokyselin
Aminokyseliny
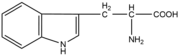
Aminokyseliny jsou základní stavební jednotky proteinů. Chemicky jsou to organické sloučeniny navzájem spojené peptidovou vazbou. V aminokyselině musí být přítomna alespoň jedna primární aminoskupina –NH2 a současně alespoň jedna karboxylová skupina –COOH. Chemicky jsou to substituční deriváty karboxylových kyselin.
- 2–100 aminokyselin (monomerů) – peptidy
- 100 a více aminokyselin – proteiny
V přírodě bylo prokázáno více než 700 různých AMK. Proto také rozdělujeme AMK dle jejich výskytu:
- aminokyseliny nacházející se ve všech živých organismech
- vázané v bílkovinách (21 proteinogenních AMK), peptidech nebo jako volné AMK
- aminokyseliny nacházející se jen v některých organismech
- vázané v peptidech nebo jako volné AMK
- nejsou složkami bílkovin
Proteinogenní aminokyseliny, nebo-li také kódované, se vyskytují v bílkovinách jako L-alfa-aminokyseliny (výjimkou je glycin). Je to dáno chemickým uspořádáním, které je nezbytné pro biogenní funkci. Konkrétní druhy aminokyselin, jejich posloupnost a prostorová struktura pak dávají proteinům jejich biologické vlastnosti.
Struktura
- aminoskupina (-NH2, volná, substituovaná)
- karboxylová skupina (-COOH)
- další funkční skupiny
Klasifikace
- dle struktury postranního řetězce a funkčních skupin
- dle polarity postranního řetězce
- polární
- nepolární
- dle významu ve výživě člověka
- esenciální = lidský organismus je není schopen vytvořit endogenně
- podmíněně esenciální = esenciální při nepřítomnosti prekurzorů či nezralosti enzymatických systémů
- plně neesenciální
- glycin, alanin, serin, cystein, kyselina asparagová a asparagin, glutamová kyselina a glutamin, selenocystein, tysorin, prolin
| Rozšířená klasifikace | |
|
| Zástupci | |
|
| Fyzikálně-chemické vlastnosti | ||||||||||
|
Peptidy
Struktura
- kondenzace (aminokyseliny -› peptidy)
- vazba některých aminokyseliny neobvyklým způsobem (Glu distální skupinou COOH = γ-peptidová vazba)
- vázány D-aminokyseliny
- vázány neobvyklé aminokyseliny
- ß-alanin (3-aminopropionová)
 , α-aminomáselná (2-aminomáselná)
, α-aminomáselná (2-aminomáselná)  , γ-aminomáselná (4-aminomáselná)
, γ-aminomáselná (4-aminomáselná)  , taurin
, taurin  , 2-aminoakrylová (dehydroalanin)
, 2-aminoakrylová (dehydroalanin)  , (E)-2-aminokrotonová (dehydrobutyrin)
, (E)-2-aminokrotonová (dehydrobutyrin)  , pyroglutamová
, pyroglutamová 
- ß-alanin (3-aminopropionová)
Klasifikace
Počet vázaných monomerů (aminokyselin)
- oligopeptidy (2–10 aminokyselin)
- polypeptidy (dříve makropeptidy, 11–100 aminokyselin)
Typ řetězce
- lineární
- cyklické
druh vazeb
- homodetní (pouze peptidové vazby)
- heterodetní (peptidové i jiné vazby)
- disulfidové -S-S-, esterové (depsipeptidy) -CO-O-R
Vázané složky
- homeomerní obsahující jen aminokyseliny
- heteromerní (peptoidy) obsahující i jiné sloučeniny
- nukleopeptidy – fosfopeptidy
- lipopeptidy – chromopeptidy
- glykopeptidy – metalopeptidy
Výskyt
- produkty metabolismu, přirozené peptidy
- produkty proteolýzy, enzymová nebo neenzymová hydrolýza
- syntetické peptidy, náhradní sladidla
Vlastnosti
- biologická aktivita
- senzorické vlastnosti
- produkty metabolismu baktérií mléčného kvašení = bakteriociny
- nisin (Streptococcus cremoris, syn. Lactococcus lactis ssp. Lactis)
- konzervační činidlo, stabilizace kysaných výrobků
Významné peptidy
Glutathion
(G-SH nebo G-S-S-G)
γ-L-glutamyl-L-cysteinylglycin (γ-amidová vazba) 
Výskyt
- mikroorganismy, rostliny, živočichové
- pšeničná mouka (10–15 mg/kg)
- maso (300–1500 mg/kg)
Funkce
- detoxikace toxických forem kyslíku
- transport (přenos) aminokyselin do buněk
- metabolické pochody (biosyntéza leukotrienu)
- stabilizace oxidačního stavu SH-proteinů (substrát peroxidas, glutathionreduktázy)
- technologie
Chorleywoodský způsob výroby bílého chleba, askorbová kyselina
- H2A + ½ O2 → A + H2O (askorbasa)
- A + 2 G-SH → H2A + G-S-S-G (glutathiondehydrogenáza)
- G-S-S-G – bez vlivu na rheologické vlastnosti těsta
- G-SH – negativní vliv (depolymerace bílkovin lepku)
- P-S-S-P + G-SH → P-S-S-G + P-SH
β-alanylhistidinové dipeptidy
Výskyt
- v mase
Funkce
- účast na kontrakci kosterního svalstva
- pufrovací kapacita svalu
- organoleptické vlastnosti
Produkty proteolýzy
- proteolýza spontánní (autolýza)
- žádoucí zrání masa (konzistence, aróma), výroba autolyzátů kvasinek (aditiva)
- nežádoucí
- proteolýza záměrná
- výroba sýrů (žádoucí konzistence, aróma)
- výroba sladu (stabilizace pěny piva)
- výroba hydrolyzátů bílkovin
- enzymové:
- sójová omáčka
- hydrolyzáty odpadních bílkovin (krve, syrovátky, kaseinů)
- kyselé: polévkové koření aj. přípravky
- enzymové:
Hořké peptidy enzymových hydrolyzátů a potravin
- hydrofobní aminokyseliny: Val, Leu, Ile, Phe, Tyr, Trp (M < 6000 Da)
Syntetické peptidy
- náhradní sladidlo Aspartam (Asp-Phe)

Bílkoviny
Bílkoviny (proteiny) neboli polypeptidy jsou organické makromolekulární látky. Jejich molekulová hmotnost přesahuje 10 000. Skládají se z aminokyselin v počtu větším než 100. Typický protein jich obsahuje 200–300.
Stavba
Aminokyseliny v peptidu jsou vzájemně vázány peptidovou vazbou. Peptidová vazba spojuje jednoduchou kovalentní vazbou aminoskupinu jedné aminokyseliny a karboxylovou skupinu druhé aminokyseliny. Hodnota Gibbsonovy energie této reakce je rovna G = 10 kJ/mol.
Polykondenzací vzniká libovolně dlouhý řetězec aminokyselin. Konec řetězce, který má volnou (nezreagovanou) aminoskupinu, se nazývá N-konec. Na opačné straně řetězce nalezneme naopak volnou karboxylovou skupinu. Tento konec se nazývá C-konec.
Struktura
Struktura proteinů vychází z uspořádání aminokyselin v řetězci. Struktura proteinů je velmi důležitá pro jejich funkci.
- Primární struktura
Primární struktura je definována přesným pořadím aminokyselin v řetězci.
- Sekundární struktura
Sekundární strukturou rozumíme prostorové uspořádání aminokyselin v řetězci a stabilizace vodíkovými můstky.
- Existují dvě základní sekundární struktury:
- α-helix: Řetězec je stočen do pravotočivé šroubovice. Délka jednoho závitu šroubovice je rovna 3,6 aminokyselinových zbytků. Strukturu α-helixu nalezneme především u vláknitých proteinů (keratinů) nebo proteinů svalových.
- β-skládaný list: Dva rovnoběžně a antiparalelně uspořádané řetězce připomínající složený list papíru.
- Terciární struktura
Terciární strukturu charakterizují další intramolekulární vazebné interakce. Například disulfidické můstky, iontové vazby a van der Waalsovy síly. V molekule mohou také vznikat další H-můstky.
- Kvarterní struktura
Kvarterní struktura vzniká u proteinů, které se skládají ze dvou a více polypeptidových řetězců. Jejich spojení zajišťují vzájemné extramolekulární vazebné interakce. Kvarterní strukturu nalezneme například v hemoglobinu. Naopak myoglobin kvarterní strukturou nedisponuje.
Denaturace proteinů
Denaturace bílkovin je proces, kdy se mění sekundární a terciární struktura. Protein tímto ztrácí biologickou aktivitu. Denaturace můžeme dosáhnout například zahřátím nebo změnou pH.
Hlavní živiny
- peptidové vazby
- jiné vazby
- disulfidové -S-S-
- esterové
- amidové
- jiné složky než aminokyseliny (fyzikálně nebo chemicky)
- voda
- anorganické ionty
- lipidy, cukry, nukleové kyseliny, barevné sloučeniny
| Klasifikace | |
|
| Maso, masné výrobky, drůbež, ryby | |
|
| Vejce | |
|
| Potraviny rostlinného původu | |
|
| Reakce | |
|
Odkazy
Související články
Externí odkazy
Zdroj
- 2. AMINOKYSELINY, PEPTIDY, BÍLKOVINY [online]. [cit. 2012-03-10]. <https://el.lf1.cuni.cz/p51525121/>.