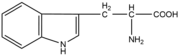
Aminokyseliny jsou základní stavební jednotky proteinů. Chemicky jsou to organické sloučeniny navzájem spojené peptidovou vazbou. V aminokyselině musí být přítomna alespoň jedna primární aminoskupina –NH2 a současně alespoň jedna karboxylová skupina –COOH. Chemicky jsou to substituční deriváty karboxylových kyselin.
- 2–100 aminokyselin (monomerů) – peptidy
- 100 a více aminokyselin – proteiny
V přírodě bylo prokázáno více než 700 různých AMK. Proto také rozdělujeme AMK dle jejich výskytu:
- aminokyseliny nacházející se ve všech živých organismech
- vázané v bílkovinách (21 proteinogenních AMK), peptidech nebo jako volné AMK
- aminokyseliny nacházející se jen v některých organismech
- vázané v peptidech nebo jako volné AMK
- nejsou složkami bílkovin
Proteinogenní aminokyseliny, nebo-li také kódované, se vyskytují v bílkovinách jako L-alfa-aminokyseliny (výjimkou je glycin). Je to dáno chemickým uspořádáním, které je nezbytné pro biogenní funkci. Konkrétní druhy aminokyselin, jejich posloupnost a prostorová struktura pak dávají proteinům jejich biologické vlastnosti.
- aminoskupina (-NH2, volná, substituovaná)
- karboxylová skupina (-COOH)
- další funkční skupiny
- hydroxylová -OH
- sulfhydrylová (merkaptoskupina) -SH
- sulfidová -S-R
- guanidylová (
 )
)
- fenylová aj. (
 )
)
- dle struktury postranního řetězce a funkčních skupin
- dle polarity postranního řetězce
- dle významu ve výživě člověka
- esenciální = lidský organismus je není schopen vytvořit endogenně
- podmíněně esenciální = esenciální při nepřítomnosti prekurzorů či nezralosti enzymatických systémů
- plně neesenciální
| Rozšířená klasifikace
|
- 19 α-aminokyselin s primární aminoskupinou (-NH2)

- 1 α-aminokyselina se sekundární aminoskupinou (-NH-)
 n=0, pyrrolidin
n=0, pyrrolidin
- 18 aminokyselin = chirální sloučeniny řady L
- triviální názvy, systematické názvy, symboly (třípísmenné, jednopísmenné)
Podle struktury postranního řetězce a funkčních skupin
- alifatické s nesubstituovaným řetězcem
- alifatické hydroxyaminokyseliny
- alifatické sirné
- s karboxylovou skupinou v postranním řetězci (monoaminodikarboxylové, kyselé)
- jejich monoamidy (s karboxamidovou skupinou v postranním řetězci)
- s bazickými skupinami v postranním řetězci
- s aromatickým (heterocyklickým) postranním řetězcem
Podle polarity postranního řetězce a jeho iontové formy (v neutrálním prostředí)
- nepolární, hydrofobní
- Val, Leu, Ile, Phe, Tyr, Met, Pro;
- někdy Gly, Ala, Trp (amfifilní)
- polární, hydrofilní
- Ser, Thr, Cys, Asp, Glu, Asn, Gln, Lys, Arg, His
- Hydrofilní (podle iontové formy postranního řetězce v neutrálním prostředí)
- neutrální (nemá elektrický náboj): většina
- kyselé (záporný náboj): Asp, Glu
- bazické (kladný náboj): Lys, Arg, His
|
|
| Zástupci
|
Deriváty základních proteinogenních aminokyselin[upravit | editovat zdroj]
- vznik specifickou modifikací
- L-cystin (CySSCy)

- 4-hydroxy-L-prolin (Hyp)

- 5-hydroxy-L-lysin (Hyl)

- 3-methyl-L-histidin

- O-fosfo-L-serin

- N-methylglycin (sarkosin)
 , N,N-dimethylglycin , N,N-dimethylglycin  , N,N,N-trimethylglycin , N,N,N-trimethylglycin 
- L-karnitin
 (3-hydroxy-4-trimethylaminobutyrát, vitamin Bt) (3-hydroxy-4-trimethylaminobutyrát, vitamin Bt)
- ß-alanin (3-aminopropionová kyselina)
 , γ-aminomáselná (4-aminomáselná) kyselina (GABA) , γ-aminomáselná (4-aminomáselná) kyselina (GABA) 
- S-alk(en)yl-L-cysteiny
 , S-alk(en)yl-L-cysteinsulfoxidy , S-alk(en)yl-L-cysteinsulfoxidy 
Bazické aminokyseliny a příbuzné sloučeniny[upravit | editovat zdroj]
- L-ornithin (n = 2)

- L-citrullin (n = 2, karbamoylderivát ornithinu)

- kreatin-fosfát

potraviny deficitní některými aminokyselinami
- Lys − obiloviny (rostlinné proteiny obecně)
- Met − mléko, maso
- Thr − pšenice, žito
- Trp − kasein, kukuřice, rýže
|
|
| Fyzikálně-chemické vlastnosti
|
- acidobazické (pK a pI)
- optické
- senzorické
| ion I1 (kation) |
ion I2 (amfion) |
ion I3 (anion)
|
| volný náboj +1 |
volný náboj 0 |
volný náboj -1
|
| pH < 2 |
pH ≈ 6 |
pH > 10
|
Závislost iontových forem Gly na pH
kation (I1) → amfion (I2) → anion (I3)


- Gly = výjimka
- většina = chirální atom Cα... 2 optické isomery (enantiomery)
- některé 2 chirální centra... Ile, Thr, Hyp, CySSCy
L- a D-aminokyseliny, L-aminokyseliny = (S)-stereoisomery, výjimka: L-cystein = (R)-stereoisomer
D-aminokyseliny = (R)-stereoisomery
Obsah
Diastereoisomery aminokyselin
- sladké - Gly, Ala, Thr, Pro
- kyselé - Asp, Glu
- hořké - Leu, Ile, Phe, Tyr, Trp
- indiferentní - ostatní
Unikátní vlastnosti = chuť umami
|
|
| Přeměna látek a energie v buňce |
|
| |
|
| |
|
| |
|
| |
|
| |
|
| |
|
| |
|
| |
|
| |
|
| |
|
| |
|
| |
|
| |
|
| |
|
| Fontana J., Trnka J., Maďa P., Ivák P. a kol.: Přeměna látek a energie v buňce. In: Funkce buněk a lidského těla : Multimediální skripta. |