Regulace metabolických drah na úrovni buňky
Náplň podkapitoly
- Obecné principy regulací metabolických drah na úrovni buňky
- Kompartmentace metabolických dějů
- Změna absolutní koncentrace enzymu
- Modulace aktivity již existujícího enzymu
- Regulace jednotlivých metabolických drah
Obecné principy regulací metabolických drah na úrovni buňky
Aktivitu metabolických drah musí organismus neustále měnit. Reguluje se jak podle okamžitých potřeb a možností konkrétní buňky, tak podle potřeb organismu jako celku.
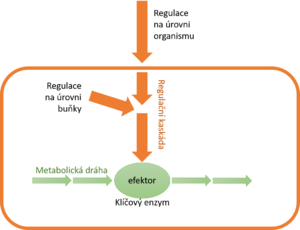
Na úrovni organismu zprostředkovávají regulaci signály, které k buňkám přicházejí zvenčí. Přenášejí se přes buněčnou membránu a uvnitř se spojí s regulačními ději samotné buňky. Regulace mívají řadu kroků, které se řadí do kaskád. Často končí změnou aktivity enzymu, který tak působí jako efektor regulace. Regulaci obvykle podléhá jen jeden enzym metabolické dráhy, tzv. klíčový nebo regulační enzym. Klíčové enzymy obvykle katalyzují nejpomalejší reakce metabolických drah.
Rychlost určité metabolické dráhy jako celku určuje její nejpomalejší krok. Jak jsme už uvedli, právě tento krok obvykle podléhá regulaci. Měnit se může jednak množství molekul klíčového enzymu, jednak jejich aktivita (tj. katalytická účinnost). Klíčové enzymy často katalyzují prakticky nevratné, např. silně exergonické reakce.
Děje, kterými se mění rychlost metabolických drah, můžeme rozdělit do tří skupin:
- Regulace, které využívají kompartmentaci metabolických dějů
- Řízení koncentrace enzymu
- Modulace aktivity (katalytické účinnosti) molekul enzymu
Kompartmentace metabolických dějů
Eukaryotickou buňku rozdělují semipermeabilní membrány do několika kompartmentů. Ty se od sebe liší například enzymatickým vybavením nebo membránovými transportními přenašeči. Různé bývají i hodnoty pH – enzymy mají totiž často různá pH optima. Kdyby byl v buňce jen jediný prostor, část enzymů by pravděpodobně nebyla funkční nebo by jimi zprostředkovaná katalýza nebyla dostatečně efektivní.
| Oddíl buňky | Metabolické dráhy |
|---|---|
| Cytoplazma | Metabolismus sacharidů: glykolýza, část glukoneogeneze, glykogenolýza a syntéza glykogenu, pentózový cyklus
Metabolismus mastných kyselin: syntéza mastných kyselin Metabolismus aminokyselin: syntéza neesenciálních AMK, některé transaminace Jiné dráhy: část drah syntézy hemu a močoviny, metabolismus purinů a pyrimidinů |
| Mitochondrie | Metabolismus sacharidů: pyruvátdehydrogenázový komplex, začátek glukoneogeneze (přeměna pyruvátu na oxalacetát)
Metabolismus mastných kyselin: β-oxidace MK, syntéza ketolátek (jen jaterní buňky), degradace ketolátek (jen extrahepatální tkáně) Metabolismus aminokyselin: oxidativní deaminace glutamátu, některé transaminace Jiné dráhy: Krebsův cyklus, dýchací řetězec a oxidativní fosforylace (na vnitřní mitochondriální membráně), část syntézy hemu a močoviny |
| Hladké endoplazmatické retikulum | Syntéza triacylglycerolů a fosfolipidů
Elongace a desaturace mastných kyselin Část syntézy steroidů Biotransformace xenobiotik Přeměna glukózy-6-fosfát na glukózu (v tkáních, kde se vyskytuje glukóza-6-fosfatáza) |
| Drsné endoplazmatické retikulum | Proteosyntéza (translace mRNA)
Posttranslační modifikace (oxidace, štěpení, metylace, fosforylace, glykosylace) |
| Golgiho aparát | Posttranslační modifikace proteinů (glykosylace, …)
Třídění proteinů a tvorba sekrečních vezikulů |
| Lysozomy | Hydrolytické štěpení proteinů, sacharidů, lipidů a nukleových kyselin |
| Peroxizomy | Degradace MK s dlouhým řetězcem (od 20 uhlíků) |
| Jádro | Replikace DNA a transkripce
Syntéza RNA |
| Jadérko | Úprava RNA
Syntéza ribozomů |
| Ribozomy | Syntéza proteinů |
V různých oddílech buňky pozorujeme i různou distribuci substrátů a produktů. Ani některé koenzymy nemohou volně přecházet mezi kompartmenty, např. molekuly NADH nebo koenzymu A neprocházejí vnitřní mitochondriální membránou. Mnoho enzymů přitom potřebuje vhodný koenzym pro svou katalytickou funkci. Změnou koncentrace koenzymu v určitém kompartmentu lze určitou metabolickou dráhu zapnout nebo vypnout. Kompartmentace usnadňuje i regulaci protichůdných dějů.
Např. syntéza mastných kyselin probíhá v cytoplazmě, zatímco jejich odbourávání v mitochondrii. Rychlost reakcí závisí na
- dodávce substrátů, popř. kosubstrátů (koenzymů),
- z předchozích kroků metabolické dráhy,
- transportem z jiných kompartmentů,
- odčerpávání produktů
- dalšími kroky metabolické dráhy,
- transportem do jiných kompartmentů.
Reakce, které na sebe v metabolismu přímo navazují, často probíhají na enzymech, které jsou v těsné blízkosti. Příkladem mohou být reakce již zmíněného Krebsova cyklu nebo dýchacího řetězce. Seskupení reakcí do jednoho kompartmentu zvyšuje rychlost metabolických drah, neboť produkt jedné reakce se hromadí přímo v místě, kde slouží jako substrát reakce navazující.
Kompartmentace umožňuje citlivě a cíleně řídit metabolické dráhy, které probíhají na jednom místě, aniž by došlo k ovlivnění pochodů v jiné části buňky.
Změna koncentrace enzymu
Množství enzymu v buňce se mění zvýšením nebo snížením exprese genu, který tento enzym kóduje. Regulační protein, který ovlivňuje transkripci, se nazývá transkripční faktor – induktor nebo represor. Působení regulačních proteinů je obvykle reverzibilní. Transkripční faktory jsou závislé na některých molekulách (např. hormonech), které působí jako jejich ligandy. Regulace touto cestou trvá déle (hodiny až dny) než regulace aktivity již vytvořeného enzymu (sekundy, minuty).
Exprese genu je obecně ovlivněna čtyřmi různými mechanismy.
- Na represor, který je navázán na DNA, se připojí ligand. Komplex represor-ligand se uvolní a umožní tak transkripci genu.
- Ligand se naváže na volný represor. Komplex represor-ligand se naváže na DNA a znemožní transkripci genu.
- Na induktor, který je navázán na DNA, se připojí ligand. Komplex induktor-ligand se uvolní a znemožní tak transkripci genu.
- Ligand se naváže na volný induktor. Komplex induktor-ligand se naváže na DNA a umožní tak transkripci genu.
Indukce tvorby enzymu může několikanásobně zvýšit jeho množství.
Naopak represe může tvorbu enzymu podstatně snížit.
Těmito procesy se buňky adaptují na měnící se vnitřní prostředí.
Modulace aktivity již existujícího enzymu
Kovalentní modifikace molekuly enzymu
Tvorba aktivních enzymů z neaktivních prekurzorů
Mnoho enzymů se tvoří v neaktivní formě (tzv. proenzymy či zymogeny). Částečnou proteolýzou enzymu se molekula mění na aktivní formu a díky ní se zvyšuje koncentrace aktivního enzymu. Vyřazení takto aktivovaných enzymů zařídí jejich proteolytické odbourání. Tento proces je typický například pro trávicí enzymy či pro některé faktory koagulační kaskády.
Interkonverze enzymů
Interkonverze enzymů je rychlé přepínání aktivní a inaktivní formy molekuly enzymu pomocí jiného enzymu. Nejznámějším příkladem je reverzibilní ATP-dependentní fosforylace a defosforylace hydroxylových skupin aminokyselin serinu, threoninu či tyrosinu tvořících řetězce enzymu.
Některé enzymy se fosforylací aktivují (např. glykogenfosforyláza), jiné jsou fosforylací inhibovány (např. glykogensyntáza). Fosforylaci katalyzují enzymy patřící mezi proteinkinázy (fosfotransferázy), defosforylaci zajišťují proteinfosfatázy. Tento způsob regulace enzymové aktivity se uplatňuje hlavně při přenosu signálu z membránových receptorů do nitra buněk, například při odpovědi na hormonální signál (propojení mezi signálem přicházejícím k buňkám z vnějšku s následným ovlivněním dějů uvnitř nich).
Zásahy, které ovlivňují enzymovou kinetiku
- Vliv koncentrace substrátů a produktů, hodnoty KM, pH, teploty atd.
- Dostupnost substrátů
- Koncentrace regulačních enzymů metabolických drah je v buňce velmi nízká. Stejně tak je koncentrace substrátů mnohem nižší než je hodnota Michaelisovy konstanty (KM se shoduje s koncentrací substrátu, při níž rychlost enzymem katalyzované reakce dosahuje poloviny maximální rychlosti). I nepatrná změna koncentrace substrátu pak změní rychlost jeho přeměny.
- Vliv Michaelisovy konstatnty KM
- Enzymy mají určitou substrátovou specifitu. Přeměňuje-li enzym více různých substrátů, má ke každému substrátu různou afinitu. Pokud mohou stejný substrát přeměňovat např. dva různé enzymy, každý z nich má k danému substrátu jinou afinitu. Čím je afinita k substrátu vyšší (KM pro dvojici enzym-substrát je tím nižší), tím stačí enzymu nižší koncentrace substrátu v okolí jeho aktivního centra, nezbytná k uskutečnění dané reakce.
- Odstraňování produktů
- Pokud je produkt reakce ihned využit, nehromadí se a reakce dále probíhá ve směru jeho další tvorby. Začne-li se nevyužitý produkt hromadit, často pak slouží jako inhibitor reakce nebo sledu reakcí vedoucích k jeho vzniku. Tomu v metabolismu zabrání následující mechanismy:
- odebírání produktu jedné reakce reakcí následnou (princip metabolických drah),
- využití produktu jedné metabolické dráhy v jiné metabolické dráze,
- transport produktu do jiného buněčného kompartmentu.
- Všechny tyto procesy urychlí průběh dané reakce.
- Vliv pH
- Změna pH může také ovlivnit aktivitu enzymu změnou disociace funkčních skupin v aktivním centru enzymu (elektrostatické interakce při vazbě substrátu) i v celé molekule enzymu (změna biologicky aktivní konformace enzymu v konformaci méně aktivní – např. přístup k aktivnímu centru).
- Vliv přítomnosti modulátorů aktivity (aktivátorů nebo inhibitorů)
Aktivitu regulačního enzymu může ovlivnit přímá vazba na nějaké látky (ligandu neboli efektoru či modulátoru) na jeho proteinovou molekulu. Pozitivní efektor slouží jako aktivátor enzymu, negativní efektor je naopak jeho inhibitorem.
- Nahromadění konečného produktu (či meziproduktu) dané metabolické dráhy často vede k inhibici regulačního enzymu dané dráhy, na nějž se produkt váže – tzv. regulace zpětnou vazbou.
- (Mezi)produkt jedné metabolické dráhy může ovlivňovat (aktivovat nebo inhibovat) aktivitu regulačního enzymu jiné, nějakým způsobem související metabolické dráhy – tzv. zkřížená regulace.
- Meziprodukt metabolické dráhy může ovlivňovat aktivitu následného enzymu dané metabolické dráhy – tzv. regulace krokem vpřed.
Modulátory
Modulátory se mohou vázat na enzym buď přímo do aktivního centra (kompetitivní inhibice), nebo se vážou na jiné, tzv. allosterické místo (allosterická regulace). Přirozené modulátory aktivity se na enzym vážou nekovalentně, jen pomocí slabých nevazebných interakcí.
Izosterická modulace enzymové aktivity
Isosterická modulace enzymové aktivity se týká jednoduchých enzymů, které vykazují hyperbolickou závislost mezi rychlostí reakce a koncentrací substrátu. Jejich aktivitu ovlivňují zejména změny v koncentraci substrátu, snížení nebo zvýšení syntézy enzymu. Dále aktivitu enzymů ovlivňují inhibitory, které se vážou přímo na aktivní centrum namísto substrátu (kompetitivní inhibice). Kompetitivním inhibitorem může být jeden z produktů metabolické dráhy (inhibice zpětnou vazbou).
Allosterická regulace
Allosterická regulace se vyskytuje u enzymů složených z více podjednotek (většina regulačních enzymů metabolických drah). Tyto enzymy vykazují sigmoidální závislost rychlosti reakce na koncentraci substrátu. Allosterické modulátory aktivity se vážou mimo aktivní centrum na jiná místa molekuly enzymu. Vazbou modulátoru se mění konformace molekuly, což se může projevit změnou afinity enzymu k substrátu (tj. dochází ke snížení nebo zvýšení hodnoty KM).
Také se může snížit koncentrace aktivního enzymu (část molekul enzymu je inaktivováno), tím se pak vyvolá změna hodnoty maximální rychlosti enzymem katalyzované reakce. Vazbou aktivátoru se méně aktivní tzv. T-forma enzymu („tenzní“) mění na aktivnější R-formu („relaxovanou“). Vazba allosterických aktivátorů tak může zvýšit počet molekul enzymu v R-formě.
Substráty a efektory obecně pouze ovlivňují rovnováhu mezi konformacemi T a R – obě konformace existují vedle sebe v různých poměrech. Konečné množství aktivních forem enzymu záleží na celkovém účinku různých aktivátorů a inhibitorů vázajících se na enzym, tj. závisí na jejich vzájemném poměru v buňce. Při zvýšení KM může být za fyziologických podmínek reakce úplně vyřazena, neboť fyziologická koncentrace substrátu leží v oblasti, kde je enzym prakticky neúčinný. Jde o velmi jemnou a plynulou regulaci reakční rychlosti na základě propojení různých metabolických drah.
Regulace jednotlivých metabolických drah