Enzymy
(přesměrováno z Enzymy (FBLT))
V biologických systémech probíhá mnoho různých reakcí. Při pokusech se zjistilo, že rychlost těchto reakcí je při provedení mimo živý systém (tj. in vitro) mnohem nižší než in vivo. V živých systémech probíhají reakce stokrát až milionkrát rychleji než in vitro. Způsobují to specifické katalyzátory – enzymy. Ty často umožňují průběh i takových reakcí, které by jinak v podmínkách lidského těla (teplota, pH atd.) prakticky neprobíhaly.
Biologické katalyzátory
Katalyzátor je látka, která zvyšuje rychlost chemické reakce, ale nemění chemickou rovnováhu (jen zkracuje čas jejího dosažení). Při reakcích se molekula enzymů nespotřebovává.
Enzym
Enzym je specifická organická molekula urychlující reakce v organismech (působí jako biokatalyzátor). Umožňuje tak průběh reakcí i při relativně nízkých teplotách, neutrálním pH a atmosférickém tlaku, které se v organismech běžně vyskytují. Naprostá většina enzymů jsou proteiny. Výjimku tvoří některé druhy RNA molekul – tzv. ribozymy.
Vedle bílkovinné složky mohou enzymy obsahovat i nebílkovinnou součást. Podle její přítomnosti lze enzymy dělit na:
Kofaktory
Kofaktorem mohou být :
- ionty kovů: Zn2+ (např. alkoholdehydrogenáza), Mn2+ (např. argináza), Fe2+, Cu2+, Mg2+,
- organické molekuly: často se jedná o deriváty vitaminů.
Podle charakteru vazby na apoenzym kofaktory dělíme na:
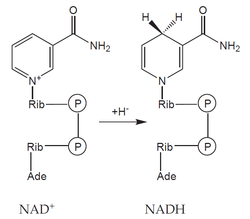
- koenzymy: organická molekula neproteinové povahy, na molekulu apoenzymu vázaná volně – může se z něho oddělit (např. NAD+, NADP+),
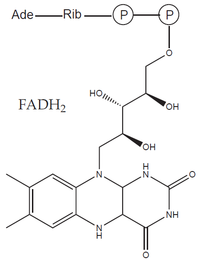
- prostetické skupiny: organická molekula neproteinové povahy, na molekulu apoenzymu vázaná pevně (např. hem, FAD).
Multienzymový komplex
Enzym může být tvořen různým počtem peptidových řetězců. Každý řetězec může obsahovat více domén (se stejnou či rozdílnou enzymovou specificitou). Pokud enzym obsahuje více řetězců (kvarterní struktura), označujeme jej jako multienzymový komplex. Jednotlivé podjednotky mívají obvykle různou specificitu a bývají vzájemně spojeny nekovalentně. Jako příklad multienzymového komplexu lze uvést syntázu mastných kyselin, která katalyzuje syntézu vyšších mastných kyselin v buňkách.
Zymogeny
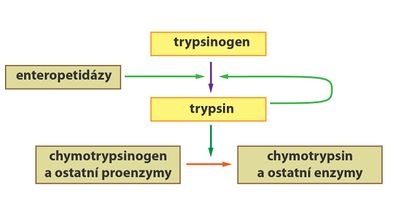
Některé enzymy (např. trávicí) jsou tvořeny a sekretovány ve své neaktivní podobě jako tzv. zymogeny (proenzymy). Důvodem je ochrana syntetizujících buněk před štěpením účinkem aktivních forem enzymů. Zymogeny jsou aktivovány až na místě, kde se jejich aktivita požaduje. Aktivace může například probíhat jako tzv. parciální proteolýza, během níž se odštěpí přesně definovaná část molekuly proenzymu.
Uvedeme si dva příklady tohoto procesu:
- Hlavní buňky žaludeční sliznice sekretují proenzym pepsinogen. HCl přítomná v žaludeční šťávě napomáhá autoaktivaci pepsinogenu na aktivní pepsin. Reakce probíhá také autokatalyticky, kdy se na štěpení pepsinogenu podílejí již vytvořené molekuly pepsinu.
- Podobně jako pepsin je i trypsin syntetizován v pankreatu jako inaktivní trypsinogen. V tenkém střevě je následně pomocí enzymu enteropeptidázy (tvořené buňkami sliznice střeva) odštěpen hexapeptid za vzniku aktivního trypsinu.
Izoenzymy a izoformy enzymů
V organismu existují enzymy zvané izoenzymy, které katalyzují stejnou reakci, ale vzájemně se liší svými fyzikálně-chemickými vlastnostmi (odlišná afinita k substrátu, KM, citlivost k inhibitorům) a také výskytem v tkáních. Tyto geneticky podmíněné rozdíly (odlišný sled nukleotidů DNA) například dovolují jistou regulaci podmínek, za kterých bude daná reakce v různých tkáních probíhat.
Názorným příkladem jsou izoenzymy katalyzující přeměnu glukózy na glukóza-6- fosfát (fosforylace glukózy) – glukokináza (nacházející se v hepatocytech a β-buňkách pankreatu) a hexokináza (lokalizovaná v ostatních buňkách těla). Glukokináza vykazuje nižší afinitu ke svému substrátu – glukóze (to vyjadřuje tzv. KM, pro glukokinázu je přibližně 10 mmol/l). To znamená, že enzymem katalyzovaná reakce probíhá, pokud hladina glukózy v krvi dosáhne dostatečné výše (obvykle po jídle). Při normální glykémii (mezi jídly) je glukokináza málo aktivní. Játra tak nechávají dostatek glukózy pro ostatní tkáně, které obsahují hexokinázu s hodnotou KM kolem 0,1 mmol/l.
Kromě izoenzymů se v těle vyskytují i izoformy enzymů. Tyto mnohočetné formy enzymů pocházejí ze stejného genu (stejný sled nukleotidů DNA), ale liší se rozdílnými posttranslačními modifikacemi či alternativním splicingem (sestřihem). Výsledkem je, že tyto enzymy mohou katalyzovat i různé reakce.
Mechanismus účinku enzymů a faktory ovlivňující enzymovou aktivitu
Mechanismus účinku enzymů
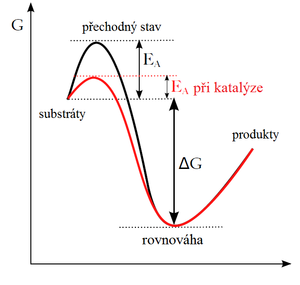
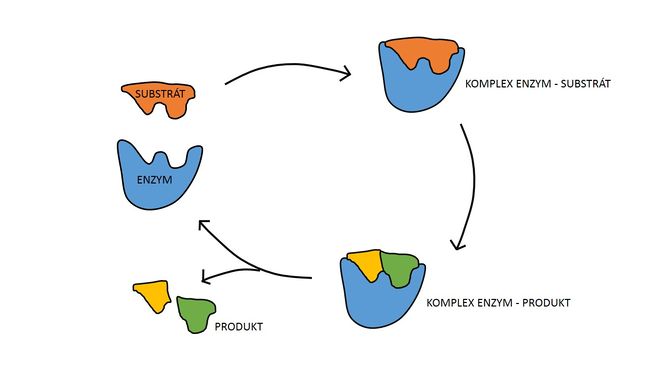
Enzymy, podobně jako i ostatní katalyzátory, pracují na principu snížení aktivační energie.
Během prvního kroku dojde k tvorbě komplexu enzym-substrát (E-S). Tato reakce probíhá typicky velmi rychle a je reverzibilní. Následně se substrát za katalýzy enzymem přemění v produkt. Z komplexu E-S tak vzniká komplex enzym-produkt (E-P), který se rozpadá za uvolnění produktu. Tato reakce je pomalá a ireverzibilní.
Reakce se tak rozdělí na několik postupných kroků, v nichž vzniká jeden nebo několik přechodných stavů E-S (transition states). Aktivační energie potřebná k vytvoření každého meziproduktu a k následné přeměně E-S na E-P je nižší než při přímé přeměně substrátu na produkt, přestože celkové ΔG obou reakcí je stejné.
Interakce substrátu a enzymu
Substrát interaguje s molekulou enzymu v oblasti zvané aktivní místo (centrum). To je tvořeno následovně:
- Vazebným místem enzymu
- Vazebné místo enzymu je prostorově vymezená, malá část molekuly enzymu obsahující přesně rozmístěné funkční skupiny (−SH, −OH, kyselé a bazické aminokyseliny), jejichž postavení odpovídá struktuře substrátu. Na vazbě mezi enzymem a substrátem se podílejí nevazebné interakce (H-můstky, elektrostatické a hydrofobní interakce, van der Waalsovy síly). Kovalentní vazby vznikají jen výjimečně.
- Katalytickým místem
- Katalytické místo obsahuje další skupiny zodpovědné za katalytickou aktivitu enzymu. Tyto skupiny často pocházejí z molekuly kofaktoru. Přesné rozlišení vazebného a katalytického místa je ale obvykle problematické.
Kromě aktivního místa se na povrchu enzymu mohou nacházet i místa allosterická, umožňující regulaci aktivity enzymu vlivem různých efektorů (inhibitorů nebo aktivátorů).
Původní model interakce mezi molekulou substrátu a enzymu (později nazvaný teorií zámku a klíče – lock and key) vytvořený německým chemikem Emilem Hermannem Fischerem koncem 19. století předpokládal, že molekula substrátu přesně zapadá do molekuly enzymu. Ve 20. století tento model pozměnil americký biochemik Daniel Edward Koshland, Jr., který přišel s tvrzením, že substrát dokáže do jisté míry indukovat konformační změnu místa, na něž se váže (případně na sebe působí vzájemně). Přesného tvaru „zámku a klíče“ se tedy dosáhne až po navázání. Ukazuje se, že tato teorie indukovaného přizpůsobení (induced fit theory) popisuje interakce mezi enzymem a substrátem lépe než původní model.
Specificita enzymů
Enzymová specificita omezuje rozsah působení určitého enzymu. Rozlišujeme dva typy specificity:
1. Substrátová specificita
Enzym působí pouze na omezenou skupinu substrátů a pro jiné substráty reakci katalyzovat nebude. Podle rozsahu může být substrátová specificita:
Absolutní:
- Enzym katalyzuje reakci pouze jednoho určitého substrátu, ale již nebude katalyzovat reakce, jichž se účastní například deriváty tohoto substrátu. Příkladem je ureáza katalyzující reakci:
- urea + H2O → CO2 + 2 NH3
- Ureáza však nedokáže katalyzovat hydrolýzu metylmočoviny či thiomočoviny.
Skupinová:
- Jedná se o častější formu specificity. Enzym katalyzuje reakce několika podobných substrátů (typicky obsahujících stejné funkční skupiny). Afinita ke každému substrátu může být rozdílná (KM se tedy pro jednotlivé substráty liší). Příkladem je karboxypeptidáza B, která hydrolyzuje peptidy z jejich karboxy- konce. Preferenčně štěpí peptidové vazby obsahující nabité aminokyseliny (arginin, lysin).
2. Reakční (účinková) specificita
Enzym obecně katalyzuje jeden typ reakce. Příkladem mohou být lipázy – enzymy hydrolyzující lipidy.
Mnoho enzymů působí stereospecificky. Atakují pouze určité konfigurační izomery substrátů (například jen L- nebo jen D- formu) pravděpodobně kvůli nutnosti vazby substrátu na alespoň tři specifická místa aktivního centra enzymu (který je chirální sloučeninou) – opačný stereoizomer se nenaváže.
Faktory ovlivňující enzymovou aktivitu a kinetika jednosubstrátových reakcí
Koncentrace substrátu
Zkoumání enzymové kinetiky jednosubstrátových reakcí se věnovali Leonor Michaelis a Maud Leonora Mentenová. V této kapitole se uplatňují zákony obecné kinetiky.
U katalyzovaných jednosubstrátových reakcí předpokládáme, že probíhají ve dvou krocích:
| (1) |
kde kcat je rychlostní konstanta katalyzované reakce. Nazývá se také číslo přeměny (turnover number) a udává počet molekul substrátu přeměněných jednou molekulou enzymu za jednotku času (nejčastěji za jednu sekundu). Její hodnoty se pohybují od 4.10^7 (pro katalázu) do 0,5 (pro lysozym).
- Maximální rychlost katalyzované reakce
Je možné ji vyjádřit jako:
| (2) |
- kde [E]t je celková koncentrace enzymu.
- Rovnice Michaelise a Mentenové
Rovnice popisuje, jak počáteční rychlost v0 závisí na rychlostní konstantě kcat a také na tom, kde se rovnováha ES nachází:
| (3) |
Předpokládáme přitom, že množství enzymu se nemění (a jeho koncentrace je výrazně nižší než koncentrace substrátu) a také přítomnost jistého pseudo-ustáleného stavu, při kterém se koncentrace komplexu ES mění mnohem pomaleji než koncentrace S a P.
Dosazením rovnice (2) můžeme rovnici (3) přepsat do tvaru:
| (4) |
KM (Michaelisova konstanta) je experimentálně definována jako taková koncentrace substrátu, při které se rychlost průběhu enzymaticky katalyzované reakce rovná polovině maximální rychlosti (vyjadřuje tedy afinitu substrátu a enzymu). Čím je hodnota KM nižší, tím je afinita vyšší (stačí totiž nižší [S], aby se enzym z poloviny nasytil).
Z grafu vyplývá, že závislost rychlosti enzymově katalyzované reakce na koncentraci substrátu má tvar hyperboly. Jestliže je koncentrace substrátu malá, křivka změny rychlosti přibližně odpovídá kinetice 1. řádu (lineární nárůst). Tento téměř lineární nárůst ale nemůže pokračovat donekonečna kvůli omezenému množství vazebných míst na molekulách enzymu. Při dostatečně vysoké koncentraci substrátu po nasycení vazebných míst všech dostupných molekul enzymů je tak dosaženo maximální rychlosti (vmax). Rychlost se dál nezvyšuje a zůstává přibližně konstantní. Tato část křivky odpovídá kinetice 0. řádu (bez závislosti na koncentraci).
KM lze následně stanovit graficky z hyperboly, ale v praxi se toto stanovení moc často nepoužívá. Přesnější je stanovení s použitím převrácených hodnot 1/v a 1/[S] – tzv. dvojitě reciproké vynesení dle Lineweavera a Burka. Z rovnice (4) pak dostáváme:
| (5) |
Rovnici také můžeme zapsat v tvaru odpovídajícím rovnici přímky y = a · x + b:
| (6) |
Teplota
Enzymy mohou být kvůli své proteinové povaze vlivem vysoké teploty denaturovány (nastávají konformační změny, s následným zničením aktivního místa). Obvykle k tomu dochází při teplotách kolem 55–60 °C. Rychlost postupně klesá, až se průběh příslušné reakce úplně zastaví.
Také nízké teploty snižují aktivitu enzymů a tím i rychlost jimi katalyzovaných reakcí. Enzym má maximální aktivitu při teplotě označované jako teplotní optimum (u většiny lidských enzymů se jedná o teplotu kolem 37 °C).
pH (koncentrace H+)
Podobně jako na změny teploty jsou enzymy citlivé i na výkyvy pH. Extrémní hodnoty (nízké i vysoké) mohou opět vyvolat denaturaci molekuly enzymu. Koncentrace H+ má také významný vliv na ionizaci kyselých a bazických skupin nejen molekuly enzymu, ale i molekuly substrátu. Analogicky jako u teploty se považuje za pH optimum taková hodnota pH, při které má enzym maximální aktivitu.
Názvosloví enzymů
Triviální názvosloví
Původně užívaný termín fermenty, který vycházel z faktu, že enzymy se podílejí na fermentaci (kvašení), se již nepoužívá. Enzymy objevené mezi prvními dostaly obvykle jméno podle svého zdroje nebo metody, kterou byly objeveny. Jejich názvy tedy bývají bez vztahu k mechanismu reakce, kterou katalyzují. Mnohé jsou zakončeny příponou -in – viz pepsin objevený v trávicí šťávě žaludku (řec. pepsis – trávení) nebo ptyalin nalezený ve slinách (řec. ptyalon – slina).
Doporučené názvosloví
Zavádí do názvosloví systém a je zároveň jednodušší než systematické názvosloví, proto je často užíváme v běžné praxi. Název vytvoříme spojením:
- Substrát + -áza (-asa) – například amyláza (katalyzující hydrolýzu amylózy);
- Typ reakce + -áza – například dehydrogenáza.
Systematické názvosloví
Systematické názvosloví zavedla IUB (International Union of Biochemistry). Každý enzym má své EC (Enzyme Commission) číslo složené ze čtyř číslic – x.x.x.x. První značí jednu z šesti hlavních enzymových tříd, další dvě podskupinu a podpodskupinu. Poslední indikuje pořadí enzymu v podpodskupině (a zcela tak daný enzym charakterizuje). Rozeznáváme těchto sedm hlavních tříd enzymů:
- oxidoreduktázy,
- transferázy,
- hydrolázy,
- lyázy (syntázy),
- izomerázy,
- ligázy (syntetázy),
- translokázy.
Oxidoreduktázy
Oxidoreduktázy katalyzují reakce, při nichž dochází k oxidaci jedné a k redukci druhé složky. Často využívají kofaktory – např. NAD+, NADP+, FAD či hem. Mezi oxidoreduktázy patří:
- oxidázy, peroxidázy,
- oxygenázy – vnášejí do molekuly substrátu kyslík, buď ve formě -OH (monooxygenázy, nebo také hydroxylázy) či jako O2 (dioxygenázy),
- dehydrogenázy – oxidují substrát odebráním H-atomů, jejich název se zkracuje jako DH (př. laktátdehydrogenáza – LDH, alkoholdehydrogenáza – ADH),
- desaturázy.
Transferázy
Transferázy se podílejí na přenosu různých skupin (amino-, acyl-, methyl-, glykosyl-, fosforyl-, …). Příkladem transferáz jsou:
- transaminázy (aminotransferázy) – přenášejí -NH2 skupinu,
- kinázy (fosfotransferázy) – přenášejí fosfátovou skupinu z ATP nebo jiných nukleosidtrifosfátů,
- transaldolázy, transketolázy.
Hydrolázy
Katalyzují hydrolytické reakce (štěpení vazeb v molekulách prostřednictvím molekuly vody). Mezi hydrolázy patří:
- lipázy, fosfolipázy,
- proteázy, peptidázy (pepsin, trypsin),
- esterázy,
- fosfatázy.
Lyázy (syntázy)
Katalyzují odstranění určité skupiny ze substrátu bez hydrolýzy (nehydrolytické štěpení např. vazeb mezi C-C, C-N) a také adiční reakce na dvojnou vazbu a syntézy bez spotřeby ATP. Příkladem lyáz jsou:
- dekarboxylázy,
- aldolázy,
- dehydratázy, hydratázy.
Izomerázy
Katalyzují změny uvnitř jedné molekuly substrátu (intramolekulární změny). Vzniklý produkt je izomerem výchozího substrátu. Mezi izomerázy patří:
- epimerázy – mění polohu -OH skupiny v molekule,
- mutázy – mění polohu fosfátové skupiny v molekule.
Ligázy (syntetázy)
Katalyzují syntetické reakce spojené s hydrolýzou ATP (spřažení exergonické a endergonické reakce). Příkladem ligáz jsou:
- karboxylázy,
- DNA-ligáza.
Translokázy
Zajišťují přesun látek přes biologickou membránu. Umožňují specifický přestup atomů a molekul. Např.:
- TOM komplex – zajišťuje přechod vnější membránou mitochondrie (translocase of the outer mitochondrial membrane)
- TIM komplex – zajišťuje přechod vnitřní membránou mitochondrie (translocase of the inner mitochondrial membrane)
- ADP-ATP-translokasa – katalyzuje antiport ATP za ADP na vnitřní membráně mitochondrií
Inhibice enzymů a její význam ve farmakologii
Inhibice enzymů
Existuje mnoho látek schopných ovlivnit funkci enzymu ve smyslu zvýšení (aktivátory) nebo snížení (inhibitory) jeho aktivity. Právě inhibice enzymové aktivity patří k jednomu z nejdůležitějších regulačních mechanismů v živých systémech. Na inhibici specifických enzymů metabolických drah je založeno i působení mnoha léků. Proto je důležité znát inhibiční mechanismus jejich působení, který má vliv například na možnosti neutralizace jejich účinku. Na základě vratnosti efektu existují dvě hlavní formy inhibice:
- Reverzibilní inhibice,
- Ireverzibilní inhibice.
Reverzibilní inhibice
Reverzibilní (vratná) inhibice může být potlačena. Inhibitor se váže nekovalentně (slabými chemickými vazbami) buď do aktivního místa enzymu, nebo mimo něj. Efekt inhibitoru se dá odstranit například zvýšenou nabídkou substrátu nebo dialýzou.
- Kompetitivní inhibice
- Kompetitivní inhibitor soutěží s molekulou substrátu o aktivní místo enzymu. Jedná se tedy často o látky strukturně podobné molekule substrátu, ale neschopné podstoupit enzymem katalyzovanou reakci – inhibitor se na enzym jen naváže. Zvýšením koncentrace substrátu lze inhibici vytěsněním inhibitoru z aktivního místa potlačit.
- Kompetitivní inhibitor neovlivňuje vmax, jen oddaluje její dosažení (musí dojít k vytěsnění inhibitoru zvýšenou koncentrací substrátu). KM se tedy zvyšuje (zdánlivě je snížená afinita enzymu k substrátu).
- Nekompetitivní inhibice
- Při nekompetitivní inhibici se inhibitor váže mimo vazebné místo pro substrát. Toto místo někdy bývá označováno jako modulační. Vazbou změní konformaci enzymu tak, že ovlivní i konformaci aktivního místa. Tím je znemožněna vazba substrátu. Inhibice se zvýšením koncentrace substrátu potlačit nedá, protože substrát nemá tendenci k vazbě na místo modulační (nedochází tedy k boji – kompetici o vazebné místo). Tuto inhibici lze zrušit jen odstraněním inhibitoru (např. dialýzou).
- Protože žádný z komplexů enzym-inhibitor (případně ani enzym-inhibitor-substrát) není katalyticky aktivní, sníží se celkové množství enzymu dostupného pro substrát. Tím dojde ke snížení vmax reakce. KM se v tomto případě nemění.
- Akompetitivní inhibice
- Jedná se o inhibici, při níž se inhibitor váže pouze na komplex enzym-substrát. Vzniká tak ternární komplex enzym-inhibitor-substrát.
- Dochází ke snížení vmax (obsazené komplexy jsou enzymaticky neúčinné) i KM, ale jejich vzájemný poměr se nemění. Inhibitor je při nízké koncentraci substrátu velmi málo účinný, protože nemá dostatek komplexů ES, na které by se mohl navázat.
Ireverzibilní inhibice
V průběhu této inhibice označované také jako nevratná dochází ke kovalentní modifikaci molekuly enzymu. Inhibitor se kovalentně naváže do aktivního místa enzymu nebo mimo něj, a proto není možné inhibici odstranit (například dialýzou nebo zvýšením koncentrace substrátu).
Dalším popisovaným jevem je inhibice nadbytkem substrátu. Při příliš vysoké koncentraci substrátu totiž dochází k boji o vazebné místo mezi jeho molekulami navzájem. To se na grafu projeví mírným snížením vmax v oblasti vyšší koncentrace substrátu.
Allosterická regulace enzymové aktivity
Mnoho regulačních enzymů, které limitují rychlost metabolických drah (tzv. rate-limiting enzymes), jsou enzymy allosterické. Allosterická regulace jejich aktivity patří k jedné z nejvýznamnějších forem regulace průběhu metabolických drah.
Allosterický enzym má na svém povrchu kromě aktivního místa i místo jiné, tzv. allosterické (řec. αλλος – jiný), přes které může být ovlivněn modulátory (aktivátory či inhibitory). Vazba allosterického modulátoru způsobí konformační změnu molekuly enzymu. Tato změna vede k rozdílné afinitě k substrátu a dalším ligandům. Většina allosterických enzymů je oligomerních (jsou složeny z podjednotek). Vazba modulátoru na jednu podjednotku ovlivní prostřednictvím konformační změny aktivitu dalších podjednotek. Rozeznáváme dva základní typy allosterické regulace:
- Homotropní – modulátor je zároveň i substrátem pro enzym. Známým příkladem je O2, což je homotropní allosterický modulátor hemoglobinu.
- Heterotropní – modulátor a substrát jsou odlišné molekuly. V návaznosti na předchozí příklad by CO2 byl heterotropním allosterickým modulátorem hemoglobinu.
Allosterické enzymy vykazují sigmoidální kinetiku
Jako příklad použijeme reakci ovlivněnou homotropně působícím allosterickým aktivátorem. Při nízkých koncentracích substrátu probíhá reakce pomalu, protože je obsazeno jen málo molekul enzymu. Pokud se alespoň na jednu podjednotku enzymu naváže substrát, zvýší to afinitu i ostatních podjednotek. To se na grafu projeví prudkým vzestupem reakční rychlosti. Čím více podjednotek molekula enzymu obsahuje, tím prudší je nástup efektu zvýšení koncentrace substrátu.
Enzym pracuje na principu vše anebo nic. Před dosažením jisté koncentrace substrátu reakce téměř neběží, naopak nad danou koncentrací substrátu rychle dosáhne Vmax. V tuto chvíli jsou už všechna vazebná místa enzymových podjednotek obsazena.
Tato vlastnost allosterických enzymů je při regulaci metabolických drah velmi výhodná, neboť umožňuje rychle vypnout nebo zapnout průběh reakce a tím i celé metabolické dráhy.
Využití enzymů v diagnostice onemocnění
Stanovování aktivit různých enzymů v tělesných tekutinách je v klinické praxi často užíváno při diagnostice místa a rozsahu tkáňového postižení. Kromě diagnostického přínosu je významný i prognostický přínos, hodnocený na základě změn hladin příslušných enzymů v čase.
Nejčastěji se měří aktivity enzymů přímo v plazmě. Může se jednat o:
- Enzymy specifické pro plazmu – např. srážecí faktory.
- Sekreční enzymy, které se v různé míře dostávají do krve – např. pankreatická amyláza či lipáza.
- Intracelulární enzymy plnící v buňkách různé funkce – do krve pronikají při poškození buněk příslušné tkáně.
Při hodnocení naměřených hladin enzymů je důležité znát jejich:
- Intracelulární lokalizaci
- Některé enzymy se specificky vyskytují jen v určitých kompartmentech buňky a mohou tak sloužit jako jejich markery. Příkladem může být cytochromoxidáza, která je specifická pro mitochondrie. Podle zastoupení enzymů vyplavených z buněk můžeme také odhadovat míru postižení dané tkáně. Jsou-li v krvi přítomny jen enzymy lokalizované v cytozolu, je postižení mírnější než v případě výskytu i typicky mitochondriálních enzymů.
- Orgánovou a tkáňovou distribuci
- Podobně jako se liší distribuce enzymů v rámci buněčných kompartmentů, různí se i jejich distribuce mezi jednotlivými tkáněmi a orgány. Některé enzymy jsou proto více či méně orgánově specifické. Typicky se jedná zejména o různé druhy izoenzymů či izoforem enzymů. Příkladem mohou být izoenzymy kreatinkinázy – CK-MB typická pro myokard a CK-MM pro kosterní sval.
Nejčastěji stanovované enzymy
Játra
- Markery poškození hepatocytů:
- ALT (alaninaminotransferáza) – lokalizovaná převážně v cytoplazmě,
- AST (aspartátaminotransferáza) – lokalizovaná převážně v mitochondriích.
- Protože AST je zejména mitochondriální enzym, dochází k jejímu uvolnění až při těžším poškození jaterních buněk. Podle poměru AST/ALT se tedy dá posoudit závažnost postižení.
- Markery cholestázy:
- ALP (alkalická fosfatáza),
- GGT (γ-glutamyltransferáza) – její zvýšenou aktivitu zaznamenáváme také u chronického alkoholického postižení jater.
Pankreas
- Pankreatická amyláza – méně specifická pro postižení pankreatu než pankreatická lipáza.
- Pankreatická lipáza.
Svalová tkáň
K odlišení místa poškození se měří aktivity izoenzymů kreatinkinázy:
- CK-MM – lokalizovaná v kosterním svalstvu;
- CK-MB – lokalizovaná v myokardu;
- CK-BB – lokalizovaná v mozku.
Při diagnostice infarktu myokardu se kromě CK-MB měří také hladiny:
- Troponinů I a T – v současnosti nejspecifičtější kardiální markery, vrchol jejich koncentrace nastupuje asi 12 hodin po infarktu.
- Myoglobinu – jako kardiální marker málo specifický, ale vrcholu své koncentrace dosahuje už 2 hodiny po infarktu.
Kostní tkáň
- ALP (alkalická fosfatáza) – lokalizovaná v osteoblastech – tzv. kostní frakce, může ale pocházet i z jater (tzv. jaterní frakce), GIT či z ledvin,
- ACP (kyselá fosfatáza) – lokalizovaná v osteoklastech, může pocházet i z prostaty.
Izoenzymy laktátdehydrogenázy (LD, LDH)
- LD-1 – lokalizovaná v buňkách myokardu a erytrocytech.
- LD-2 – lokalizovaná v RES.
- LD-3 – lokalizovaná v plicích.
- LD-4 – lokalizovaná v ledvinách, pankreatu a placentě.
- LD-5 – lokalizovaná v játrech a kosterním svalu.
Přehled nejčastěji stanovovaných enzymů
| Stanovovaný enzym | Poškození orgánu/tkáně |
|---|---|
| α-amyláza (AMS), pankreatická lipáza (LPS) | Pankreas |
| Alkalická fosfatáza (ALP) | Kost, játra, GIT, ledviny, placenta |
| Kyselá fosfatáza (ACP) | Kost, prostata |
| Kreatinkináza (CK) | Kosterní sval, srdce |
| Laktátdehydrogenáza (LD) | Srdce, játra, kosterní sval, ledviny, erytrocyty |
| Alanin aminotransferáza (ALT) | Játra |
| Aspartát aminotransferáza (AST) | Játra, srdce, kosterní sval |
| Gama-glutamyltransferáza (GGT) | Játra |
Přehled kofaktorů enzymů
Ionty kovů a stopové prvky
| Kofaktor | Příklady enzymů |
|---|---|
| Zn2+ | Peptidázy, alkoholdehydrogenáza |
| Mg2+ | Enzymy závislé na ATP, fosfohydrolázy |
| Mn2+ | Superoxiddismutáza, argináza |
| Fe2+/ Fe3+ | Cytochromy, kataláza, peroxidázy |
| Cu2+ | Cytochromoxidáza, aminooxidázy |
| Mo2+ | Xantindehydrogenáza |
Organické látky
Kofaktory oxidoreduktáz
| Kofaktor | Výchozí vitamin | Lokalizace/funkce |
|---|---|---|
| NAD+, NADP+ | Kyselina nikotinová | Dýchací řetězec, syntéza MK |
| FAD, FMN | Riboflavin (B2 ) | Dýchací řetězec |
| Ubichinon/ubichinol | Dýchací řetězec | |
| Hem | Cytochromy |
Kofaktory transferáz
| Kofaktor | Výchozí vitamin | Lokalizace/funkce |
|---|---|---|
| ATP, GTP | Thiamin (B1) | Přenos fosfátového zbytku |
| TDP (thiamindifosfát) | Thiamin (B1) | Přenos uhlíkatých fragmentů (oxidační dekarboxylace) |
| PALP (pyridoxalfosfát) | Pyridoxin (B6) | Přenos −NH2 skupin (transaminace), dekarboxylace aminokyselin |
| THF (tetrahydrofolát) | Folát (kyselina listová) | Přenos jednouhlíkatých fragmentů |
| CoA (koenzym A) | Pantothenát | Přenos acylů |
| PAPS (fosfoadenosinfosfosulfát) | Přenos sulfátů | |
| SAM (S-adenosylmethionin) | Methylace | |
| B12-komplex | Kobalamin B12 | Přenos CH3 skupiny |
Kofaktory lyáz
| Kofaktor | Výchozí vitamin | Lokalizace/funkce |
|---|---|---|
| PALP (pyridoxalfosfát) | Pyridoxin (B6) | Dekarboxylace |
Kofaktory ligáz
| Kofaktor | Výchozí vitamin | Lokalizace/funkce |
|---|---|---|
| ATP | ||
| Karboxybiotin | Biotin | Přenos CO2 (karboxylace) |
Odkazy
Související články








![v_{max} = k_{cat} \cdot [\mbox{E}]_t](https://wikimedia.org/api/rest_v1/media/math/render/svg/fffd8f91cef6d3bdeec699d3bbb8685ed272b7c2)
![v_0 = \frac{\Delta [\mbox{P}]}{\Delta t} = \frac{k_{cat} \cdot [\mbox{E}]_t \cdot [\mbox{S}]}{K_M + [\mbox{S}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a97c55b8a7c051d320416ca2d459057c7c38e2d7)

![v_0 = \frac{v_{max} \cdot [\mbox{S}]}{K_M + [\mbox{S}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9574cc2ea02f40f2663065e3b18038273fbf68e4)
![\underline{K_M = [\mbox{S}]:}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9b2d3e85c09c6f46643abc1e26b33a07284b82cf)

![\frac{1}{v} = \frac{K_M + [\mbox{S}]}{v_{max} \cdot [\mbox{S}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/30ae51390b6634e839e90c00b29c5312d206c943)

![\frac{1}{v} = \frac{K_M}{v_{max} \cdot [\mbox{S}]} + \frac{1}{v_{max}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ba0611a604ffafd8a236aa3ac51bd1af4a886c3b)





