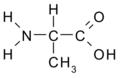
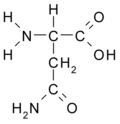
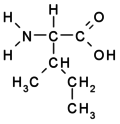
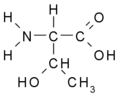
Aminokyseliny
Aminokyseliny jsou organické kyseliny obsahující nejméně jednu aminovou (-NH2) a karboxylovou (-COOH) skupinu. Jsou základní stavební složkou proteinů. Biologické vlastnosti proteinů jsou dány druhem aminokyselin, jejich pořadím a jejich vzájemnými prostorovými vztahy. Ačkoliv se v přírodě vyskytuje více než 300 aminokyselin, pouze 21 z nich zařazují buňky do bílkovin, tzv. kódované aminokyseliny. Všechny tyto proteogenní (nebo též biogenní) aminokyseliny patří mezi {L}-α-aminokyseliny (přísně vzato kromě glycinu, který nemá chirální uhlík a nelze jej proto zatřídit do {L}- ani {D}-řady).
Vlastnosti[upravit | editovat zdroj]
Reaktivita[upravit | editovat zdroj]
Základní reaktivitu, společnou všem aminokyselinám, podmiňují karboxylová skupina a aminoskupina. Aminokyseliny mohou díky těmto dvěma skupinám vstupovat do všech obvyklých reakcí, které tyto funkční skupiny poskytují i u jiných organických látek. Vytvářejí soli, probíhá na nich esterifikace, acetylace, dále dekarboxylace (odstranění karboxylové skupiny), deaminace (odstranění aminové skupiny). Mohou se přesouvat aminové skupiny z jedné molekuly na druhou (transaminace). Nejdůležitější reakcí je vznik peptidové vazby, kde reagují α-karboxylová skupina jedné aminokyseliny s α-aminoskupinou druhé za odštěpení molekuly vody.
Další reakce mohou probíhat na postranním řetězci aminokyselin. Jak konkrétně může postranní řetězec té které aminokyseliny reagovat, je dáno jeho strukturou. Možností je řada; např. hydroxylace, dehydratace či oxidace hydroxy-aminokyselin, tvorba thioéterů (disulfidových můstků) u cysteinu, tvorba Schiffových bází (aldiminů) u aminokyselin s dusíkem v postranním řetězci, substituce aromatických jader a heterocyklů atd.
Rozpustnost[upravit | editovat zdroj]
Většina aminokyselin je snadno rozpustná v polárních rozpouštědlech (voda, etanol). Jsou nerozpustné v nepolárních rozpouštědlech (benzen, hexan, ether).
Elektrochemické vlastnosti[upravit | editovat zdroj]
Aminokyseliny obsahují přinejmenším dvě disociovatelné skupiny, -COOH (kyselý charakter) a -NH2 (zásaditý charakter).
- R-COOH R-COO− + H+
- R-NH3+ R-NH2 + H+
Při pH krve (7,4 resp. 7,1) existují karboxylové skupiny jako ionty R-COO− a většina aminoskupin jako R-NH3+. Vzniká tak amfion, obojetný ion, který nese kladný i záporný náboj.
Každá disociovatelná skupina je charakterizována svou disociační konstantou . Izoelektrický bod je taková hodnota pH, při které má aminokyselina nulový celkový elektrický náboj (netvoří amfion). Izoelektrické pH u aminokyselin, které mají jednu kyselou a jednu zásaditou skupinu, leží uprostřed hodnot jejich :
Biogenní aminokyseliny[upravit | editovat zdroj]
Kombinací těchto 20 (ve skutečnosti 21) biogenních aminokyselin jsou tvořeny všechny známé lidské bílkoviny.
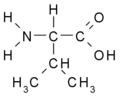
Aminokyseliny s alifatickým postranním řetězcem
S karboxylovou nebo amidovou skupinou na postranním řetězci (kyselé skupiny)
- Kyselina asparagová Asp (D)
- Asparagin Asn (N)
- Kyselina glutamová Glu (E)
- Glutamin Gln (Q)
S aminovou skupinou na postranním řetězci (basické skupiny)
S aromatickým jádrem nebo hydroxylovou skupinou na postranním řetězci
- Histidin His (H)
- Fenylalanin Phe (F)
- Serin Ser (S)
- Threonin Thr (T)
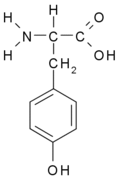
- Tyrozin Tyr (Y)
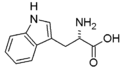
- Tryptofan Trp (W)
Se sírou v postranním řetězci
Iminokyseliny
- Prolin Pro (P)
21. aminokyselina
- Selenocystein SeCys – nahrazuje cystein v lidském enzymu glutathionperoxidáze a v enzymech některých bakterií
Esenciální aminokyseliny[upravit | editovat zdroj]
Esenciální jsou ty, které si tělo nedokáže samo vytvořit (obsahují řetězce, které tělo nedokáže syntetizovat). Jsou to rozvětvené aminokyseliny valin, leucin, izoleucin, aromatická aminokyselina fenylalanin, dále tryptofan se složitým heterocyklem a aminokyseliny s obtížně syntetizovatelnými postranními řetězci lyzin, methionin a threonin. U esenciálních aminokyselin jsme tedy odkázáni na jejich příjem v potravě.
Semiesenciální aminokyseliny[upravit | editovat zdroj]
Semiesenciální (neboli poloesenciální či podmíněně esenciální) jsou dvě aminokyseliny arginin a histidin. Lidský organismus je sice dokáže syntetizovat de novo, avšak jejich produkce není dostatečná pro podporu růstu. Jsou tedy esenciální jen pro děti a mláďata.
V některých situacích může mít i dospělý organismus zvýšené nároky na tyto aminokyseliny. Například při regeneraci tkání, během těhotenství a kojení nebo při intenzivní zátěži.
Neesenciální aminokyseliny[upravit | editovat zdroj]
Neesenciální aminokyseliny za určitých podmínek dokáže lidský metabolismus vytvořit dokáže a díky tomu dokáže krýt jejich potřebu pro organismus. Jejich uhlíkový řetězec se vytváří například v Krebsově cyklu. Zdrojem aminodusíku je ale prakticky výhradně jiná aminokyselina, syntéza neesenciálních aminokyselin de novo je tedy podmíněna příjmem aspoň nějakých aminokyselin potravou, nebo jejich uvolněním ze zásobních bílkovin.
Odkazy[upravit | editovat zdroj]
Související články[upravit | editovat zdroj]
Externí odkazy[upravit | editovat zdroj]
Použitá literatura[upravit | editovat zdroj]
- MURRAY, Robert K, et al. Harperova Biochemie. 4. vydání. Jinočany : Nakladatelství H+H, 2002. 872 s. ISBN 80-7319-013-3.
- KOTLÍK, Bohumír a Květoslava RŮŽIČKOVÁ. Chémia II. v kocke. 1. vydání. Havlíčkův Brod : Fragment, 1996. 135 s. ISBN 80-88879-97-3.
- Přispěvatelé Wikipedie. Aminokyseliny [online]. Wikipedie: Otevřená encyklopedie, ©2011. Poslední revize 2010-12-06, [cit. 2011-01-08]. <https://cs.wikipedia.org/wiki/Aminokyseliny>.