Kompartmentace metabolických drah (FBLT)
Náplň podkapitoly
- Význam kompartmentace pro buňku
- Biologické membrány
- Selektivní transport
- Intracelulární transport
- Kompartmentace drah
Význam kompartmentace pro buňku
- Všechny reakce probíhající v buňkách se odehrávají v určitém prostoru – kompartmentu, který je oddělen od ostatních kompartmentů semipermeabilními membránami. Takto jsou oddělena i chemicky různorodá prostředí, což v nich napomáhá optimalizovat průběh chemických reakcí.
- Enzymy katalyzující jednotlivé reakce mají totiž často různá teplotní a pH optima a při existenci jen jednoho prostoru v buňce by část enzymů pravděpodobně nebyla funkční nebo by jimi zprostředkovaná katalýza nebyla dostatečně efektivní. Rozdělením prostoru se mohou vytvořit optimální podmínky pro průběh jednotlivých enzymaticky katalyzovaných reakcí.
- Zároveň je před činností lytických enzymů chráněna i samotná buňka. Například uzavřením buněčného trávení do lyzosomů se znemožní nechtěné samonatrávení buněčných struktur. Častým jevem souvisejícím s narušením kompartmentace buňky (např. vylití obsahu lyzosomů nebo mitochondrií) je nekróza nebo aktivace apoptózy – programované buněčné smrti.
- Oddělením prostředí je ovlivněna i regulace metabolických drah. Ta může být přesnější a cílenější a nezasahuje do chodu drah probíhajících v jiných kompartmentech. Někdy lze regulovat průběh reakcí už na místě vstupu jednotlivých substrátů do kompartmentu (přestup přes membránu, často zprostředkován transportními mechanismy).
- Kompartmentace však zároveň klade zvýšené nároky na energetickou spotřebu buňky. Je nutné využít ATP-dependentních přenašečů transportujících látky přes membrány proti koncentračnímu gradientu a vytvářejících tak v oddělených prostorech různá prostředí.
Biologické membrány
Architektura
Základní architekturu cytoplazmatické membrány tlusté přibližně 6–10 nm tvoří fosfolipidová dvojvrstva prostoupená proteiny a cholesterolem. Na bílkoviny i fosfolipidy mohou být navázány sacharidy, které tak tvoří glykolipidy a glykoproteiny. Tato základní stavba, u membrán jednotlivých organel v různé míře pozměněná, ovlivňuje fyzikálně-chemické vlastnosti membrán (zejména jejich propustnost) úzce související s funkcí a průběhem biochemických procesů v příslušné organele.
Příkladem může být myelinová pochva neuronů, v níž činí poměr proteinů k lipidům 19 % : 81 % (což zapříčiňuje jejich vynikající izolační vlastnosti) nebo vnitřní membrána mitochondrií, ve které se poměr obrací ve prospěch proteinů 76 % : 24 % (a souvisí s její značnou nepropustností i pro látky, jež membránami běžně procházejí).
Molekuly fosfolipidů tvoří dvě fyzikálně odlišné části:
- Polární (hydrofilní) část
- Polární část je tvořena fosfátovou skupinou, případně na ni navázanými skupinami – tato část je obrácena směrem do vodného prostředí (nebo k jinému polárnímu rozpouštědlu).
- Nepolární (hydrofobní) část
- Nepolární část vytvářejí řetězce MK obrácené proti sobě a tvořící tak hydrofobní jádro membrány. Právě na základě hydrofobních interakcí mají fosfolipidy tendenci shlukovat se a tvořit membrány.
Molekula fosfolipidu tedy obsahuje jak polární, tak nepolární části, jedná se o tzv. amfipatickou molekulu.
Historická korelace
Současně používaný model popisující strukturu biologických membrán vytvořili v roce 1972 S. J. Singer a G. L. Nicolson. Podle tohoto fluidně mozaikového modelu můžeme membrány považovat za formu 2-dimensionální kapaliny, ve které molekuly fosfolipidů a proteinů v různé míře difundují.
Pohyblivost fosfolipidů je mnohem vyšší než mobilita ostatních komponent membrán. Proto místa, ve kterých jsou proteiny či cholesterol v membráně zabudovány, vykazují nižší laterální pohyblivost a membránu tak stabilizují (týká se to zejména cholesterolu). Části membrány tvořené převážně lipidy se někdy mohou překlopit na opačnou stranu tzv. flip-flop mechanismem.
Fluidita membrány závisí především na:
- Teplotě – při vyšší teplotě je membrána pohyblivější, tzv. fáze gel, při teplotách nižších je tužší, tzv. fáze sol
- Podílu nenasycených MK – čím je jejich obsah vyšší, tím je membrána pohyblivější (fáze gel)
Proteiny tvoří základní složku buněčných membrán. Podle jejich uložení v membráně je rozdělujeme na periferní a integrální proteiny.
- Periferní proteiny neprostupují do hydrofobního jádra membrány, vážou se jen na její povrch (z extra- nebo intracelulární strany), a proto se dají od membrány oddělit bez jejího poškození. Interakce, které se vazeb účastní jsou především elektrostatické síly a vodíkové můstky.
- Integrální proteiny membránou prostupují, a to buď v celé její tloušťce – tzv. transmembránové proteiny – nebo do různé hloubky. Oddělení těchto proteinů od membrány je spojeno s narušením její integrity.
Proteiny plní v biologických membránách funkci:
- receptorovou,
- transportní,
- enzymatickou.
Cholesterol tvoří asi jednu čtvrtinu všech lipidů v membráně. Molekula cholesterolu, podobně jako molekula fosfolipidů, má díky OH– skupině navázané na třetí uhlík amfipatický charakter. Základní funkcí cholesterolu v membránách živočišných buněk je jejich stabilizace a snižování fluidity.
Vlastnosti biologických membrán
Permeabilita, čili propustnost membrány (vyjadřuje míru pasivní difuze částic skrze membránu), se řídí Fickovým zákonem difuze a závisí na více faktorech:
- Velikost a polarita prostupující molekuly – malé a nepolární molekuly procházejí membránou snadno, zatímco větší a polární molekuly obvykle potřebují přenašeče nebo kanály.
- Koncentrační gradient – čím vyšší je koncentrace látky na jedné straně membrány, tím větší bude mít tendenci pronikat na stranu opačnou. Tohle pravidlo platí i pro ostatní gradienty – jako elektrochemický (daný rozdílem nábojů na obou stranách membrány) nebo osmotický (daný rozdílem osmoticky aktivních částic na obou stranách membrány).
- Tloušťka membrány – čím tlustší membrána, tím pomaleji přes ni látky procházejí.
- Plocha membrány – větší plochou membrány může za jednotku času projít větší množství látky.
Mezi další vlastnosti membrán patří míra tepelné a elektrické izolace, elektrického náboje. Celkový náboj cytoplazmatické membrány je negativní – je dán především negativními zbytky sialové kyseliny v glykolipidech a glykoproteinech. Membrány mají schopnost selektivního transportu.
Selektivní transport
Selektivní transport je proces, při kterém buněčná membrána umožňuje průchod pouze určitým látkám, zatímco jiné zadržuje. Tento mechanismus je zásadní pro udržení homeostázy a regulaci vnitřního prostředí buňky. Můžeme rozdělit na:
- Pasivní transport
- Aktivní transport
- Prostup makromolekul
Pasivní transport
Probíhá bez spotřeby energie, na základě fyzikálního principu difuze, jen s využitím koncentračního gradientu látky mezi oběma stranami membrány. Bez existence gradientu se pasivní transport zastaví. Rozlišujeme dva základní typy pasivního transportu – prostá a facilitovaná difuze.
Prostá difuze
Jde o přestup látek přes membránu bez pomoci transportních proteinů. Látky musejí projít hydrofobním centrem membrány, a proto je tento typ transportu typický zejména pro:
- malé nepolární molekuly – plyny (CO2, O2, …);
- malé polární molekuly – voda, močovina;
- větší nepolární molekuly – MK, cholesterol, vitaminy rozpustné v tucích.
Hydrofilní a větší molekuly (zejména s Mr > 200) procházejí prostou difuzí jen velice pomalu, případně téměř vůbec. Transportu iontů, jejichž molekuly jsou relativně malé, brání především objemný hydratační obal vytvořený molekulami vody.
Facilitovaná (usnadněná) difuze
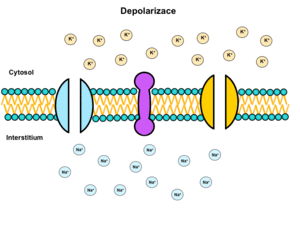
Jedná se o pasivní transport za pomoci transportních proteinů, na které se přenášená molekula nekovalentně naváže a jejichž prostřednictvím je přenesena na druhou stranu membrány. Facilitovaná difuze probíhá rychleji než prostá a může být spojena s transportem jiné látky v protisměru – tzv. antiport, např. ATP za ADP, Cl-za HCO3-). Nabízí se i možnost transportu přes tunelovou bílkovinu procházející skrz celou tloušťku membrány. Při přenosu dochází ke změně její konformace. Některé kanály mohou být ovládány na základě změn membránového potenciálu (napěťově-ovládané kanály).
Kinetika difuze
Kinetika prosté a facilitované difuze se liší. U difuze prosté dochází k lineárnímu nárůstu rychlosti difuze při zvyšování koncentrace přenášené látky. Přenašečové proteiny facilitované difuze mají ale kapacitu omezenou (je dána jejich celkovým počtem v membráně) a při vysokých koncentracích látky se rychlost difuze zpomaluje, až se ustálí na maximální rychlosti, při níž jsou přenašečové proteiny plně saturovány.
GLUT přenašeče
K nejvýznamnějším příkladům facilitované difuze patří transport glukózy prostřednictvím GLUT přenašečů (Glucose transporters). Kontinuální existenci koncentračního gradientu pro glukózu zabezpečuje její intracelulární přeměna na glukóza-6-fosfát a její následné využití v metabolických drahách. Celkově existuje až sedm typů GLUT přenašečů. Blíže se zmíníme jen o některých z nich:
- GLUT 1 a 3 slouží k udržení bazálního vychytávání glukózy tkáněmi, jejichž metabolismus je na glukóze závislý, např. mozek, erytrocyty, ale také ledviny a placenta.
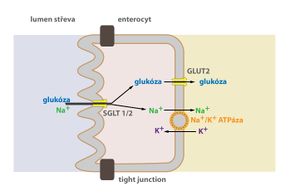
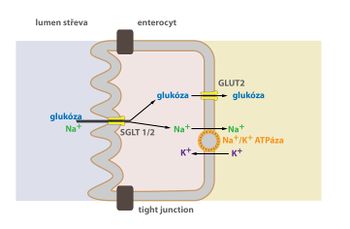
- GLUT 2 lokalizovaný na membráně β-buněk pankreatu a hepatocytů umožňuje také přestup glukózy z resorpčních epitelů (proximální tubulus ledvin, enterocyty střeva) do krve.
- GLUT 4 je transportérem glukózy v tzv. inzulin-dependentních tkáních (kosterní sval, myokard a tuková tkáň). Jeho vystavení na membráně je totiž podmíněno přítomností vyšších hladin inzulinu v krvi. K tomu dochází zejména po jídle, kdy jsou zmíněné tkáně zodpovědné za metabolismus až 80 % glukózy z krve. V období mezi jídly ji naopak neresorbují a šetří ji pro tkáně na ní závislé.
Aktivní transport
Může probíhat i proti koncentračnímu a elektrochemickému gradientu. Transport je v tomto případě spřažen s hydrolýzou ATP → ADP a Pi a uvolněná energie se využije na přenos. Rozlišujeme dva základní druhy aktivního transportu:
- Primární aktivní transport
- Sekundární aktivní transport
Primární aktivní transport
Energie ATP je využita přímo na přenos příslušné látky přes membránu. Jako příklady nám poslouží Na+/K+-ATPáza, H+/K+-ATPáza a Ca2+-ATPáza.
Na+/K+-ATPáza
Sodno-draselná pumpa je tetramer složený ze dvou alfa a dvou beta podjednotek. Alfa podjednotky prostupují celou šíří membrány, intracelulárně mají vazebné místo pro Na+ a extracelulárně pro K+. Beta podjednotky jsou na rozdíl od nich glykosylované a nejsou transmembránové (jsou otočeny svými oligosacharidovými řetězci směrem do extracelulárního prostoru).
Enzym může být přítomný ve dvou odlišných konformacích podle toho, zda je fosforylován anebo ne. Na+/K+-ATPáza funguje jako antiport a za spotřeby ATP přenáší 3 kationty Na+ směrem ven z buňky výměnou za 2 kationty K+ směřující dovnitř buňky. Tímto způsobem vytváří nerovnoměrné rozložení iontů na membráně, které je podkladem klidového membránového potenciálu. Na+/K+-ATPáza je ubikvitární – nachází se nejspíše na všech buňkách lidského těla.
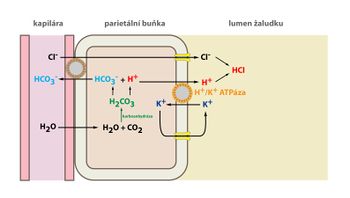
H+/K+-ATPáza
Je antiport fungující podobně jako Na+/K+-ATPáza, je lokalizován v parietálních buňkách žaludku, kde se podílí na tvorbě žaludeční šťávy, a v proximálních tubulech ledvin. Přenáší jeden iont H+ směrem ven z cytoplazmy výměnou za jeden iont K+.
Ca2+-ATPáza
Je vápníková pumpa, která se nejvíce objevuje ve svalových a nervových buňkách. Aktivně přečerpává vápenaté ionty směrem ven z cytoplazmy, a to buď do sarkoplazmatického retikula či extracelulárně. Ve svalech tím umožňuje snížit koncentraci Ca2+ na úroveň před kontrakcí.
Sekundární aktivní transport (sekundárně aktivní transport či kotransport)
V tomto případě je energie ATP využita nikoli přímo během přenosu příslušné látky (např. glukózy), ale k přenosu látky jiné (např. sodný kationt), pro kterou tím v buňce vzniká koncentrační nebo elektrochemický gradient. Ten je motorem pro přenos příslušné látky (glukózy) pomocí jejích přenašečů (Sodium Glucose Transporter – SGLT). Přenašeč provádějící sekundární aktivní transport (SGLT) tedy přemisťuje minimálně dvě částice – jednak tu, jež má být přenesena (glukóza), a jednak tu, která tento přenos pohání (Na+) – neboli pro kterou je v buňce gradient.
K tomu, aby byl tento gradient zachován, se vyžaduje druhý transportér (např. Na+/K+-ATPáza), který může být lokalizován i na jiném úseku membrány. Tento druhý transportér je místem, kde se spotřebovává energie (ATP) – proto aktivní transport. V závorkách se uvádí příklad sekundárně aktivního přenosu glukózy poháněného gradientem sodného kationtu skrze Sodium Glucose Transporter, gradient pro Na+ vytváří Na+/K+-ATPáza. Podle směru transportu rozlišujeme symport (obě částice jsou přenášeny stejným směrem – např. do buňky) a antiport (částice jsou přenášeny opačným směrem – jedna do buňky a jedna z buňky). SGLT provádí symport glukózy a Na+.
Na obdobném principu funguje i existence terciárního aktivního transportu.
Prostup makromolekul přes membránu
Může být podle směru:
- Exocytóza: proces, při kterém makromolekuly buňku opouštějí. Během exocytózy dochází k spojení membrány transportní vesikuly a cytoplazmatické membrány a makromolekuly mohou buď být uvolněny do mezibuněčného prostoru, nebo zůstat součástí povrchu buňky.
- Endocytóza: proces, při němž jsou makromolekuly buňkou přijímány. Cytoplazmatická membrána invaginuje dovnitř buňky, až se vytvoří transportní vesikula. Podle chemické povahy přenášených molekul se jedná o:
- Pinocytózu: přenos makromolekul ve formě roztoku. Proces může být neselektivní (místo invaginace na povrchu buňky je nahodilé) anebo selektivní (v místě specifických povrchových receptorů).
- Fagocytózu: ingesce velkých částic, které buňka nejprve obalí výběžky cytoplazmatické membrány (pseudopodie) a posléze kolem nich vytvoří vakuolu.
Intracelulární transport
Transport uvnitř buňky se může uskutečnit prostřednictvím:
- Difuze – látky rozpuštěné ve vodném prostředí cytosolu.
- Transportu sekrečními vezikuly – typicky se proteiny tvořené drsným ER nejdříve přesunou do GA a z něj se pak oddělují sekreční vezikuly nebo lyzosomy. Na transportu sekrečních vezikul se podílejí transportní motorové proteiny (dynein a kinesin), které se pohybují za spotřeby ATP po povrchu mikrotubulů (dynein směrem k – a kinesin k + koncům).
Kompartmentace drah
Cytosol
Jedná se o cytoplasmu samotnou, tzn. tekutá část bez organel. Odehrává se zde metabolismus:
- sacharidů: glykolýza, část glukoneogeneze, glykogenolýza a syntéza glykogenu a pentózový cyklus
- mastných kyselin: syntéza MK
- aminokyselin: syntéza neesenciálních AMK, některé transaminace
Mimo jiné zde probíhá i část drah syntézy hemu a močoviny, metabolismu purinů a pyrimidinů.
Mitochondrie
Patří k důležitým organelám buněčného metabolismu. Probíhá tady metabolismus:
- sacharidů: PDH, začátek glukoneogeneze (přeměna pyruvátu na oxalacetát)
- mastných kyselin: β-oxidace MK (Lynenova spirála), syntéza ketolátek (jen jaterní buňky), degradace ketolátek (jen extrahepatální tkáně)
- aminokyselin: oxidativní deaminace glutamátu a některé transaminace
Je zde lokalizována spojnice všech katabolických reakcí – Krebsův cyklus. Na vnitřní mitochondriální membráně probíhá dýchací řetězec a oxidativní fosforylace. Mitochondrie jsou také důležité pro syntézu hemu a močoviny.
Drsné endoplazmatické retikulum
Má důležitou roli v proteosyntéze (probíhá zde translace mRNA). Nasyntetizované proteiny se zde následně posttranslačně modifikují (oxidace, štěpení, metylace, fosforylace, glykosylace).
Hladké endoplasmatické retikulum
Má významnou roli v syntéze TAG a fosfolipidů. Jsou zde lokalizovány enzymy pro elongaci (do max. délky 24 uhlíků v nervové tkáni) a desaturaci (do max. vzdálenosti 9 uhlíků od karboxylové skupiny) mastných kyselin. Probíhá tady část syntézy steroidů a biotransformace xenobiotik. V některých tkáních je zde lokalizovaná glukóza-6-fosfatáza, která proměňuje glukóza-6-fosfát na glukózu.
Golgiho aparát
Také zde probíhá posttranslační modifikace proteinů (např. glykosylace), dále třídění proteinů a tvorba sekrečních vezikul.
Lyzosomy
Slouží k hydrolytickému štěpení proteinů, sacharidů, lipidů a nukleových kyselin.
Peroxisomy
Slouží na degradaci MK s dlouhým řetězcem (od 20 uhlíků).