Amyloidóza/PGS
| Tento článek je určen pro postgraduální studium | ||||
| Prosíme, neprovádějte věcné editace, nemáte-li potřebnou kvalifikaci. | ||||
| Editujte s rozvahou. Věcné změny nejprve projednejte v diskusi. | ||||
Amyloidóza (amyloidní dystrofie) je označení pro hlavní příznak skupiny onemocnění podmíněných depozicí amyloidu v řadě orgánů. Amyloid je nerozpustný degradační produkt některých proteinů, jeho název je odvozen od toho, že se při barvení Lugolovým roztokem chová podobně jako škrob. Depozita amyloidu mohou poškodit funkci orgánů natolik, že se klinicky manifestuje např. renální selhávání, malabsorpční syndrom nebo demence. Bezprostřední příčinou depozice mohou být patologické podmínky, obvykle chronické zánětlivé onemocnění, ale existují i dědičné formy onemocnění, při kterých některé mutantní proteiny vykazují vyšší náchylnost k depozici amyloidu. Molekulárním podkladem vlastností amyloidu je precipitace fragmentů bohatých na sekundární strukturu β sheet (skládaný list) a jejich skládání do charakteristických nevětvených fibril.
Historie[upravit | editovat zdroj]
Nejstarší popsaný případ pravděpodobné sekundární amyloidózy je z roku 1639, kdy Nicolaus Fontanus popsal "velkou slezinu vyplněnou kameny" při pitvě mladého muže s ascitem, ikterem a epistaxí. Pravděpodobně se jednalo o ságovou slezinu. Thomas Bartholin popsal v knize Historiarum Anatomicarum Rariorum (1654) pitevní nález ženy, jejíž slezina byla tak tuhá, že bylo možné ji jen s obtížemi řezat nožem. I zde se mohlo jednat o ságovou slezinu. Primární amyloidózu poprvé popsal nejspíše Samuel Wilks v roce 1856 jako pitevní nález u 52letého muže se "špekovitými" změnami orgánů. Wilks byl přesvědčen o proteinovém původu amyloidu. Hermann Weber popsal v roce 1967 první případ amyloidózy asociované s myelomem.
Vlastní termín amyloid poprvé použil v roce 1838 německý botanik Matthias Schleiden k popisu normální složky rostlinného pletiva. Německý patolog Rudolf Virchow použil termín amyloid v roce 1854 při zjištění, že corpora amylacea se barví jódem podobně jako škrob. Virchow předpokládal, že jde skutečně o depozita škrobu nebo glykogenu. Rozhodně nesouhlasil se zjištěním Carla Friedreicha a Augusta Kekulého, kteří v roce 1859 zjistili v amyloidu sleziny vysoký obsah dusíku, a tedy že jde spíše o látku bílkovinné povahy.
Nezávisle na sobě popsali v roce 1875 Anderé-Victor Cornil (Paříž), Richard Heschl (Vídeň) a Rudolf Jürgens (Berlín) použití anilinových barev k barvení amyloidu. Paul Ehrlich v roce 1878 použil Williamem Ackroydem zavedený termín metachromazie k popisu chování amyloidu při barvení anilinovými barvami, zejm. methylvioletí. Právě methylvioleť nahradila jodové reakce při mikroskopickém průkazu amyloidu. V roce 1922 popsal Hermann Bennhold barvení amyloidu kongo červení. Není bez zajímavosti, že vlastní pojem kongo červeň (konžská červeň) nemá s Kongem bezprostředně nic společného, v době syntézy nového anilinového barviva probíhaly v Berlíně diplomatické konference koloniálních velmocí týkající se zejména oblasti Konga a Kongo tím přišlo natolik do módy, že jako konžská byla označena i barva používaná původně k barvení textilií. Bennhold podával kongo červeň pacientům nitrožilně jako diagnostický test, protože nativně se barvily i zdravé tkáně, ovšem barvení se poměrně rychle vymylo, takže při biopsii provedené s vhodným odstupem bylo možné v preparátu připraveném metodou zmražených řezů prokázat amyloid jako zabarvenou substanci. Později zjistil, že pokud je tkáň po obarvení kongo červení vystavena roztoku uhličitanu lithného v 80% alkoholu, barví se pouze amyloid, ze zdravé tkáně je barva vymyta. Konečně charakteristický dvojlom popsali belgičané Divry a Florkin v roce 1927.
Cohen a Calkins popsali v roce 1959 amyloid v elektronovém mikroskopu jako vláknitou nevětvící se strukturu. Stejný obraz byl popsán u amyloidu z různých lokalit u primární i sekundární amyloidózy. Pras a kol. popsali v roce 1968 metodu extrakce amyloidu z tkání. Eanes a Glenner v roce 1968 studovali rentgenový difrakční vzor amyloidu, na základě kterého usoudili vysoký podíl β struktur amyloidu. V roce 1971 popsali Glenner a kol., že amyloid primární amyloidózy obsahuje aminokyselinové sekvence odpovídající lehkým řetězcům imunoglobulinů. Ve stejném roce popsali Benditt a kol. sekvenci amyloidu sekundární amyloidózy. Costa a kol. v roce 1978 a Skinner a Cohen v roce 1981 popsali prealbumin (transthyretin) jako další možný proteinový základ amyloidu u familiární amyloidové polyneuropatie. Postupně byly objeveny i další proteiny schopné podílet se na formování amyloidu.
Morfologie postižení[upravit | editovat zdroj]
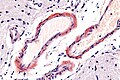
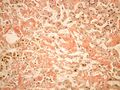
Makroskopicky je amyloid obvykle žlutavě šedobílý, poloprůsvitný, konzistence je obvykle křehké až drolivé, může být ale i poměrně pružný. Amyloidem infiltrované orgány bývají tužší, někdy pružnější, na řezu jsou pak matně lesklé způsobem, který starým patologům připomínal slaninu. V běžném barvení hematoxylinem a eosinem je amyloid amorfní, barví se růžově červeně. Při zobrazení elektronovým mikroskopem má amyloid fibrilární strukturu, je tvořen nevětvenými fibrilami průměru obvykle 8–10 nm (dle některých pramenů 6–12 nm), které vytvářejí poměrně hustou strukturu podobnou plsti.
Průkaz amyloidu[upravit | editovat zdroj]
- makroreakce – průkaz amyloidu v makroskopickém vzorku tkáně
- Virchow I – Lugolův roztok barví tkáň mahagonově hnědě
- Virchow II – po přenesení z Lugolova roztoku do kyseliny sírové se zbarví modrozeleně
- mikroskopický průkaz
- Reakce s Kongo červení (Benholdova r.) – oranžově červené zbarvení. Zajímavé je, že barva sama o sobě nemá význam, protože je odvislá mj. od tloušťky preparátu, významná je přítomnost dvojlomu[pozn. 1] a dichroismu[pozn. 2].
- Reakce s krystalvioletí (Cornilova-Weigertova r.) – červenofialové metachromatické barvení[pozn. 3]
- Reakce s tioflavinem S nebo T – žlutozelená fluorescence, citlivá, ale méně specifická metoda.
- imunochemický průkaz stavebního proteinu – Použití parafinových bloků je méně vhodné, protože fixace snižuje citlivost, proto je vhodnější použití zmražených preparátů (kryostatické řezy). Metoda je vhodná pro diagnostiku amyloidózy na podkladě SAA a β2 mikroglobulinu, v případě amyloidu na podkladě λ řetězců imunoglobulinů je méně citlivá.
Postižení jednotlivých orgánů[upravit | editovat zdroj]
V nadledvině se amyloid ukládá mezi sinusoidní kapiláry a trámce spongiocytů, nejvíce v zona fasciculata, vede k atrofii buněk. Ve slezině může být amyloid vázán především na folikuly, pak vytváří obraz ságové sleziny, může být vázán i na červenou pulpu, obraz šunkové sleziny. V ledvinách se amyloid ukládá nejprve do kliček glomerulů, při pokračování onemocnění se ukládá i do intersticia. Klinicky vede postižení ledvin k renálnímu selhávání. V játrech se amyloid ukládá do Disseho prostorů. Ve střevě se amyloid ukládá v bazální membráně střevního epitelu. Porucha funkce střeva může vést k malabsorbčnímu syndromu.
Patogeneze[upravit | editovat zdroj]
Amyloid je tvořen fibrilami tvořenými především výchozím proteinem. Bylo popsáno několik desítek proteinů, které mohou dát vznik amyloidu. Vznik fibril z proteinu je spontánní proces řízený fyzikálně chemickými vlastnostmi prekurzorového proteinu. Vznik fibril je podobný krystalizaci, fibrily nejlépe vznikají na podkladě existujících jader, tedy shluků patologických prekurzorových proteinů. Na dynamiku procesu vzniku amyloidu má vliv koncentrace jader, na kterých může docházet k rychlejšímu vzniku amyloidových fibril. Z hlediska dynamiky procesu lze rozlišit tři fáze tvorby amyloidu:
- nukleace (lag fáze) – pomalá oligomerace proteinů, resp. fragmentů proteinů, s patologickou konformací
- elongace – dostatečná koncentrace kondenzačních jader vede k tomu, že do vznikajících amyloidových fibril mohou být někdy vestavěny i proteiny s normální konformací, fibrily rychle narůstají
- steady-state – v ustáleném stavu nedochází k dalšímu růstu fibril.
I když bylo popsáno nejméně 27 různých prekurzorových proteinů uplatňujících se v lidské patologii, vzhled i vznik fibril je poměrně uniformní. Fibrily tvoří protofilamenta o průměru 25 nm z proteinových zbytků bohatých na strukturu β-list. Protofibrily mají průměr 25 nm a mohou se kolem sebe stáčet nebo adherovat k sobě laterálně. V zásadě lze rozlišit pět možných mechanismů, které mohou vést ke vzniku amyloidu:
- Propagace konformačních změn – Patologicky konformovaný protein indukuje změnu konformace i u normálně konformovaného proteinu. Tento mechanismus se uplatňuje především u prionových onemocnění.
- Selhání proteolytického procesu – Proteolytický proces chybně konformovaného proteinu může proběhnout nestandardně a zbyde špatně degradovatelný proteinový zbytek. Tento mechanismus se uplatňuje např. v patogenezi Alzheimerovy choroby.
- Mutace genu pro prekurzorový protein – V některých případech je patologická konformace způsobena zárodečnou mutací v genu. Jde o případ dědičných amyloidóz.
- Nadprodukce – Přílišná produkce fyziologického proteinu může sama o sobě zvýšit riziko vzniku kondenzačních jader amyloidových fibril. Podílí se na patogenezi zejm. lokalizovaných amyloidóz.
- Porucha kontroly kvality sestaveného proteinu
Amyloidové fibrily[upravit | editovat zdroj]
Proces vzniku amyloidových fibril je stále málo prostudovaný, protože detailní analýza struktury amyloidu je totiž velmi obtížná. Ukazuje se, že řada proteinů za specifických podmínek in vitro může zaujmout nefyziologickou konformaci (misfolding), která vede k agregaci; jen několik málo proteinů však zaujme takovou konformaci i za podmínek in vivo.
Proteiny, které mohou dát vzniknout amyloidu, jsou heterogenní skupinou proteinů různých funkcí i struktur. Obvyklým rysem těchto proteinů je vysoký podíl sekundárních struktur β-list, α-helix a β-helix, i když v amyloidu jsou prokazatelné jen β struktury. Během vzniku amyloidu dochází k fragmentaci původního proteinu, fyziologicky je v této fázi obvyklá úplná degradace.
Analýza rentgenového difrakčního vzoru amyloidu vedla již na konci 60. let ke zjištění, že amyloid je bohatý na β struktury, podobný vzor byl získán z amyloidu vzniklého z různých prekurzorových proteinů. Z biochemického pohledu je amyloid nekovalentně vázaný polymer, jehož monomerní jednotky jsou peptidy bohaté na β-list. Důsledkem misfoldingu proteinů je vysoký podíl β-listu v jejich sekundární struktuře. β-listy spolu za určitých okolností mohou interagovat poměrně silnou vazbou a to nejen v rámci jedné molekuly, ale i mezi molekulami. Vazba mezi jednotlivými molekulami dávají vzniknout tzv. cross-β struktuře. Pro další vlastnosti amyloidu je významné, že vzniklé struktury jsou poměrně hydrofobní. To je nejspíše zodpovědné za vysokou stabilitu amyloidu in vivo, nejspíše včetně toho, že amyloid prakticky nestimuluje zánětlivou reakci. Interakce mezi β-listy několika vede ke vzniku protofibril, podél jejichž dlouhé osy jsou βlisty jednotlivých peptidů orientovány podélně. Protofibrily se k sobě přikládají opět bočně jedna ke druhé, ovšem ve výsledku se skládají tak, že jsou čáslešně pootočené. V amyloidové fibrile jsou pak protofibrily uloženy kolmo k dlouhé ose fibrily, nejsou však v řadě za sebou. Je zajímavé, že amyloidové fibrily nejsou uniformní. To je pravděpodobně způsobeno tím, že je energeticky možných několik konformací a několik sestavení protofibril.
Není bez zajímavosti, že molekulární a mikroskopická struktura amyloidu propůjčuje amyloidu jako materiálu vysokou pevnost, vysoký modul pružnosti a odolnost vůči chemické degradaci. Proto probíhají i pokusy o syntézu materiálu se strukturou odvozenou z amyloidu pro použití např. v molekulární elektronice nebo ve tkáňovém inženýrství.
Koprecipitované komponenty[upravit | editovat zdroj]
Součástí amyloidových depozit nejsou jen amyloidové fibrily, obsahují i řadu dalších více či méně pevně vázaných látek, tzv. koprecipitované komponenty:
- Sérový amyloidový protein (SAP) – objemný komplex, který je běžnou součástí extracelulární matrix. Zdá se, že se SAP podílí na rezistenci amyloidu vůči proteolýze. SAP se váže na rostoucí i definitivá amyloidové fibrily, proto lze radioaktivně označený SAP využít k diagnostice.
- glykosaminoglykany ve všech typech byl prokázán zejm. heparan sulfát
- Apoproteiny – zřejmě hrají významnou roli při patogenezi, protože např. Apo E4 je významným rizikovým faktorem pro rozvoj Alzheimerovy choroby.
Buněčná a tkáňová toxicita[upravit | editovat zdroj]
Amyloid není z hlediska tkáňové biologie jen pasivní hmotou. I když nevyvolává úklidovou reakci, působí na toxicky na přiléhající buňky. Původně se předpokládalo, že za toxické působení je zodpovědné především to, že amyloid je fyzickou bariérou, která významným způsobem ovlivňuje výměnu látek nezbytných pro metabolismus buňky. Tento efekt mohl být potencován přítomnými makrofágy. Pozněji však bylo prokázáno, že nejméně stejně toxicky působí i rozpustné prekurzorové složky amyloidu, tedy že toxické působení amyloidu je mnohem komplexnější. Tak například v experimentu přidané solubilní fragmenty amyloidu původu z lehkých řetězců indukují apoptózu kardiomyocytů ve tkáňové kultuře.
Klasifikace amyloidózy[upravit | editovat zdroj]
Klasifikace amyloidózy se může zdát jako nepřehledná, protože prodělala vývoj od popisného klinického a patologického pohledu k molekulární podstatě, přitom oba pohledy mají své výhody.
Klasifikace dle klinického a patologického obrazu[upravit | editovat zdroj]
Jde o klasickou klasifikaci, která je založena především na klinickém obrazu. Každá skupina sdílí společné vlastnosti, není ovšem homogenní.
- sekundární amyloidóza
- primární amyloidóza
- lokalizovaná amyloidóza
Sekundární amyloidóza[upravit | editovat zdroj]
Sekundární amyloidóza se objevuje na podkladě dobře definovaného primárního onemocnění, které má obvykle charakter chronického zánětu. Obvykle vzniká při chronické osteomyelitidě, chronickém abscesu, revmatoidní artritidě, nádorovém onemocnění či tuberkulóze nebo syfilis. Depozice amyloidu není ovlivněna lokalizací primárního onemocnění, postiženy jsou nejčastěji následující orgány (seřazeno dle četnosti postižení):
Primární amyloidóza[upravit | editovat zdroj]
Definujícím znakem pro primární amyloidózu je chybění základního onemocnění, které by tvorbu amyloidu vysvětlilo. Liší se i lokalizace postižení, nejčastěji bývá postižen myokard a jazyk, méně často pak plíce a kůže, mohou být postiženy i jiné orgány. Amyloid se nemusí barvit zcela typicky, pak se nález označuje jako achromatická amyloidóza, atypická amyloidóza nebo paraamyloidóza. Klinicky primární amyloidóza obvykle rychle progreduje. Existují i hereditární formy.
Amyloid při plazmocytomu se liší se spektrem postižených orgánů, které je podobné spíše primární amyloidóze. Klasicky byl řazen mezi sekundární amyloidózy právě z toho důvodu, že je (patologicky) jasně patrné vyvolávající onemocnění.
Lokalizovaná amyloidóza[upravit | editovat zdroj]
- Nádorový amyloid není nádorové onemocnění, i když je možná souvislost s plazmocytomem. Jde o výrazné místní nakupení amyloidu, které se prezentuje jako nádor připomínající uzel. Nejčastěji se vyskytuje ve spojivce, v kůžu, v jazyce a v močovém měchýři, méně obvyklý je např. v dýchacích cestách.
- Amyloid ve stromatu nádoru se nejčastěji objevuje u nádorů tvořících některé hormony, např. nesidiom.
- Výše uvedené skupiny lze považovat za "klasické" (Bednář, 1981). Změny podobné amyloidóze, a to i na molekulární úrovni, probíhají např. u řady neurodegenerativních onemocnění (Alzheimerova nemoc, Parkinsonova nemoc, Demence s Lewyho tělísky nebo prionová onemocnění).
Klasifikace molekulární[upravit | editovat zdroj]
Molekulární klasifikace je založena na určení proteinu tvořícího amyloid. Obvykle se jedná o nemoc získanou, existují ovšem i hereditární formy. Nejčastější typy shrnuje následující tabulka:
| choroba | prekurzorový protein | upřesnění |
|---|---|---|
| AL amyloidóza | lehký řetězec imunoglobulinu | získaná mutace a nadprodukce |
| AH amyloidóza | těžký řetězec imunoglobulinu | nadprodukce při myelomu |
| Senilní systémová amyloidóza | transtyretin | akumulace běžného typu transtyretinu |
| Familiární amyloidová polyneuropatie | transtyretin | vrozená porucha |
| AA amyloidóza (sekundární a.) | SAA protein | nadprodukce SAA při zánětlivém onemocnění |
| Aβ2M amyloidóza (a. dialyzovaných) | β2-mikroglobulin | chronická hemodialýza |
| Lyzozymová amyloidóza (ALyz) | lyzozym | vrozená porucha |
| Apo AI amyloidóza (AApoI) | apolipoprotein AI | vrozená porucha |
| Apo AII amyloidóza (AApoII) | apolipoprotein AII | vrozená porucha |
| Apo AIV amyloidóza (AApoIV) | apolipoprotein AIV | vrozená porucha |
| Fibrinogenová amyloidóza (AFib) | α řetězec fibrinogenu | vrozená porucha |
| Finská hereditární amyloidóza (AGel) | gelsolin | vrozená porucha |
| Amyloidová angiopatie islandského typu (ACys) | Cystatin C | vrozená porucha |
| Familiární Britská demence (BriPP a.) | produkt genu BRI2 | vrozená porucha, stop kodon |
| Získaná renální amyloidóza (ALECT2) | leukocytární chemotaktický faktor 2 | získaná porucha |
| Amyloidóza aortální medie (AMed) | lacadherin | |
| Atriální amyloidóza (AANF) | atriální natriuretický faktor | někdy u pacientů s fibrilací |
| Amyloidóza asociovaná s medulárním karcinomem š.ž. | kalcitonin | omezen na nádor |
| spongiformní encefalopatie (AScr) | prion | získaná změna, omezeno na mozek |
| Amyloidóza Langerhansových ostrůvků | amyloidový polypeptid Langerhansových ostrůvků | lokalizace na Langerhansovy ostrůvky, někdy při DM 2. typu nebo v nesidiomu |
| Amyloidóza na bázi laktoferinu (ALac) | laktoferin | familiární postižení rohovky |
| Alzheimerova nemoc | amyloid β prekurzorový protein | získaná porucha |
| Hereditární cerebrální angiopatie (Aβ) | amyloid β prekurzorový protein | vrozená porucha |
Jednotlivé formy[upravit | editovat zdroj]
AL amyloidóza[upravit | editovat zdroj]
Amyloid je tvořen fragmenty lehkých řetězců (light chain) imunoglobulinů. Prakticky odpovídá primární amyloidóze v patologické klasifikaci, proto se názvy AL amyloidóza a primární amyloidóza obvykle používají jako synonyma.
Jde o nejčastější formu systémové amyloidózy, incidence v zemích Západu je zhruba 1/100 000 případů za rok. Obvykle se vyskytuje u pacientů starších 45 let s maximem výskytu kolem 67. roku věku. Medián přežití se dle publikovaných výsledků pohybuje mezi 10 a 42 měsíci.
Vlastní příčinou je monoklonální proliferace plasmatických buněk s nadprodukcí lehkých řetězců. Stávající terapie je zaměřena především na potlačení monoklonální proliferace, ovšem tato terapie není kurativní v tom smyslu, že potlačení nadprodukce lehkých řetězců obvykle nevede k regresi postižení. Depozita amyloidu se mohou vyskytnou prakticky kdekoliv v těle, nejčastěji se však vyskytnou v následujících lokalitách:
Zvláštní - ovšem ne zcela neobvyklou - formou depozice amyloidu je amyloidom, tumorózní nakupení amyloidu kdekoliv v těle včetně mozku. Pokud je postiženo srdce, je prognóza pacietnů výrazně horší.
Výše popsaná klonální expanze plasmatických buněk obvykle není doprovázena klinicky manifestním mnohočetným myelomem, v kostní dřeni je obvykle méně než 10 % myelomových buněk. Důvod nadprodukce lehkých řetězců spočívá v tom, že lehké a těžké řetězce jsou i v nenádorových buňkách produkovány nezávisle na sobě, ovšem ve vyrovnaném poměru. U nádorových buněk může dojít k porušení tohoto poměru, obvykle ve prospěch lehkých řetězců, kterých může být syntetizován troj- až čtyřnásobek ve srovnání s těžkými řetězci. Tím se objevují volné lehké řetězce v množství, které je dostatečné ke vzniku a růstu depozit amyloidu. Samotná přítomnost lehkých řetězců v séru a případně i v moči je prokazatelná u poměrně velkého počtu osob nad 50 let, k rozvoji klinicky manifestní amyloidózy tedy nepostačuje. Vlastní amyloidogeneze je podmíněna interakcí biofyzikálních vlastností konkrétního prekurzorového proteinu a mikroprostředí v cílové tkáni. Lehké řetězce jsou vzhledem ke své sekvenci poměrně heterogenní skupinou proteinů; ukazuje se, že některé variabilní domény dávají vzniknout amyloidu výrazně častěji.
Při rozvoji primární amyloidózy jsou postiženy nejprve cévy. Prakticky u všech pacientů s primární amyloidózou lze prokázat endoteliální mikrocirkulační poruchu, která vede např. k prokazatelným ischemickým změnám na myokardu. Mechanismy, jakými je narušena mikrocirkulace, nejsou známy; je však zřejmé, že nejde jen o pasivní překážku difuze významných látek, ale že amyloid ovlivňuje i reaktivitu cév.
Podezření na primární amyloidózu by měl vyvolat nález jinak nevysvětlitelné nefropatie, srdečního selhání, periferní nebo autonomní neuropatie, hepatomegalie, splenomegalie nebo postižení více orgánových systémů. Zhruba 50 % případů se manifestuje postižením ledvin s proteinurií a nefrotickým syndromem. U nemocných se může objevit získaný deficit faktoru X, který může mimo jiné komplikovat provedení biopsie. Městnavé srdeční selhávání v důsledku postižení srdce se objevuje asi u 15–30 % pacientů. Posturální hypotenze může být přímým důsledkem postižení srdce, ale může být vyvolána i amyloidovou neuropatií nebo následkem změn způsobených nefrotickým syndromem. Postižení jater je téměř pravidlem, ovšem klinická manifestace je obvykle méně výrazná a klinickému obrazu nedominuje.
Prognóza neléčené primární amyloidózy je velmi špatná; medián přežití se pohybuje mezi 6 a 15 měsíci, desetileté přežití je menší než 5 %. Stávající terapie je zaměřena na zastavení produkce volných lehkých řetězců. Při potlačení klonální expanze chemoterapií poškození orgánů nepokračuje, bylo popsáno i několik případů remise amyloidových depozit. Významné zlepšení intervalu přežití je spojeno s časnou intervencí. Chemoterapie se volí podle zkušeností s terapií mnohočetného myelomu. Zkušenosti s transplantací autologních kmenových buněk jsou rozporné, protože výkon sám je zatížen vysokou mortalitou.
Nedílnou součástí terapie je symptomatická terapie komplikací. Terapie srdečního selhávání a nefrotického syndromu diuretiky má vitální význam. Postižení autonomního nervového systému je obtížně řešitelné, někdy může dobře reagovat na fludrokortizon a midodrin. Pacienti jsou vnímavější na infekční onemocnění, proto je vhodné očkování proti sezónní chřipce a indikace nasazení antibiotik by měly být mnohem volnější. Transplantace selhávajících orgánů zůstává kontroverzní otázkou.
Sekundární amyloidóza[upravit | editovat zdroj]
Sekundární amyloidóza, obvykle značená jako AA amyloidóza, je poměrně vzácnou komplikací prakticky každého chronicky probíhajícího zánětlivého onemocnění, chronické infekce nebo nádorového onemocnění. Vyvolávajícím faktorem je dlouhodobá elevace proteinů akutní fáze, konkrétně SAA proteinu.
V minulosti byla nejčastější příčinou chronického zánětu tuberkulóza, dnes se sekundární amyloidóza objevuje nejčastěji jako komplikace revmatických onemocnění, zejm. revmatoidní artritidy, ankylozující spondylitidy, psoriatické artritidy a juvenilní idiopatické artritidy. Sekundárná amyloidóza doprovázející revmatická onemocnění představuje zhruba 50–70 % všech případů. Na druhou stranu frekvence postižení u revmatologických pacientů je nižší, např. dle pitevního nálezu u pacientů léčených s revmatoidní artritidou se sekundární amyloidóza vyvinula u necelých 6 % nemocných. Sekundární amyloidóza je ovšem závažnou komplikací, odhaduje se, že zhruba 3 % nemocných s revmatoidní artritidou umírá na komplikace sekundární amyloidózy. Ve srovnání se studiemi provedenými v minulosti je patrný klesající trend výskytu sekundární amyloidózy u revmatologických pacientů. V rozvojových zemích je spektrum příčin jiné, výrazněji se uplatňují chronické infekce.
Výčet stavů asociovaných se sekundární amyloidózou:
- Revmatické choroby
- Revmatoidní artritida
- Ankylozující spondylitida
- Juvenilní idiopatická artritida
- Stillova nemoc, adultní forma
- Psoriatická artritida
- Reaktivní artritida
- Behçetova nemoc
- Velkobuněčná arteriitida
- Polyarteritis nodosa
- Takayasuova arteriitida
- Dna
- Oxalátová arthritida
- Systémový lupus erythematosus (raritně)
- Systémová skleróza (raritně)
- Sjögrenův syndrom
- Nádory
- Hereditární periodické horečky
- Familiární středomořská horečka
- Periodický syndrom asociovaný s TNF receptorem
- Muckle-Wellsův syndrom
- Hyperimmunoglobulinémie D
- FCAS (Familial Cold Autoinflammatory Syndrome)
- Střevní zánětlivá onemocnění
- Chronické infekce
- Bronchiektázie
- Chronické kožní ulcerace a dekubity
- Chronická pyelonefritida
- Lepra
- Osteomyelitida
- Tuberkulóza
- Whippleho nemoc
- Subakutní bakteriální endokarditida
- Další stavy
- AIDS
- CVID (Common Variable ImmunoDeficiency)
- Cyklická neutropenie
- Pohlavně vázaná agamaglobulinémie
- Hypogammaglobulinémie
- Epidermolysis bullosa
- Sarkoidóza
- Cystická fibróza
- Atriální myxom
- Rosai-Dorfmanova nemoc
- Srpkovitá anémie
- Schnitzlerův syndrom
- Idiopatická retroperitoneální fibróza
V době diagnózy se sekundární amyloidóza obvykle (až 95 % případů) manifestuje jako proteinurie nebo renální selhávání s různě rychlou progresí, která u zhruba 10 % pacientů dosáhne až ESRD (End Stage Renal Disease). Postižení jater a sleziny je prokazatelné např. radioaktivně značeným SAP, klinicky se však manifestuje jen zřídka. Postižení sleziny se klinicky může manifestovat častějšími infekcemi, z laboratorních vyšetření pro výraznější postižení sleziny hovoří zejména nález vyššího počtu Howell-Jollyho tělísek v periferní krvi. Amyloid může infiltrovat submukózu gastrointestinálního traktu, případné postižení se pak klinicky manifestuje malabsorbčním syndromem, pseudoobstrukcí, zvracením nebo průjmem. Infiltrace cév gastrointestinálního traktu zvyšuje riziko gastrointestinálního krvácení i perforace stěny. Případná infiltrace štítné žlázy se klinicky manifestuje jako struma. Jen výjimečně je postižen myokard a rozvíjí se kardiomyopatie; prognosticky jde o špatný stav. Rovněž amyloidová neuropatie z infiltrace periferních nervů je raritní komplikací.
Prognóza pacientů se sekundární amyloidózou se zlepšuje. Např. v roce 1991 byl odhadovaný medián přežití pacientů 24 měsíců, studie publikované na konci první dekády 21. století již medián přežití posouvají na hodnotu kolem 10 let. Prognosticky nepříznivými faktory jsou vyšší věk pacienta, nižší hladina sérového albuminu a ESRD v době diagnózy.
Hladina SAA jako ukazatele probíhajícího zánětu je velmi dobrým prognostickým faktorem s přímou vazbou na biologii onemocnění. Je-li hladina SAA snížena léčbou základního onemocnění pod 5 mg/l, je poměrně často dosaženo regrese postižení všech orgánů s výjimkou ledvin. Postižení ledvin bývá obvykle ireverzibilní a proto lze očekávat nejvýše zachování funkce a nezhoršování.
Amyloidóza chronicky dialyzovaných[upravit | editovat zdroj]
Amyloidóza chronicky dialyzovaných (β2M amyloidóza) je závažnou komplikací chronické hemodialýzy. Fibrily se formují z β2 mikroglobulinu, součásti HLA. β2 mikroglobulin se může akumulovat, protože jeho degradace probíhá poměrně neobvyklým způsobem. Protein normálně prochází přes glomerulární membránu do primární moči a je resorbován a degradován v proximálních renálních tubulech. Pokud dojde k rozvoji ESRD (End Stage Renal Disease), protein se hromadí a hladina z fyziologických hodnot 1–2 mg/l může vystoupat na 50–70 mg/l.
Rozvoj onemocnění je pozvolný, obvykle se objevuje až po 10 letech po zahájení dialýzy. β2M amyloid se deponuje především v pohybovém aparátu, manifestuje se obvykle jako syndrom karpálního tunelu, artralgie, spondylartropatie, subchondrální kostní cysty a patologické fraktury.
Senilní systémová amyloidóza[upravit | editovat zdroj]
Senilní systémová amyloidóza (ATTRWT amyloidóza) je chorobou starších lidí, častěji se vyskytuje u mužů. Prekurzorovým proteinem amyloidových fibril je normální transthyretin. Jde nejspíše o poměrně běžný stav, amyloid je prokazatelný u hruba 25 % pitvaných starších 80 let.
Depozita vznikají obvykle v srdci, obvykle jde o asymptomatická depozita. Pokud senilní amyloidóza dospěje do klinického stádia, manifestuje se jako restriktivní kardiomyopatie a městnavé srdeční selhání. Klinicky němá depozita jsou prokazatelná v řadě dalších orgánů, zejm. v plicích, ve střevě, v močovém měchýři a ve stěně malých tepen.
Familiární amyloidová polyneuropatie[upravit | editovat zdroj]
Familiární amyloidová neuropatie (hereditární transthyretinová amyloidóza, ATTR amyloidóza, FAP) je nejčastější hereditární amyloidózou. Základním klinickým projevem je progresivní periferní i autonomní neuropatie. Bylo popsáno zhruba 100 bodových mutací genu pro transthyretin (prealbumin), které jsou za vznik FAP zodpovědné. Ke klinické manifestaci dochází obvykle ve třetí dekádě, ale věk nástupu i šíře dalších projevů je odvislá od konkrétní mutace. Celkově je fatální progresivní onemocnění, od počátku symptomů není očekávaná života delší než 10 let. Časnější nástup symptomů bývá spojen s horší prognózou. Vedle nervové tkáně bývá často postiženo i srdce.
- Portugalská forma (ATTRV30M, amyloidóza portugalského typu) je nejčastější, je způsobena náhradou valinu na pozici 30 methioninem (V30M). Choroba se nejčastěji manifestuje mezi 30. a 40. rokem, od ostatních forem se liší tím, že postižení srdce je výjimečné. Většina nemocných se nachází v Portugalsku, ale tatáž mutace byla prokázána i ve Švédsku.
- Varianta T60A je nejčastější v Irsku a ve Spojeném království. Obvykle se projevuje kolem 50. roku věku poruchami autonomního nervového systému. Postižení myokardu v době diagnózy klinickému obrazu nedominuje, ale je prokazatelné prakticky ve všech případech.
- Varianta V122I se vyskytuje asi u 3–4 % černochů, která se klinicky manifestuje ve věku nad 60 let jako postižení myokardu. Neuropatie obvykle nebývá součástí klinického obrazu.
Klíčovou roli v terapii hraje ortotopická transplantace jater, protože většina mutantního transthyretinu je produkována právě v játrech. Vlastní načasování transplantace je stále předmětem debat.
Výzkum se zaměřuje na další terapeutické strategie, především na stabilizaci rozpustného transthyretinu v krvi a na útlum exprese transthyretinu.
Hereditární gelsolinová amyloidóza[upravit | editovat zdroj]
Hereditární gelsolinová amyloidóza (amyloidóza finského typu) je způsobena mutací genu pro gelsolin. Většina popsaných případů je z Finska. Byly popsány dvě mutace: G645A a G645T. Obvykle se prezentuje jako mřížková dystrofie rohovky (lattice corneal dystrophy) ve středním věku, postupně se vyvíjí pomalu progredující ale výrazně pacienta poškozující neuropatie hlavových nervů. Onemocnění prakticky nezkracuje očekávanou délku života. Depozita amyloidu v ledvinách bývají prokazatelná již v době diagnózy, obvykle ale nevedou ke klinické manifestaci. Vzácně se vyskytují i nemocní homozygoté, u kterých dochází naopak k velmi rychlému horšení renálních funkcí.
Diagnostika systémové amyloidózy[upravit | editovat zdroj]
Diagnózu komplikuje klinicky značně heterogenní obraz onemocnění, proto je diagnóza stanovena obvykle poměrně pozdě, výjimečné není ani to, že je amyloidóza neočekávaným nálezem při histopatologickém vyšetření.
Histopatologická diagnostika[upravit | editovat zdroj]
Pro histopatologickou diagnostiku je zlatým standardem barvení kongo červení a průkaz dvojlomu, imunohistochemické vyšetření hraje roli při určení typu fibril. Imunochemické vyšetření je ovšem poměrně málo senzitivní i specifické, protože amyloidové fibrily mohou poměrně často ztrácet antigenní specifitu a naopak může docházet k poměrně nespecifickému barvení, zejm. v případě primární amyloidózy. Efektivní metodou typizace amyloidů by zřejmě mohla být hmotnostní spektroskopie vzorků získaných pomocí laserové mikrodisekce.
Pro vyloučení mnohočetného myelomu jako příčiny AL amyloidózy může být vhodné vyšetření kostní dřeně.
Zobrazovací techniky[upravit | editovat zdroj]
Specifickou technikou pro průkaz amyloidových depozit v těle pacienta je scintigrafické vyšetření za použití radioaktivně značeného proteinu SAP, obvykle 123I-SAP. SAP se totiž reverzibilně váže na všechny známé typy amyloidu, rovnováhy je dosaženo velmi rychle. Metoda není vhodná pro vyšetření malých nebo pohyblivých struktur, nehodí se tedy k hodnocení postižení srdce a nervů.
K hodnocení závažnosti postižení srde je vhodná echokardiografie. Pro amyloidózu srdce je charakterické ztluštění stěny stěn komor, ztluštění chlopní a diastolická restrikce. Postižení srdce je pravděpodobné, pokud je střední tloušťka stěny levé komory větší než 12 mm bez přítomnosti faktorů, které by mohly hypertrofii vyvolat, tj. zejm. bez přítomnosti hypertenze.
Magnetická rezonance srdce může odhalit poměrně charakteristické pozdní zesílení gadoliniem subendokardiálně nebo difuzně.
Rentgenové vyšetření skeletu je vhodným doplňkem k vyloučení mnohočetného myelomu.
Laboratorní vyšetření[upravit | editovat zdroj]
Biochemické ukazatele slouží především jako marker závažnosti postižení jednotlivých orgánů.
V případě primárních amyloidóz lze prokázat monoklonální produkci patologického proteinu v séru a obvykle i v moči. Kvantitativní vysoce senzitivní analýza hladiny lehkých řetězců je jedním z nejcitlivějších ukazatelů odpovědi na chemoterapii v případě AL amyloidózy.
Genetické vyšetření[upravit | editovat zdroj]
Odhaduje se, že 5–10 % všech systémových amyloidóz vzniká na dědičném podkladě, proto je vhodné doplnit i genetické vyšetření.
Histologické preparáty[upravit | editovat zdroj]
Odkazy[upravit | editovat zdroj]
Poznámky pod čarou[upravit | editovat zdroj]
- ↑ Dvojlom je vlastností některých opticky anizotropních látek. Světelný paprsek nerovnoběžný s optickou osou se po vstupu do takové látky rozdělí na dva různé paprsky, oba jsou lineárně polarizované.
- ↑ Dichroismus je vlastnost některých látek, které se jeví bezbarvé, ale v polarizovaném světle mohou část spektra absorbovat a tak se jevit barevnými.
- ↑ Metachromatické barvení je takové barvení, při kterém má obarvená struktura jiný barevný tón než použité barvivo.
Literatura[upravit | editovat zdroj]
- ELLEDER, M.. Vybrané kapitoly z patologie buňky II. 1. vydání. Praha : Karolinum, 2009. ISBN 80-7184-748-8.
- KYLE, R.A.. Amyloidosis: a convoluted story. Br J Haematol. [online]. 2001, vol. 114, no. 3, s. 529-38, dostupné také z <http://www.bloodmed.com/home/hannpdf/bjh2999.pdf>. ISSN 0007-1048.
- SIPE, J.D. a A.S. COHEN. Review: history of the amyloid fibril. J Struct Biol. [online]. 2000, vol. 130, no. 2-3, s. 88-98, dostupné také z <https://www.researchgate.net/publication/12380967_Review_History_of_the_Amyloid_Fibril>. ISSN 1047-8477.
- BLANCAS-MEJÍA, L. M. a M. RAMIREZ-ALVARADO. Systemic amyloidoses. Annu Rev Biochem.. 2013, vol. 82, s. 745-74, ISSN 1545-4509.
- PERFETTO, F., A. MOGGI-PIGNONE a R. LIVI, et al. Systemic amyloidosis: a challenge for the rheumatologist. Nat Rev Rheumatol.. 2010, vol. 6, no. 7, s. 417-29, ISSN 1759-4804.
- PINNEY, J. H. a P. N. HAWKINS. Amyloidosis. Ann Clin Biochem.. 2012, vol. 49, no. Pt 3, s. 229-41, ISSN 1758-1001.
- PINNEY, J. H. a H. J. LACHMANN. Systemic AA amyloidosis. Subcell Biochem.. 2012, vol. 65, s. 541-64, ISSN 0306-0225.
- SCHLEEGER, M., C. C. VAN DEN AKKER a T. DECKERT-GAUDING, et al. Amyloids: From molecular structure to mechanical properties. Polymer [online]. 2013, vol. 54, no. 10, s. 2473-2488, dostupné také z <http://www.sciencedirect.com/science/article/pii/S0032386113001638>. ISSN 0032-3861.
Související články[upravit | editovat zdroj]
Externí odkazy[upravit | editovat zdroj]
- HOLMES, JR., R. O.. Medscape : Amyloidosis [online]. ©2014. [cit. 5/2014]. <https://emedicine.medscape.com/article/335414-overview>.
- NYIRADY, J.. Medscape : Primary Systemic Amyloidosis [online]. ©2014. [cit. 5/2014]. <https://emedicine.medscape.com/article/1093258-overview>.
- DHAWAN, R.. Medscape : AA (Inflammatory) Amyloidosis [online]. ©2013. [cit. 5/2014]. <https://emedicine.medscape.com/article/335559-overview>.