Kmenové buňky
Z WikiSkript
(přesměrováno z Kmenová buňka)
Kmenové buňky či SC (stem cells) jsou buňky schopné obnovovat poškozené nebo opotřebované části a udržovat homeostázu organismu. Buňky s časově neomezenou schopností sebeobnovy, jejichž mitotickým dělením vzniká jedna buňka identická s mateřskou (pro udržení poolu kmenových buněk) a buňka, která může dát vzniknout alespoň jednomu vysoce diferenciovanému buněčnému typu.
SC musí splňovat čtyři kritéria (splněna u ESC; u hematopoetické a nervové SC je sebeobnova mírně snížena vlivem snížené hladiny telomerázy):
- podstupuje mnohočetná mitotická dělení, kterými se regeneruje;
- dceřiné buňky se diferencují ve více než jeden buněčný typ (vjm. některé ASC);
- při transplantaci jsou schopné funkčního znovuosídlení tkáně svého původu;
- in vivo přispívají k tvorbě diferenciovaných buněčných populací (i bez poškození).
Základní druhy SC[upravit | editovat zdroj]
- Embryonální karcinomové buňky ECC – z testikulárních nádorů (heteroploidní);
- embryonální kmenové buňky ESC – z vnitřní buněčné masy preimplantačních embryí (euploidní);
- embryonální zárodečné buňky EGC – z prvopohlavních buněk postimplantačních embryí (euploidní);
- kmenové buňky z pupečníkové krve – pupečníková krev obsahuje více typů kmenových buněk (hematopoetické, mesenchymální)[1]
- kmenové buňky plodové vody AFC – z plodové vody (euploidní);
- dospělé (orgánové) kmenové buňky ASC – z dospělých tkání (euploidní) (např. HSC, NSC);
- indukované kmenové buňky iPSC – s genovými manipulacemi (inzerce 3–4 genů – Oct-3 a 4, SOX geny; Klf a Myc geny, Nanog, LIN28) upravených somatických buněk (fibroblastů), podobné ESC.
Rozdělení podle určení osudu SC[upravit | editovat zdroj]
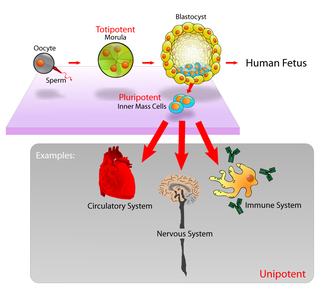
- Totipotentní SC neboli omnipotentní SC mohou vytvořit celého nového jedince (embryoblast i trofoblast) – např. zygota 2-buněčná myší blastomera, 4–8-buněčná lidská blastomera.
- Pluripotentní SC se dovedou specifikovat v jakoukoliv buňku lidského těla. Nejsou schopny vytvořit nového jedince (tj. nedovedou vytvořit trofoblast) – poprvé popsány u teratokarcinomů (= nádory gonád obsahující buňky všech 3 primárních zárodečných listů vzniklé z ECC). Kmenové buňky možno třídit podle toho, kdy a kde se vytvořily v průběhu vývoje organismu a jak jsou použitelné. Pluripotentní kmenové buňky mohou být zdrojem všech typů buněk. Nejlépe jsou charakterizovány embryonální kmenové buňky (embryonic stem cells = ES) myší i lidské. Jsou to linie pluripotentních buněk odvozených od nediferencovaných embryonálních buněk, jejichž charakteristikou je téměř neomezené samoobnovování v nediferencované formě a velmi široká diferenciační schopnost (pluripotence). Mají tedy podobné vlastnosti nediferencované embryonální zárodečné buňky (embryonic germ cells = EG, primordial germ cells = PGC). Kandidáti obou linií (ES a EG) z blastocysty lidského zárodku nebo z embryonálních gonád se mohou diferencovat na řadu různých typů somatických buněk. Lidské pluripotentní kmenové buňky představují možný zdroj obnovy diferencovaných buněk při náhradě poškozených nebo nemocných tkání buněčnou transplantací. Embryonální kmenové buňky, které jsou lokalizovány na vnitřní části blastocysty, jsou plně pluripotentní a mohou se množit neomezeně v nediferencovaném stavu, anebo diferencovat na všechny varianty buněk in vivo a na mnohé in vitro.
- Multipotentní SC dávají vzniknout více než 1 buněčnému typu (HSC, NSC). Kmenové buňky z tkání dospělých jedinců (nebo embryí z pozdějších fází vývoje) jsou více omezeny ve svých schopnostech růstu a diferenciace. Kupř. krvetvorné kmenové buňky mohou vytvořit všechny typy krevních elementů „in vivo“, ale jen málo rostou v buněčné kultuře a nejsou vhodné pro produkci buněk jiných tkání. Kmenové buňky pozdějších stádií vývoje se vyskytují ve většině orgánů – kmenové buňky hematopoetické, gastrointestinální, epidermální, jaterní, mesenchymové nebo nervové. Až do nedávna se soudilo, že tyto multipotentní progenitorové buňky (MAPC) se mohou diferencovat pouze v buňky téže buněčné linie (tkáňově specifické). Ukázalo se však, že po transplantaci kostní dřeně nebo obohacených hematopoetických kmenových buněk bylo možno prokázat i myoblasty kosterního svalstva nebo myokardu, endotelu, také epitelie plic, střeva, žlučových cest a jater, kůže nebo neuroektodermu. Jiné experimemty pak prokázaly, že kmenové buňky nervové nebo svalové mohou diferencovat na buňky hematopoetické. V experimentu bylo prokázáno, že MAPC vyžadují pro uplatnění své plasticity (tj. multipotence v diferenciaci a množení) prostředí embryonálních kmenových buněk (tedy prostředí blastocysty) s expresí jejich genetických markerů: Oct-4, Rex-1, SSEA-1. To se zdá být slibné pro terapii degenerativních a vrozených chorob.
- Oligopotentní SC mohou diferenciovat do více buněčných typů. (Lymfoidní kmenové kuňky- T a B lymfocyty, NK)
- Unipotentní (Progenitorové buňky- nejsou kmenové) dávají vzniknout jednomu buněčnému typu (spermatogonie). Užití pro terapeutické účely (léčba neplodnosti).
Získávání terapeutických SC[upravit | editovat zdroj]
ESC se připravují z časných lidských embryí po oplození in vitro[upravit | editovat zdroj]
- Rutinně jsou oplozena vajíčka v laboratorních podmínkách – některá se dají do dělohy matky, ostatní se zamrazí a uskladní v tekutém dusíku, většinou jsou potom zničena;
- potenciální zdroj pro výzkum nebo terapii závažných chorob;
- kritika – zničení budoucího lidského života.
ESC kultivované z prvopohlavních buněk lidského embrya[upravit | editovat zdroj]
- Nediferencované buňky, ze kterých by se v pohlavních žlázách vyvinuly oocyty nebo spermie;
- zdrojem jsou plody po umělém přerušení těhotenství.
ESC jako produkt terapeutického klonování[upravit | editovat zdroj]
- Rediferenciace snadno dostupných buněk pacienta v ty potřebné k uzdravení;
- vytvoření embrya ze somatické buňky lidského těla;
- pacientovi je odebrána specializovaná somatická buňka (z ústní sliznice, kožní), její jádro je vpraveno do enukleovaného oocytu a vznikající zárodek je použit k produkci ESC a buněk pro buněčnou terapii;
- výhoda – genetická totožnost pacienta a ESC, imunitní systém transplantované buňky přijme.
iPSC vzniklé genovými mutacemi[upravit | editovat zdroj]
- Klinické testování, žádné etické problémy.
ASC z kostní dřeně (1 z 1010)[upravit | editovat zdroj]
- Plasticita = schopnost tkáňově specifických SC nabýt buněčných typů tkání odlišného původu;
- možnost použití jako tzv. autologní štěpy.
Alternativní cesty pro buněčnou terapii[upravit | editovat zdroj]
- Vytvoření univerzálně přijatelných SC;
- vytvoření rozsáhlého souboru lidských ESC, mezi kterými by bylo možné najít SC pro jakéhokoliv pacienta.
Odkazy[upravit | editovat zdroj]
Související články[upravit | editovat zdroj]
Reference[upravit | editovat zdroj]
- ↑ KLABUSAY, Martin. Kmenové buňky v kardiologii: minulost, současnost a budoucnost celulární terapie poškozeného myokardu. Interní medicína pro praxi [online]. 2009, roč. 11, vol. 10, s. 453, dostupné také z <http://www.solen.cz/pdfs/int/2009/10/05.pdf>. ISSN 1803-5256.
Použitá literatura[upravit | editovat zdroj]
- NOVOTNÁ, Božena, RNDr., CSc. a Jaroslav, doc. RNDr., CSc. MAREŠ. Vývojová biologie pro mediky. 1. vydání. Praha : Karolinum, 2005. 99 s. ISBN 80-246-1023-X.
- MASOPUST, Jaroslav, et al. Patobiochemie buňky. 1. vydání. Praha : Univerzita Karlova, 2. lékařská fakulta, 2003. 344 s. s. 79. ISBN 80-239-1011-6.