Antibiotika
Antibiotika jsou látky, které inhibují růst (množení) mikroorganismů (bakteriostatické), nebo je usmrcují (baktericidní). Jsou produkovány bakteriemi nebo houbami. Účinné jsou i jejich (semi)syntetické deriváty. Ze širšího hlediska se k nim řadí i jiné antimikrobiální látky, tj. chemoterapeutika (syntetické substance) – sulfonamidy a chinolony.
Rozdělení na bakteriostatické a baktericidní není zcela přesné, protože mnoho bakteriostatických antibiotik působí ve vyšších koncentracích rovněž baktericidně (chloramfenikol![]() u meningokokové infekce). Naopak některá baktericidní antibiotika neusmrcují určité bakterie ani ve vysokých koncentracích (penicilin G enterokoky). Jiným hlediskem je zařazení antibiotik do skupin podle farmakoterapeutického účinku: protistafylokoková, protipseudomonádová, antianaerobní, protituberkulozní aj.
u meningokokové infekce). Naopak některá baktericidní antibiotika neusmrcují určité bakterie ani ve vysokých koncentracích (penicilin G enterokoky). Jiným hlediskem je zařazení antibiotik do skupin podle farmakoterapeutického účinku: protistafylokoková, protipseudomonádová, antianaerobní, protituberkulozní aj.
| Bakteriostatická | Baktericidní |
|---|---|
Mechanismy účinku
Základním požadavkem na antibiotickou terapii je optimální antimikrobiální účinek za minimální toxicity na hostitele, tj. vysoká selektivita účinku. Toho lze dosáhnout několika způsoby:
- ovlivněním struktur nebo enzymatických procesů specifických jen pro mikroorganizmy (syntéza buněčné stěny),
- kumulací látky v mikroorganizmu s využitím specifických transportních mechanizmů (možné u tetracyklinů).
| Inhibice syntézy buněčné stěny | Peniciliny, cefalosporiny, monobaktamy, karbapenemy, vankomycin, bacitracin |
| Porucha funkce cytoplazmatické membrány | Amfotericin B, azoly, polyeny, polymyxiny |
| Inhibice syntézy bílkovin | Aminoglykozidy, chloramfenikol, makrolidy, tetracykliny, linkomycin |
| Inhibice syntézy nukleových kyselin | Sulfonamidy, trimetoprim, chinolony, rifampicin, pyrimetamin |
Inhibice syntézy buněčné stěny
Bakterie, na rozdíl od živočišných buněk, mají cytoplazmatickou membránu krytou buněčnou stěnou, která se u jednotlivých kmenů liší svou stavbou, tloušťkou i kvalitou. Stavba buněčné stěny rozhoduje o způsobu barvení podle Grama a rozlišuje pak mikroorganizmy grampozitivní a gramnegativní.
Buněčná stěna je nezbytně nutná pro přežití mikroba. Udržuje jeho tvar a zabezpečuje optimální nitrobuněčné prostředí (vysoký intracelulární tlak). Její poškození (např. lysolem, detergenty) nebo inhibice tvorby některé z komponent vede k poruše její funkce, až k lýze buňky. To je možné zejména u grampozitivů.
Grampozitivní mikroby mají buněčnou stěnu tvořenou silnou vrstvou navzájem spojených řetězců peptidoglykanu. Základem peptidoglykanu je polysacharidový řetězec tvořený N-acetylglukosaminem a N-acetylmuramovou kyselinou, ke které je připojen polypeptidový řetězec, zakončený 2 aminokyselinami D-alanyl-D-alaninem (D-Ala-D-Ala). Kompaktní bariéra vzniká odštěpením terminálního D-alaninu a napojením zbytku polypeptidového řetězce na řetězec sousedního peptidoglykanu – transpeptidace. Tuto reakci katalyzuje integrální protein vážící penicilin – PBP (penicilin binding protein). Syntéza volného peptidoglykanu probíhá na vnitřní straně cytoplazmatické membrány, transpeptidace na straně zevní.
Buněčná stěna gramnegativních mikroorganizmů je odlišná. Skládá se z vrstvy peptidoglykanů (slabší než u grampozitivů) doplněné o zevní fosfolipidovou membránu, která může bránit průniku hydrofilních antibiotik (penicilinu G) k vazebnému proteinu. Hydrofilní antibiotika ovlivňují gramnegativní bakterie pouze v případě, že jsou schopny pronikat transmembránovými póry (poriny) zevní membrány (např. ampicilin, amoxycilin).
Porucha funkce cytoplazmatické membrány
Schopnost porušit integritu cytoplazmatické membrány bakterií (gramnegativů vlivem polymyxinů) nebo hub (vlivem polyenů, azolů, amfotericinu B) vede k úniku endogenních látek extracelulárně a k následnému zániku mikroorganizmu.
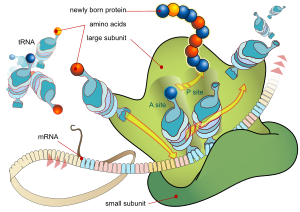
Inhibice syntézy bílkovin
Selektivita účinku je dána inhibicí syntézy bílkovin bakteriálními 70S ribozómy.
Normální syntéza bílkovin na ribozomech (translace) se odehrává v několika krocích. Stimulem pro zahájení je vazba iniciačního kodónu mRNA na menší podjednotku ribozomu (30S). Z volně přítomných aktivovaných aminokyselin (vázaných na tRNA) se vyčlení tRNA s komplementárním tripletem bazí (antikodónem) a naváže se na iniciační kodón mRNA – vytvoří se tzv. iniciační komplex. V dalším kroku se uvolní akceptorové místo A (aminoacylové) na větší podjednotce ribozomu (50S). Na něj se naváže tRNA, která nese antikodón komplementárně odpovídající dalšímu tripletu na mRNA. Součástí větší podjednotky je enzym peptidyltransferáza. Katalyzuje odštěpení úvodní (N-koncové) aminokyseliny od její tRNA a přenesení na další aktivovanou aminokyselinu vázanou na A místě za vzniku peptidové vazby. Úvodní tRNA se z ribozómu uvolní do cytozolu. Popsaným pochodem vznikl dipeptid vázaný na tRNA. Nyní zasáhne elongační faktor zvaný translokáza, který posune dipeptid vázaný na tRNA na tzv. donorové (peptidylové) místo P spolu s celým řetězcem mRNA, provede translokaci. Proces se opakuje až do doby, kdy se na malou podjednotku dostane stop-kodón. Informace přenášená mRNA je čtena současně několika ribozomy, seskupenými podél vláken mRNA tzv. polyzomy.
Antibiotika inhibující syntézu bílkovin ovlivňují proces elongace peptidového řetězce různými mechanizmy (viz níže).
Inhibice syntézy nukleových kyselin
Touto cestou působí chinolony, aktinomycin, mitomycin (DNA), rifampicin (mRNA), trimetoprim, sulfonamidy (k. listová).
Hodnocení antimikrobiálního účinku
Hodnocení se provádí in vitro stanovením minimální inhibiční koncentrace (MIC) a minimální baktericidní koncentrace (MBC).
MIC je nejmenší naměřené množství (koncentrace) antibiotika, které inhibuje růst a množení bakterií v testovacím mediu. MBC odpovídá nejnižší naměřené koncentraci antibiotika in vitro, která usmrtí exponovanou bakteriální kulturu v průběhu 24 hod. Obě koncentrace se stanovují pro látky baktericidní i bakteriostatické. U silně působících baktericidních antibiotik jsou rozdíly mezi MIC a MBC malé. Průkaz spolehlivosti baktericidního účinku podává následný kultivační test na agarových půdách, kde nemají vyrůst žádné kolonie bakterií.
Aby účinek antibiotika in vivo byl dostatečný, je třeba, aby minimální koncentrace antibiotika v cílových tkáních odpovídaly hodnotám MIC a MBC. V některých případech (aminoglykozidy, chinolony) je intenzita antibakteriálního účinku přímo úměrná koncentraci v plazmě a cílové tkáni. Vysoké koncentrace nebývají pro terapeutický efekt přínosné, naopak zatěžují nemocného riziky nežádoucích a toxických reakcí. U většiny antibiotik je pro terapeutický efekt důležitá doba expozice.
Významnou vlastností některých antibiotik (aminoglykosidů a β-laktamů) je postantibiotický efekt (PAE). Tím se rozumí doba, po kterou přetrvává zástava množení bakterií za podmínek, kdy bakterie už nejsou vystaveny účinkům antibiotika (není měřitelná koncentrace antibiotika v tělesných tekutinách či tkáních). Podstata tohoto jevu není dosud spolehlivě vysvětlena.
Rizika antibiotické terapie
jsou dána rezistencí mikroorganizmů, nežádoucími a toxickými účinky antibiotik.
Rezistence
znamená odolnost mikroorganizmů vůči působení antibiotika.
Rezistence primární odpovídá geneticky podmíněné necitlivosti bakterií na dané antibiotikum bez ohledu na event. předchozí kontakt s antibiotikem (aminoglykosidy v monoterapii nepůsobí na anaerobní infekce). Rezistence sekundární vzniká až v průběhu antibiotické terapie nebo následkem předchozího podávání antibiotika. V přítomnosti antibiotika se selektují rezistentní kmeny, které se nacházejí v každé velké bakteriální populaci. Rychlost rozvoje sekundární rezistence závisí na frekvenci mutací a na množství bakterií s určitým stupněm rezistence. Sekundární rezistence má dva typy:
- penicilinový typ (multiple step mutation) vzniká po dlouhodobém podávání některých antibiotik – např. penicilinu, chloramfenikolu, bacitracinu.
- streptomycinový typ (one step mutation), s rychlým vznikem vysoce rezistentních kmenů je znám u streptomycinu, erytromycinu, linkomycinu, rifampicinu.
Rezistence může být přenosná. Nejčastěji je zprostředkovaná plazmidy, má charakter sekundárního typu a je častější u gramnegativů. Genetický materiál může být předáván z jednoho mikroorganizmu na druhý konjugací (spojením bakterií a translokací DNA) nebo transdukcí (DNA plazmidu je převzata do bakteriálního viru a je jím přenesena do další bakterie).
Obecné mechanizmy rezistence:
- omezená penetrace antibiotika do bakteriální buňky,
- změna cílové struktury (receptoru),
- metabolické změny v bakteriální buňce, které zabrání účinku antibiotika na cílových strukturách,
- enzymatická inhibice/inaktivace antibiotika.
| Antibiotikum | Mechanizmy rezistence |
|---|---|
| Beta-laktamová |
produkce beta-laktamáz snížení permeability buněčné stěny změna penicilin-vazebných proteinů |
| Aminoglykosidy a makrolidy |
snížená vazebnost na ribozómy snížení permeability buněčné stěny produkce inaktivujících enzymů |
| Chloramfenikol |
snížení vazebnosti na cílové ribozómy snížení permeability buněčné stěny zvýšení aktivity chloramfenikol-acetyltransferázy |
| Tetracykliny |
snížený transport k ribozómům aktivní buněčný eflux (vylučování antibiotika z buňky) |
| Chinolony |
rezistence DNA-gyrázy snížení permeability buněčné stěny aktivní buněčný eflux |
| Sulfonamidy, Trimetoprim |
rezistence syntetázy kyseliny listové rezistence reduktázy kyseliny dihydrolistové snížení permeability buněčné stěny |
Zkřížená rezistence znamená současnou necitlivost mikroorganizmů na antibiotika, která mají podobnou chemickou strukturu a stejný mechanizmus účinku. Při oboustranně zkříženém typu rezistence na jedno antibiotikum znamená rezistenci i na antibiotikum druhé (penicilin G a V nebo tetracykliny navzájem). Při jednostranně zkříženém typu rezistence může být citlivost baktérií vůči jednomu z antibiotik zachována (meticilin a penicilin G – stafylokoky rezistentní na penicilin G nemusí být rezistentní na meticilin; meticilin-rezistentní stafylokoky jsou zcela určitě rezistentní na penicilin G).
Nežádoucí a toxické účinky
Nežádoucí účinky se objevují při obvyklých dávkách a doporučovaných farmakoterapeutických koncentracích v plazmě.
- Toxické účinky – vznikají po vysokých dávkách, vlivem vysokých plazmatických koncentrací, eventuelně při vyšší citlivosti hostitele. Toxické účinky bývají klinicky charakteristické, závislé na dávce, s dočasnými nebo trvalými následky. Většinou se jim dá předejít nebo jejich klinické projevy zmírnit. Riziko je přijatelné u život ohrožujících onemocnění, není-li dostupné antibiotikum, které by poskytlo při srovnatelném účinku záruku vyšší bezpečnosti v léčbě.
- Alergie – jsou vyvolány po předchozí senzibilizaci i malou dávkou antibiotika. Bývají časté u penicilinů. Proto je potřeba po nich pátrat v anamnéze. Klinické projevy jsou pestré, například polymorfní exantémy, kopřivka, eozinofilie, edémy, horečka, konjunktivitida, fotodermatózy, záchvat bronchiálního astmatu až anafylaktický šok. Nebezpečné formy jsou spojeny zejména s parenterálním podáním antibiotika. Mohou se projevit jako časné i pozdní reakce v průběhu léčby nebo i po jejím skončení (po 9–11 dnech). V důsledku lokálního podání se lze setkat také s kontaktní alergií (neomycin). Vzácné nejsou ani toxické reakce, na kterých se podílí pomocné látky přítomné v lékových formách (paraben jako konzervační přísada v orálních suspenzích nebo lécích pro místní podání).
- Biologické účinky – antibiotik jsou způsobeny změnou přirozené bakteriální mikroflóry kůže nebo sliznic. Jsou zvláště časté při používání širokospektrých antibiotik (ampicilinu, tetracyklinů). Příkladem jsou dyspeptické potíže, průjmy, hypovitaminóza K s následnými poruchami hemostázy. V některých případech mohou být tyto komplikace vyvolány přerůstáním kvasinek (Candida albicans) nebo rezistentních bakterií (Staphylococcus epidermidis, S. aureus, Pseudomonas aeruginosa, Klebsiella pneumoniae, Clostridium difficile) a bývají pak těžko léčitelné.
- Hoigne syndrom – při aplikaci suspenze do žíly vzniká pocit strachu, toxické účinky
- Nikolau syndrom – suspenze v artérii způsobí spazmus
Zásady používání antimikrobiálních látek
Zásady používání antimikrobiálních látek se týkají
- správné volby antimikrobiální látky,
- optimální a dostatečně dlouhé doby léčby,
- adekvátního dávkování,
- vhodné kombinace léčiv,
- žádoucího monitorování antimikrobiální terapie.
Správná volba antimikrobiální látky
Léčba chronických infekcí se provádí na základě správné diagnózy a identifikace původce infektu. Tento postup umožňuje tzv. cílenou antibiotickou terapii. Nejprve je izolován původce a následně je určena jeho citlivost na antibiotika. Z možných účinných látek je vybrána ta, která má nejužší spektrum účinku a zároveň nejnižší možnou toxicitu (penicilin G v případě pneumokokové infekce). Chronické infekce bývají vyvolány vysoce rezistentními původci (pseudomonádami nebo stafylokoky).
U akutních infekcí je cílená antibiotická terapie spíše výjimkou. V těchto případech volíme většinou léčbu empirickou (bez bakteriologického průkazu původce). Empirická léčba spočívá ve volbě antibiotika, které nejvíce odpovídá očekávanému spektru patogenních mikrooorganizmů a má potřebné farmakokinetické vlastnosti. Například k léčbě ranných infekcí, způsobených obvykle stafylokoky nebo streptokoky, volíme jiná antibiotika nežli k léčbě infekce močových cest vyvolaných nejčastěji enterobakteriemi, kde je navíc třeba, aby se antibiotikum vylučovalo ledvinami a dosahovalo v cílové tkáni vysokých koncentrací.
U život ohrožujících infekcí, kde je nutno navodit dostatečný účinek co nejrychleji, aniž bychom znali původce, jsou indikována širokospektrá antibiotika (imipenem, ciprofloxacin) nebo kombinace antibiotik, které společně široké spektrum obsáhnou (cefotaxim + piperacilin). Tento postup je používán u sepse, peritonitidy, infikované gangrény, u rozsáhlých infikovaných popálenin, nebezpečných pooperačních infekcí, endometritidy, u adnexitidy a febrilního abortu. Pro správnou volbu antimikrobiální látky je neméně důležitá znalost základního onemocnění event. onemocnění interkurentních. Je třeba pátrat po rizikových faktorech, zejména alergických reakcích v anamnéze. Důležité jsou změny funkce eliminujících orgánů patologickým stavem, nebo vlivem abnormálních podmínek např. nízkým nebo naopak vysokým věkem, stavem imunity apod. Tyto informace dáváme do souvislostí s farmakologickými vlastnostmi antimikrobiální látky, tj. s její farmakokinetikou a farmakodynamikou (zejména s potenciálními nežádoucími a toxickými účinky).
Neustále se rozšiřující paleta antibiotik a nedostatečný přehled o jejich přínosu pro terapii svádí lékaře k předepisování léků se zbytečně širokým spektrem a silným účinkem. Tento trend přináší kromě rozvoje mnohočetné rezistence i podstatné zvýšení finančních nákladů. Zásadnější změnu by mělo přinést zavedení kategorizace antibiotik do skupin: a – základní = nezbytná b – alternativní c – rezervní a vypracování závazných léčebných postupů pro konkrétní onemocnění.
Doba léčby
Vychází ze znalosti původce, lokalizace infekce a stavu nemocného. Obvykle postačuje nepřetržitá 7–10 denní léčba. Terapeutický úspěch se projeví ústupem klinických a laboratorních známek infekce (hlavně teploty). U některých chronických procesů (osteomyelitida, tuberkulóza atd.) však může antibiotická terapie trvat měsíce. Ve snaze snížit riziko nežádoucích účinků, zlepšit spolupráci nemocného (compliance) a redukovat náklady na terapii, byla vypracována schémata pro jednorázovou léčbu lehčích, nekomplikovaných infekcí (např. kapavky, lues). K tomu účelu jsou vhodná baktericidní antibiotika s delším t1/2 (např. ceftriaxon, ciprofloxacin) nebo antibiotika s dostatečně dlouhým postantibiotickým efektem (spektinomycin u kapavky). Podmínkou je dokonalý doklad o efektivitě a bezpečnosti tohoto postupu. Předčasně ukončená antimikrobiální terapie je jedním z hlavních faktorů, který se podílí na vzniku rezistence bakteriálních kmenů.
Velikost dávky
Rozeznáváme dávku jednotlivou (dosis singula, pro dosi), denní dávku (dosis pro die) a celkovou léčebnou dávku (dosis curativa). Velikost dávky je dána charakterem infekce a vlastnostmi antibiotika (jeho farmakokinetikou i farmakodynamikou), aktuálním stavem nemocného (daným zejména funkcí eliminujících orgánů), věkem nemocného a cestou podání. V klinické praxi se obvykle vychází z dávkování doporučeného výrobcem, které však může být ovlivněno komerčními zájmy firmy. Z tohoto důvodu jsou za nejvíce relevantní považována doporučení vyplývající z nezávislých klinických studií.
Úprava dávkování může být realizována podle dvou princpů:
- farmakodynamický princip – u antibiotik se širokou terapeutickou šíří (interval mezi minimální toxickou a minimální terapeutickou dávkou) je možno modifikovat velikost dávky podle závažnosti onemocnění.
- farmakokinetický princip – u antibiotik s úzkou terapeutickou šíří (u aminoglykosidů) je naproti tomu zvyšování dávky riskantní. Velikost dávky je vhodné upravovat podle plazmatických koncentrací.
Cesta podání
Cesta podání závisí na farmakokinetických vlastnostech antibiotika tj. na jeho absorpci, distribuci a eliminaci, dále záleží na stavu nemocného a charakteru infekce.
- Parenterálně – aplikace u těžkých systémových infekcí (sepse, meningitidy) a tam, kde perorálně nelze dosáhnout dostatečné koncentrace v místě infekce nebo stav nemocného neumožňuje jinou než parenterální aplikaci (bezvědomí, onemocnění GIT).
- Perorálně – tato léčba antibiotiky může být místní i celková. Celková terapie slouží pro účinky systémové a je určena pro léčbu lehkých a středně těžkých infekcí. Základním předpokladem pro její volbu je dostatečná biologická dostupnost. Při sekvenční terapii je nemocný je po 2–3 dnech injekční léčby převeden na perorální terapii (injekční cefuroxim na esterifikovanou perorální lékovou formu cefuroxim-axetil).
Kombinace léčiv
Kombinace léčiv předpokládá použití dvou nebo více antibiotik současně. Je indikována z více důvodů:
- u empirické terapie závažných infekcí (sepse) s cílem pokrýt celé spektrum možných původců. V těchto případech se volí specifický druh empirické terapie, a to léčba postupná – intervenční – podle určitého schématu. Schéma stanoví, jakými dalšími antibiotiky má být v léčbě pokračováno v případě neúčinné terapie iniciální. Tento postup se obvykle používá při terapii infekčních onemocnění spojených s poruchou funkce imunitního systému, např. u febrilní neutropenie, u sekundární infekce nemocných s AIDS atd.
- kombinací antibiotik se může dosáhnout výrazného posílení účinku (synergismu) obou látek. Podstatou synergismu je:
- sekvenční blokáda – současnou inhibicí po sobě jdoucích metabolických pochodů nezbytných pro život bakterie (trimetoprim + sulfonamid),
- inhibice enzymatické inaktivace (amoxicilin s kyselinou klavulanovou),
- zvýšení průniku antibiotika do bakterie (kombinace β-laktamového antibiotika s aminoglykosidem).
- kombinací antibiotik je možno bránit rychlému rozvoji rezistence tam, kde podání jednoho antibiotika by k vývoji rezistence nejpíše směřovalo (u tuberkulózy).
- konečně kombinace může dovolit snížit dávky toxických antibiotik při zachování účinku.
V některých případech však kombinace antibiotik vedou naopak ke snížení výsledného účinku. K tomu dochází při současném podávání:
- bakteriostatických a baktericidních antibiotik, protože účinek baktericidních antibiotik je závislý na aktivním množení mikroorganizmů (např. kontinuální syntéza buněčné stěny). Bakteriostáza vlivem bakteriostatického antibiotika vede k podstatné redukci účinku antibiotika baktericidního.
- antibiotik, které silně indukují β-laktamázy (imipenem, cefoxitin, ampicilin).
Monitorování antimikrobiální terapie
Základním principem monitorování antimikrobiální terapie je sledování klinického stavu nemocného. Především je nutno pátrat po známkách selhávání terapie, po vzniku nežádoucích až toxických účinků, které mohou být v první fázi reverzibilní. Monitorování plazmatických koncentrací je doporučeno:
- u antibiotik, kde existuje výrazná závislost mezi plazmatickými koncentracemi a terapeutickými nebo toxickými účinky,
- u antibiotik s úzkým terapeutickým oknem, tj. s malým rozsahem mezi účinnou a toxickou koncentrací (aminoglykosidy),
- u rizikových skupin nemocných (chloramfenikol u novorozenců).
Pro zabezpečení racionální farmakoterapie antibiotiky je nutné znát výsledky kultivace a stanovení rezistence.
Selhání a komplikace antimikrobiální terapie
Projeví se klinicky přetrváváním teplot, bolestí, zánětlivými projevy nebo zcela novou symptomatologií. Nejčastější příčiny selhání jsou:
- původce infekce není na antibiotikum dostatečně citlivý, tj. lék nebyl správně vybrán, výsledky kultivace in vitro byly falešně pozitivní nebo existují rozdíly mezi in vitro a in vivo účinkem antibiotika,
- nedostatečné hladiny v místě infekce při nevhodně zvolené lékové formě (p.o./i.v.), neadekvátním dávkování nebo nevyhovující farmakokinetické vlastnosti léčiva (látka nepenetruje přes bariéry),
- lékové interakce mohou podmiňovat snížení účinku (snížení absorpce tetracyklinů po podání antacid, urychlení metabolizmu po rifampicinu), nebo naopak vyvolat toxické projevy (furosemid zvyšuje nefrotoxicitu gentamicinu),
- toxické projevy vlivem změn funkce eliminačních orgánů, např. renální insuficience, „gray syndrom“ u novorozenců atd.
- alergické reakce
Odkazy
Související články
- Rezistence klinicky významných bakterií k ATB volby
- Antibiotika v neonatologii
- Rezistence bakterií způsobená produkcí inaktivujících enzymů: beta laktamová antibiotika, hyperprodukce beta laktamáz, chromozomální, plazmidové beta laktamázy
- Rezistence k makrolidům a k linkosamidům (hlavní příčiny rezistence, eflux)
Externí odkazy
 Racionální antibiotická terapie — interaktivní algoritmus + test
Racionální antibiotická terapie — interaktivní algoritmus + test- Antibiotika (česká wikipedie)
- Antibiotická léčba dle diagnóz
Zdroj
- MARTÍNKOVÁ, J, S MIČUDA a J CERMANOVÁ. Antibiotika [online]. [cit. 2010-02-18]. <https://www.lfhk.cuni.cz/farmakol/predn/bak/kapitoly/atb-bak.doc/>.
Použitá literatura
- VOTAVA, Miroslav, et al. Lékařská mikrobiologie obecná. 2. vydání. Brno : Neptun, 2005. ISBN 80-86850-00-5.
- LINCOVÁ, Dagmar, et al. Základní a aplikovaná farmakologie. 1. vydání. GALÉN, 2002. ISBN 80-7262-168-8.