tRNA
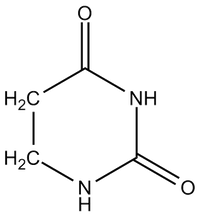
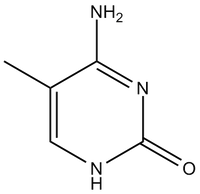
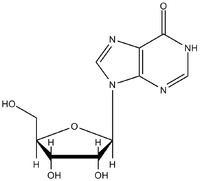
Všechny transferové RNA (tRNA) mají velmi mnoho společných strukturních rysů. Jsou tvořeny jedním nukleotidovým řetězcem o délce kolem 80 nukleotidů. 5’–konec bývá fosforylován, na 3’-konci je posttranskripčně připojena sekvence -CCA. V tRNA bývá několik neobvyklých nukleotidů. Obsahují zřídka se vyskytující (minoritní) bazi, jako je dihydrouracil, metylované baze, hypoxantin (v inosinu) a také nukleotidy s atypickou vazbou (pseudouridin). Vznikají posttranskripčními úpravami tRNA. Jejich význam spočívá v tvorbě poznávacích míst pro proteiny, pomáhají vytvořit správnou konformaci molekuly a zvyšují možnosti interakcí s kodony mRNA.
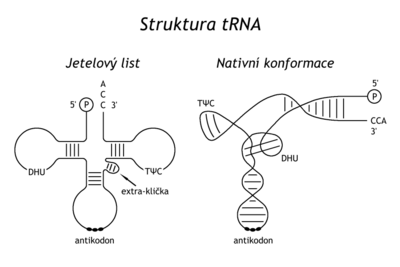
Na základě možných párování bazí lze odvodit konformaci „jetelového lístku“ tRNA se 4–5 rameny, tj. s akceptorovým ramenem se sekvencí -CCA, na jehož 2’ nebo 3’-koncovou -OH se estericky váže aminokyselina, dihydrouracilovým ramenem (DHU klička), pseudouridylovým ramenem (TφC klička) a antikodonovým ramenem s tripletem (antikodonem) párujícím se s příslušným kodonem na mRNA. V tomto úseku bývá obvykle sekvence PyPy-XYZ-modif.Pu (XYZ je antikodon). Některé tRNA mají ještě další, variabilní nebo vedlejší rameno.
Prostorově tRNA zaujímá tvar písmene L; každý ze dvou segmentů této konformace je vlastně jedna otáčka dvojité šroubovice (10 pb), jeden je tvořen antikodonovým a DHU- ramenem, druhý TφC- a akceptorovým ramenem.
Syntéza aminoacyl-tRNA[upravit | editovat zdroj]
Tvorba peptidové vazby je endergonní reakce. Aminokyselina je nejdříve aktivována tím, že se naváže na 3’-konec (na 2’-OH nebo 3’-OH posledního adenosinu) příslušné tRNA. Vzniklý ester, tj. aminoacyl-tRNA (aa-tRNA) pak obsahuje dostatek energie k navázání aminokyseliny na rostoucí peptidový řetězec. Kromě této aktivační funkce má aa–tRNA ještě význam adaptorový. Antikodon specifické tRNA se párováním bazí váže na odpovídající kodon mRNA, takže určuje správné zařazení přenášené aminokyseliny do sledu aminokyselin peptidového řetězce. Z toho vyplývá, že enzym, který katalyzuje syntézu aa-tRNA, zvaný aminoacyl-tRNA-syntetáza, musí být přísně substrátově specifický, neboť při chybné kombinaci aminokyseliny a tRNA se do peptidu zařadí chybná aminokyselina. Enzym má vazebné místo pro aminokyselinu, pro odpovídající tRNA a pro ATP. Je zajímavé, že s danou aminokyselinou může jedna syntetáza spojit tRNA s různými antikodony, odpovídajícími antikodonům pro danou aminokyselinu v rámci degenerace genetického kódu (isoakceptorové tRNA). Je to umožněno tím, že enzym rozezná správnou tRNA nikoli podle sekvence nukleotidů, nýbrž podle konformace těch částí tRNA, na které se váže, tj. povrch antikodonového, DHU a akceptorového ramena.
Reakce aa-tRNA-syntetázy probíhá ve dvou krocích. Nejdříve vznikne smíšený anhydrid aminokyseliny a AMP (aminoacyladenylát). Ve druhé fázi reakce je takto aktivovaná aminokyselina přenesena z AMP na 3’-OH nebo u některých na 2’-OH koncového adenosinu tRNA. Obě tyto reakce jsou vratné. Směr k syntéze termodynamicky zajistí hydrolýza pyrofosfátu enzymem pyrosfosfatázou.
1) Adenylace aminokyseliny na aminoacyl-AMP:
AK + ATP → Aminoacyl-AMP + PPi
2) Zbytek AK je převeden na tRNA:
Aminoacyl-AMP + tRNA → Aminoacyl-tRNA + AMP
Dohromady tedy:
AK + ATP + tRNA → Aminoacyl-tRNA + AMP + PPi
Pokud aa-tRNA-syntetáza naváže na AMP nesprávnou aminokyselinu, je schopna svou chybu opravit. Kromě syntetázové aktivity má totiž ještě aktivitu hydrolázovou, kterou aa-adenylát štěpí a aminokyselinu uvolní, místo aby ji přenesla na neodpovídající tRNA.
Odkazy[upravit | editovat zdroj]
Související články[upravit | editovat zdroj]
Zdroje[upravit | editovat zdroj]
- ŠTÍPEK, Stanislav. Stručná biochemie : Uchování a exprese genetické informace. 1. vydání. Medprint, 1998. 92 s. s. 43–45. ISBN 80-902036-2-0.