Dědičné metabolické poruchy
(přesměrováno z Dědičné poruchy metabolizmu)
Dědičné metabolické poruchy (DMP)[1]
[2]
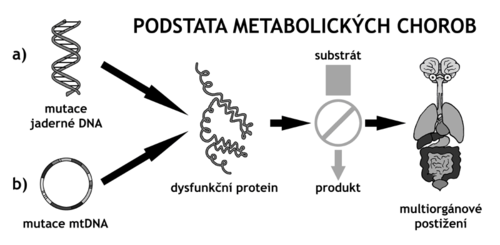
tvoří různorodou skupinu 700–800 onemocnění, která jsou způsobena enzymovým deficitem, dysfunkcí transportního proteinu či poruchou jiného proteinu souvisejícího s některou metabolickou dráhou. Typická je pro ně autozomálně recesivní, gonozomálně recesivní i dominantní, ale také mitochondriální dědičnost[1]. K nedostatečné tvorbě enzymu či potřebného proteinu dochází následkem mutací jaderné či mitochondriální DNA. Konzervativní odhady kumulativní incidence všech dědičných metabolických poruch jsou uváděny kolem 1:500[1][† 1] (frekvence heterozygotů 1:15[3]); je velmi pravděpodobné, že DMP jsou v současné době poddiagnostikovány[3]. Ilustraci jejich skutečné incidence mohou poskytnout data z novorozeneckých screeningových programů, např. v USA kumulativní incidence pro 50 screenovaných DMP se pohybuje mezi 1:1000 až 1:2000[† 2].
Ačkoliv je skupina dědičných metabolických poruch značně heterogenní, je možné najít některé společné rysy. Již z jejich podstaty vyplývá, že u pacientů budou detekovatelné biochemické a enzymatické odchylky[2]. Dále vzhledem k tomu, že většina metabolických drah je společná pro řadu buněk v organizmu, bývá časté multiorgánové postižení (např. postižení CNS, svalů, ledvin a jater u mitochondriálních onemocnění[1]). Klinické projevy DMP bývají velmi často nespecifické (neprospívání, nechutenství, porucha růstu, porucha psychomotorického vývoje, poruchy vědomí), jen poměrně vzácně se vyskytují specifické známky svědčící s vysokou pravděpodobností pro některé DMP (např. zápach zpocených nohou u pacientů s izovalerovou acidurií nebo typická faciální dysmorfie u pacientů s mukopolysacharidózami či generalizovanými peroxizomálními onemocněními). Postihují pacienty jakéhokoliv věku od prenatálního období až do stáří.
Příčiny
Nejčastější příčinou dědičných metabolických poruch jsou mutace nukleární DNA v zárodečných buňkách (a tím i následně v somatických buňkách) s typickou monogenní mendelovskou dědičností — běžně autozomálně recesivní, gonozomálně recesivní i dominantní. Méně častou příčinou DMP jsou mutace mitochondriální DNA, které se přenášejí maternálním typem dědičnosti. Fenotypové projevy u dvou jedinců se stejným genotypem se mohou lišit v důsledku dalších faktorů jako je vliv prostředí (dieta, životní styl u nemocí malých molekul) či jako jsou např. epigenetické změny, epistáze (interakce s alelickými variantami v jiných genech), inaktivace X-chromozomu (lyonizace). Mutace mohou být typu bodových mutací (missense, nonsense, synonymní mutace), delecí a inzercí (s nebo bez posunu čtecího rámce), přičemž z typu mutace a její lokalizace nelze často přímo určit stupeň postižení funkce příslušného proteinu.
Důsledkem mutace může být změněné množství translatovaného proteinu (obvykle snížené či vzácně zvýšené) nebo jeho vlastnosti (změnou izolované funkce jedné domény, nebo globální změnou všech funkcí např. při misfoldingu). Mutace mohou vést i ke změnám funkce neproteinových genových produktů jako jsou například miRNA či siRNA, které regulují expresi řady cílových genů.
Postiženým proteinem je většinou enzym některé metabolické dráhy, jež potom vázne a nevzniká její produkt, který může chybět, neodčerpává se substrát, který se může hromadit, případně metabolizovat na vedlejší produkt. Od toho se pak odvíjí postižení různých orgánů do různé míry.
Postižené metabolické dráhy
Dědičné metabolické poruchy typicky zahrnují poruchy metabolizmu:
- poruchy metabolizmu organel
- mitochondriální onemocnění
- peroxizomální onemocnění
- lysozomální onemocnění
- poruchy glykosylace (vázané na endoplazmatické retikulum)
- poruchy metabolizmu primárně nevázané na organely
- jiné DMP
Projevy
Zásadní rozdíl v povaze metabolitů, které způsobují klinické projevy onemocnění, umožňuje dědičné metabolické poruchy rozdělit do dvou skupin:
- Nemoci malých molekul
- Nemoci komplexních molekul
Nemoci malých molekul
Nemoci malých molekul jsou způsobeny hromaděním malých toxických molekul (amoniak, organické kyseliny) či nedostatkem žádoucích metabolitů (ketolátky, glukóza), které vznikají katabolismem látek přijímaných potravou (aminokyseliny bílkovin, sacharidy, mastné kyseliny). Typicky se onemocnění manifestuje v novorozeneckém věku v průběhu několika hodin či dnů, k nevyvážené koncentraci toxických molekul dojde po zvýšeném přísunu zdroje v potravě či při horečnatých infektech, a to atakovitě, jako akutní stav se změnou chování až přechodem do kómatu (např. hypoketotické kóma u deficitu MCAD). Ataky se mohou dostavit opakovaně, ve spojení se specifickou situací, se kterou si ji pacient spojuje (dlouhé hladovění nebo naopak náhlé přejídání).
Některá onemocnění se ovšem mohou od tohoto schématu lišit a mívají i subakutní či chronickou formu a postihují i jiné orgány než jen CNS.
Nemoci komplexních molekul
Nemoci velkých molekul vznikají defektem v metabolizmu (porucha tvorby, transportu látek, ale také v jejich odbourávání) endogenně tvořených makromolekul (glykosaminoglykany, glykolipidy, glykoproteiny a jiné). Některé tyto látky tvoří stavební části buněčných membrán, což se pak projeví defektem tohoto typu, jiné jsou odbourávány v peroxisomech a lysozomech, v nichž se pak mohou hromadit. To trvá řádově měsíce až roky, nemoc probíhá bez atak a zřejmých krátkodobých nutričních či infekčních souvislostí, má chronický charakter, který se manifestuje až po uběhnutí latentní fáze, během níž se nahromadilo dostatek makromolekul, aby se defekt projevil na úrovni funkce.
Nemoci, při nichž se hromadí makromolekuly v peroxisomech či lysosomech, mohou imitovat neurodegenerativní či nádorová onemocnění. Nemoci, při nichž dochází k membránovým defektům, zase chromozomové aberace, a to příznaky jako organomegalie, dysmorfie hlavy a obličeje, postižení CNS a jiných orgánů.
Léčba
Snížení příjmu substrátu potravou při hromadění substrátu (dieta), doplnění produktu potravou či parenterálně při chybění produktu (dieta), enzymatická léčba peroxisomálních onemocnění, ovlivnění metabolické dráhy (inhibice, vznik vedlejších produktů — např. podávání cysteaminu u cystinózy), transplantace orgánů a teoreticky genová terapie.
Odkazy
Související články
Zdroj
S laskavým svolením použity materiály doc. MUDr. Viktora Kožicha, CSc.
Poznámky
- ↑ Prevalence chorob, pro něž je v USA prováděn novorozenecký screening, se uvádí přibližně mezi 1:900–1:2000 [zdroj?]
- ↑ Předběžná data z projektu Region 4 Genetics, [1]
Reference
- ↑ a b c d KOŽICH, Viktor a Jiří ZEMAN. Dědičné metabolické poruchy v pediatrii. Postgraduální medicína [online]. 2010, roč. 12, vol. 7, s. 793–799, dostupné také z <https://zdravi.euro.cz/>. ISSN 1214-7664.
- ↑ a b FERNANDES, John, Jean-Marie SAUDUBRAY a Georges van den BERGHE, et al. Diagnostika a léčba dědičných metabolických poruch. 4. vydání. Praha : Triton, 2008. 607 s. ISBN 978-80-7387-096-6.
- ↑ a b KOŽICH, Viktor: Úvod do biochemické genetiky dědičných metabolických poruch. [přednáška z patobiochemie], 5. 10. 2010
Použitá literatura
- KOŽICH, Viktor: Úvod do biochemické genetiky dědičných metabolických poruch. [přednáška z patobiochemie], 5. 10. 2010
- KOŽICH, Viktor a Jiří ZEMAN. Dědičné metabolické poruchy v pediatrii. Postgraduální medicína [online]. 2010, roč. 12, vol. 7, s. 793–799, dostupné také z <https://zdravi.euro.cz/>. ISSN 1214-7664.
- FERNANDES, John, Jean-Marie SAUDUBRAY a Georges van den BERGHE, et al. Diagnostika a léčba dědičných metabolických poruch. 4. vydání. Praha : Triton, 2008. 607 s. ISBN 978-80-7387-096-6.