Chemická rovnováha
Chemická rovnováha je stav, kdy se koncentrace reaktantů ani produktů chemické reakce nemění v čase.
Představme si, že smísíme dva reaktanty a a začne probíhat chemická reakce
- .
Jak přibývá produktů této reakce, látek a , postupně se rozbíhá i zpětná reakce
- .
Zatímco rychlost dopředné reakce se postupně snižuje s tím, jak se spotřebovávají reaktanty a , rychlost vratné reakce se zvyšuje, neboť přibývá látek a . V určitém okamžiku se rychlost dopředné i vratné reakce vyrovnají. Tomuto okamžiku říkáme, že bylo dosaženo chemické rovnováhy. Látky a se nyní spotřebovávají stejně rychle dopřednou reakcí, jako vznikají vratnou reakcí, takže jejich koncentrace se již nemění v čase. Obdobně látky a vznikají dopřednou reakcí stejně rychle, jako se spotřebovávají vratnou reakcí, takže ani jejich koncentrace se již v čase nemění.
Chemickou rovnováhu můžeme také popsat jako situaci, kdy je rychlost dopředných reakcí stejná jako rychlost vratných reakcí. Soustava se navenek nemění. Nejen že jsou v čase konstantní koncentrace všech látek v soustavě, ale soustava také nepředává žádnou energii (teplo, světlo apod.) do svého okolí a naopak energii od okolí nepřijímá. To však neznamená, že by v soustavě neprobíhaly žádné děje. Chemické reakce stále běží, ale z vnějšího pohledu se jejich důsledky vzájemně ruší, neboť probíhají stejnou rychlostí v obou směrech.
Odvození rovnovážné konstanty[upravit | editovat zdroj]
Vyjádření chemické rovnováhy lze docílit pomocí tzv. rovnovážné konstanty (viz dále), přičemž vztah pro rovnovážnou konstantu je nezávislý na reakčním mechanismu.
Uvažme chemickou reakci ve tvaru:
Kde písmeny () označujeme stechiometrické koeficienty reaktantů (produktů). Zárověn však probíhá i zpětná reakce:
Podle Guldbergova–Waagova zákona je rychlost chemické reakce přímo úměrná součinu koncentrací (přesněji aktivit) reagujících látek. Konstantami úměrnosti jsou rychlostní koeficienty a .
Při ustanovení chemické rovnováhy dojde k vyrovnání rychlosti přímé a zpětné reakce, tj.:
Mějme na paměti, že se již jedná o rovnovážné koncentrace. Přesunutím konstant na jednu stranu rovnice dostáváme:
Pomocí tohoto vyjádření jsme definovali rovnovážnou konstantu jako podíl rychlostních koeficientů. V případě, že všechny látky reagují v plynné fázi, dosadíme místo koncentrací parciální tlaky (přesněji fugacity). Rovnovážnou konstantu pak označíme .
Z číselné hodnoty a lze odvodit v jakém rozsahu bude reakce probíhat.
- Čím je rovnovážná konstanta vyšší, tím je v rovnovážné směsi víc produktů a míň reaktantů.
- Čím je rovnovážná konstanta nižší, tím je v rovnovážné směsi víc reaktantů a míň produktů.
V extrémních případech, kdy:
- , pak jsou v rovnovážné směsi prakticky jen produkty
- , pak jsou v rovnovážné směsi prakticky jen výchozí látky
Na chemickou rovnováhu a tedy i na a má vliv teplota a tlak (hlavně pro plynné látky). Opět zdůrazňujeme, že hodnota rovnovážné konstanty je nezávislá na reakčním mechanismu. Dokonce ani přítomnost katalyzátoru neovlivňuje rovnovážné složení reakční směsi (mění pouze rychlost ustanovení rovnováhy).
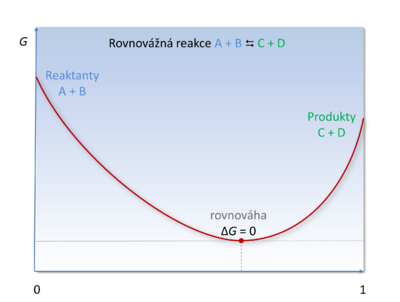
S rovnovážnou konstantou souvisí i Gibbsova energie. Při izotermicko-izobarickém ději se dosahuje chemické rovnováhy právě tehdy, když je změna Gibbsovy energie rovna nule.
Činitelé ovlivňující chemickou rovnováhu[upravit | editovat zdroj]
Změnou reakčních podmínek dojde k porušení původní rovnováhy. Po čase se ustálí nová rovnováha. Ta je charakterizována novými (jinými) hodnotami koncentrace výchozích látek a produktů.
Le Chatelierův princip akce a reakce[upravit | editovat zdroj]
Porušení chemické rovnováhy vnějším zásahem (akcí) vyvolá děj (reakci), který směřuje ke zrušení účinku tohoto vnějšího zásahu.
Změna koncentrace[upravit | editovat zdroj]
Pokud zvýšíme koncentraci výchozích látek, přibude koncentrace produktů. V opačném případě, tedy pokud budeme ze směsi odebírat produkty, získáme více produktů.
Změna tlaku[upravit | editovat zdroj]
Změna tlaku ovlivňuje chemickou rovnováhu pouze u reakcí, ve které jsou veškeré reaktanty v plynné fázi a počty molů výchozích látek a produktů jsou rozdílné − musí tedy dojít ke změně látkového množství v průběhu reakce.
Při splnění této podmínky dochází při zvýšení tlaku k posunu rovnováhy ve směru menšího počtu molů částic. Naopak při snížení tlaku dojde k posunu rovnováhy ve směru většího počtu molů částic
Při zvýšení tlaku se rovnováha posune na stranu produktů.
Při zvýšení tlaku se rovnováha posune na stranu reaktantů.
Změna teploty[upravit | editovat zdroj]
- u endotermní reakce – se zvyšující se T se zvyšuje K
- u exotermní reakce – se zvyšující se T se snižuje K
- Zvýšením teploty nastane posun rovnováhy ve směru tvorby produktů u endotermní reakce.
- Snížením teploty nastane posun rovnovážného složení ve směru tvorby produktů u exotermní reakce.
- S (s) + O2 (g) → SO2 (g)
- Jedná se o exotermní reakci → snížit teplotu.
- N2 (g) + O2 (g) → 2 NO (g)
- Jedná se o endotermní reakci → zvýšit teplotu.
Vliv katalyzátorů[upravit | editovat zdroj]
Katalyzátory nemají vliv na složení rovnovážné směsi, mění pouze čas, za který se ustanoví rovnováha. Ilustrativním příkladem jest například notoricky známá Haberova–Boschova syntéza amoniaku.
Shrnutí[upravit | editovat zdroj]
| Akce | Reakce |
|---|---|
| přidání reaktantů | zvýšení koncentrace produktů |
| přidání produktů | zvýšení koncentrace reaktantů |
| snížení tlaku | zvýšení kocentrace ve směru většího počtu molů látek |
| zvýšení tlaku | zvýšení koncentrace ve směru menšího počtu molů látek |
| snížení teploty | zvýšení koncentrace látek ve směru exotermické reakce |
| zvýšení teploty | zvýšení koncentrace látek ve směru endotermické reakce |
Typy reakcí[upravit | editovat zdroj]
Chemická rovnováha se ustanovuje v reakcích protolytických (acidobazických), redoxních, srážecích, komplexotvorných.
Chemická rovnováha ve srážecích reakcích[upravit | editovat zdroj]
Ve srážecích reakcích je heterogenní rovnováha.
Kc – závislá pouze na koncentraci kapalných nebo plynných látek. Ve srážecích reakcích se však nazývá součin rozpustnosti a označuje se Ks.
Čím je Ks menší, tím je látka méně rozpustná (stálejší).
Např. BaSO4 má součin rozpustnosti malý, proto se v lékařství využívá k vyšetření trávicího traktu.
Srážecí reakce se používají k důkazům a stanovení některých iontů v analytické chemii a k odstranění látek z reakční směsi (rozpustnost látky se dá výrazně snížit, přidáme-li elektrolyt, který má s málo rozpustnou solí shodný ion).
Chemická rovnováha v komplexních reakcích[upravit | editovat zdroj]
[Cu(NH3)4]2+ (aq) → Cu2+ (aq) + 4 NH3 (g)
Kc se v komplexních reakcích nazývá disociační konstanta komplexu a označuje se Kk.
Chemická rovnováha v redoxních reakcích[upravit | editovat zdroj]
Cu2+ (aq) + Zn (s) → Cu (s) + Zn2+ (aq)
V redoxních reakcích se Kc vztahuje jen k látkám, které jsou ve vodném roztoku.
Chemická rovnováha v protolytických reakcích[upravit | editovat zdroj]
V protolytických reakcích se Kc rozlišuje na KA (disociační konstanta kyseliny) a KB (disociační konstanta báze).
Z hodnot KA (KB) se dá určit síla kyseliny (zásady). Čím je menší hodnota KA (KB) → tím je kyselina (báze) slabší.
- silný elektrolyt:
- středně silný elektrolyt:
- slabý elektrolyt:
Elektrolyt je vodič 1. třídy. Náboj v něm přenáší ionty. Je to látka, která se při rozpouštění disociuje na ionty.
- silný elektrolyt – všechny molekuly se disociují na ionty (NaOH, H2SO4)
- slabý elektrolyt – na ionty se disociuje pouze část molekul, větší část látky je ve formě celých molekul (NH3, CH3COOH)
Odkazy[upravit | editovat zdroj]
Související články[upravit | editovat zdroj]
Použitá literatura[upravit | editovat zdroj]
- Přednášky RNDr. Aleny Trávníčkové
- Wikipedia. Chemická rovnováha [online]. Poslední revize 2013-03-09, [cit. 2015-03-19]. <https://cs.wikipedia.org/wiki/Chemick%C3%A1_rovnov%C3%A1ha>.
- Wikipedia. Le Chatelier's principle [online]. Poslední revize 2015-03-04, [cit. 2015-03-19]. <https://en.wikipedia.org/wiki/Le_Chatelier%27s_principle>.
- Wikipedia. Le Chatelierův princip [online]. Poslední revize 2014-05-14, [cit. 2015-03-19]. <https://cs.wikipedia.org/wiki/Le_Chatelier%C5%AFv_princip>.










![{\displaystyle {\ce {{{\mathit {a}}A}+{{\mathit {b}}B}->[{\mathit {k_{\mathrm {1} }}}]{{\mathit {c}}C}+{{\mathit {d}}D}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/38cd26ac60722bab2f652a3e2b9d79f4a45c5f31)


![{\displaystyle {\ce {{{\mathit {c}}C}+{{\mathit {d}}D}->[{\mathit {k_{\mathrm {2} }}}]{{\mathit {a}}A}+{{\mathit {b}}B}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ece0cc15b4fd42b8fb940a4784e643e27f5e4c89)


![{\displaystyle v_{1}=k_{1}[\mathrm {A} ]^{a}[\mathrm {B} ]^{b}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c36849d9cf137ccffc5c34df8011629580b17f10)
![{\displaystyle v_{2}=k_{2}[\mathrm {C} ]^{c}[\mathrm {D} ]^{d}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c423a340ef961d13a5c17cb491536fe5b070e765)

![{\displaystyle k_{1}[\mathrm {A} ]^{a}[\mathrm {B} ]^{b}=k_{2}[\mathrm {C} ]^{c}[\mathrm {D} ]^{d}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f4006d91f93dbb84449278072aee908e3a71102f)
![{\displaystyle {\frac {[\mathrm {C} ]^{c}[\mathrm {D} ]^{d}}{[\mathrm {A} ]^{a}[\mathrm {B} ]^{b}}}={\frac {k_{1}}{k_{2}}}=K}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d0742c44db46f30d50ad61a0ce351ade6c0d52df)