Plazmatické bílkoviny
(přesměrováno z Sérové bílkoviny)
Bílkoviny v krevním séru nebo plazmě jsou zastoupeny mnoha druhy proteinů pocházejících z různých buněk. Biosyntéza převážné většiny plazmatických bílkovin probíhá v játrech, menší část je syntetizována na jiných místech, např. v lymfocytech (imunoglobuliny) a enterocytech (např. apoprotein B-48). Odbourávání se uskutečňuje v hepatocytech a v mononukleárním fagocytárním systému, kde se degradují převážně bílkoviny po vytvoření komplexů (např. komplex antigen-protilátka, hemoglobin-haptoglobin). Intracelulárně jsou peptidové vazby bílkovin hydrolyzovány pomocí proteáz a peptidáz za vzniku aminokyselin. Další způsob odstraňování sérových bílkovin se uskutečňuje exkrecí orgány, především ledvinami a gastrointestinálním traktem.
Celková koncentrace bílkovin v séru je 65–85 g/l, což odpovídá onkotickému tlaku 3,33–3,52 kPa. V plazmě je koncentrace bílkovin vyšší o koagulační faktory.[1][2][3][4][5][6] [7] [8] [9] [10] [11]
Funkce plazmatických bílkovin
Funkce plazmatických bílkovin zahrnuje celou řadu oblastí:
- udržování koloidně-osmotického tlaku;
- transport důležitých látek (např. hormony, vitaminy, lipidy, bilirubin, léky);
- nutriční funkce;
- udržování acidobazické rovnováhy;
- hemokoagulace a fibrinolýza;
- obranné reakce organismu – humorální imunita:
Přehled sérových bílkovin
|
Podrobněji se zmíníme o albuminu a dále budeme charakterizovat skupinu bílkovin akutní fáze a imunoglobulinů.
Albumin
Albumin je sérová bílkovina, která se podílí 55–65 % na celkové bílkovině v séru (průměrná koncentrace albuminů v plazmě je 40 g/l[12]). Je syntetizován v játrech a jeho tvorba závisí na příjmu aminokyselin.
- Albumin se podílí podstatným způsobem na udržování onkotického tlaku plazmy. Hodnoty albuminu nižší než 20 g/l jsou spojeny s výskytem edémů.
- Plní transportní funkce. Transportuje bilirubin, hem, steroidní látky, tyroxin, mastné kyseliny, žlučové kyseliny, kovy, léky a další látky.
- Vytváří proteinovou rezervu organismu a slouží jako zdroj aminokyselin, zvláště esenciálních aminokyselin pro různé tkáně. Při malnutrici se jeho koncentrace snižuje. Koncentrace albuminu v séru není však dobrým indikátorem časné proteinové malnutrice, protože při nedostatku aminokyselin se snižuje i katabolismus albuminu a albumin se přemísťuje z intersticia, aby se zachovalo adekvátní množství v plazmě. Pomalý pokles je dán rovněž delším poločasem a velkou tělesnou zásobou. Z tohoto důvodu neodráží plný rozsah nutričního deficitu.
Reaktanty akutní fáze
Reakce akutní fáze je fyziologický děj, který se projevuje systémovým uvolněním mediátorů zánětu, v důsledku rozvoje patologických procesů (zánět, traumata, chirurgické výkony, infarkt myokardu, porod, nádorové procesy, stres, nadměrná fyzická zátěž).
Mediátory slouží k zajištění celkové odpovědi organismu, vzájemné komunikaci a regulaci probíhajících dějů. Rovněž vytváří celkové příznaky (horečka, únava, malátnost, bolest svalů a kloubů). Klinický význam mají látky, jejichž syntéza vzniká v důsledku známé patologie, případně když jejich koncentrace koresponduje s mírou poškození tkání. Takové látky nazýváme markery (jejich stanovením můžeme potvrdit či vyloučit diagnostiku jiného onemocnění.
Význam pozitivních reaktantů akutní fáze
Soubor proteinů akutní fáze je značně různorodý. Přesto lze podle účinku většinu z nich zařadit do některé z následujících skupin:
- Složky imunitní reakce
- Některé reaktanty akutní fáze se přímo podílejí na likvidaci noxy, která způsobila zánět. Další bílkoviny mají úlohu při odstraňování poškozených buněk, nebo modulují imunitní reakci. Patří sem např.
- C-reaktivní protein,
- složky komplementu, zejména C3 a C4,
- tumor necrosis factor α (TNF-α), interleukin 1 (IL-1) a interleukin 6 (IL-6).
- Ochrana před kolaterálním poškozením tkáně
- Během akutní fáze se především z fagocytů a rozpadajících se buněk uvolňují látky, které mají zničit noxu, jež vyvolala zánět, a „rozpustit“ poškozenou tkáň. Jsou to hlavně proteolytické enzymy a reaktivní formy kyslíku. Účinek těchto látek je třeba omezit, aby působily jen tam, kde mají – tj. aby tzv. kolaterální poškození tkáně bylo co nejmenší. Mezi reaktanty akutní fáze proto najdeme
- inhibitory proteáz
- bílkoviny, které snižují tvorbu a dostupnost reaktivních forem kyslíku
- Jde nejen o scavengery reaktivních forem kyslíku v pravém slova smyslu, ale také o bílkoviny, které váží a stabilizují přechodné kovy a jejich komplexy. Tím snižují tvorbu ROS ve Fentonově reakci a podobných pochodech. Patří mezi ně
- Transport odpadních látek vznikajících během zánětu
- Kromě hemoglobinu a hemopexinu uvedených výše sem pravděpodobně patří
- sérový amyloid A (SAA).
- Koagulační faktory a bílkoviny podílející se na regeneraci tkáně, např.
Význam některých pozitivních reaktantů akutní fáze zůstává neznámý, přestože se může jednat o bílkoviny klinicky významné (používají se jako zánětlivé parametry). Zmiňme například prokalcitonin (PCT).
Rychlost změn koncentrace reaktantů akutní fáze
Plazmatická koncentrace různých reaktantů akutní fáze se mění různě rychle. Podle doby od začátku onemocnění, za niž se změní, rozdělujeme reaktanty akutní fáze do tří skupin:
Časné proteiny akutní fáze
jsou bílkoviny s velmi krátkým biologickým poločasem. Změny jejich plazmatické koncentrace jsou patrné již za 6–10 hodin po začátku onemocnění. Vzestup vrcholí obvykle v průběhu druhého a třetího dne. Hlavními představiteli jsou především C-reaktivní protein (CRP) a sérový amyloid A (SAA). Nověji se v klinické praxi používá prokalcitonin (PCT).
- C-reaktivní protein
C-reaktivní protein (CRP) je hlavní bílkovina reaktantů akutní fáze. Je to látka, která hraje úlohu opsoninu. Své jméno získal díky tomu, že precipituje s tzv. C-polysacharidem pneumokoků[13]. Je součásti vrozené imunity.
Plazmatická koncentrace CRP se zvyšuje již za 4 hodiny po navození reakce akutní fáze a v průběhu prvních dvou dnů jeho koncentrace vzroste i více než 100krát. Maximální koncentrace je dosaženo za 24–48 hodin, přibližně 24 hodin je i poločas CRP[14].
Fyziologicky bývá plazmatická koncentrace do 8-10 mg/l[15]. Rychlý a vysoký vzestup CRP (typicky na hodnoty nad 50 mg/l) doprovází především akutní bakteriální infekce, méně obvykle také mykotické infekce. Virové infekce naproti tomu bývají charakterizovány relativně malým vzestupem CRP (zpravidla pod 25 mg/l)[16]. Stanovení plazmatické koncentrace CRP proto napomáhá v rozhodnutí, zda zahájit léčbu antibiotiky[13]. Úspěšná antibiotická terapie se pak projeví rychlým poklesem CRP, naopak při neúspěšné léčbě přetrvává zvýšení.
Stanovením CRP lze odhalit riziko pooperační infekce. Třetí den po operaci má jeho koncentrace rychle klesat k normě. Přetrvávající zvýšení nebo jen částečný pokles, následovaný dalším zvýšením, naznačuje přítomnost infekce nebo jiné zánětlivé komplikace.
Mírný vzestup CRP provází i infarkt myokardu. Obecně lze také říci, že mírně elevované hladiny CRP (obvykle nad 10 mg/l) patří mezi známky vysokého kardiovaskulárního rizika[17]. Sledování koncentrací CRP je užitečné i při monitorování autoimunitních onemocnění[18].
Nevýhodou CRP je jeho nízká specifita. Na rozdíl od prokalcitoninu neinformuje o závažnosti orgánového postižení, nýbrž pouze o přítomnosti infekce. Vzájemně se tyto dva markery nenahrazují, ale doplňují.
Struktura
Molekula CRP je tvořena 5 nekovalentně spojenými jednotkami, z nichž každá je tvořena jednoduchým neglykosylovaným polypeptidovým řetězcem. CRP patří do skupiny pentraxinů.
Funkce
Mezi hlavní funkce CRP patří:
- Opsonizace, jejíž princip spočívá ve vazbě CRP na fosfatidylcholin, který je součástí bakteriálních stěn.
- Aktivace komplementu,
- stimulace fagocytujících buněk,
- schopnost vázat C-polysacharid buněčné stěny Streptococcus pnemoniae.
- Prokalcitonin
V posledních letech se ve výzkumu i v klinické praxi začíná jako reaktant akutní fáze využívat prokalcitonin (PCT). Tuto bílkovinu o 116 aminokyselinách a molekulové hmotnosti 13 000 fyziologicky tvoří C buňky štítné žlázy jako prekurzor hormonu kalcitoninu. Zejména při generalizovaných bakteriálních infekcích jej však začnou produkovat i další buňky, hlavně neuroendokrinní buňky plic a střeva, ale i buňky parenchymatózních orgánů a při sepsi prakticky všechny tkáně a typy buněk[19]. Koncentrace této bílkoviny pak v plazmě prudce stoupá. PCT uvolněný při sepsi není konvertován na kalcitonin.[20] Přesný fyziologický význam prokalcitoninu není zdaleka objasněn; předpokládá se, že se podílí na regulaci zánětu a má analgetické účinky. Poločas prokalcitoninu je 1 den a po imunitní stimulaci vzrůstá jeho sérová koncentrace již během 2–3 hodin asi dvacetinásobně. Zvýšení lze pozorovat jen při generalizovaných bakteriálních, mykotických a protozoárních infekcích, neobjevuje se u virových infekcí. S méně výrazným vzestupem se lze setkat u polytraumat, popálenin a po rozsáhlých břišních operacích.
Proteiny akutní fáze se střední dobou odpovědi
jsou proteiny, jejichž koncentrace se mění 12–36 hodin po začátku onemocnění a maxima je dosaženo ke konci prvního týdne. Patří k nim α1-kyselý glykoprotein (orosomukoid), α1-antitrypsin, haptoglobin a fibrinogen.
Pozdní proteiny akutní fáze
jsou zastoupeny složkami komplementu C3 a C4 a ceruloplazminem, u nichž se změny rozvíjí až po 48–72 hodinách po začátku onemocnění. Vzestup koncentrací je ve srovnání s oběma předchozími skupinami proteinů méně vyjádřen a vrcholu dosahují až po 6–7 dnech.
Negativní reaktanty akutní fáze
Negativní reaktanty akutní fáze jsou bílkoviny, jejichž hladiny se v průběhu akutní zátěže snižují. Hlavními zástupci jsou albumin, prealbumin a transferin. Pro sledování a hodnocení průběhu reakce na zátěž mají menší význam než pozitivní reaktanty. Často jsou však využívány jako kritérium syntézy bílkovin v játrech a jako ukazatelé malnutrice.
Imunoglobuliny
Protilátky (imunoglobuliny) jsou specifické globuliny krevní plazmy s elektroforetickou pohyblivostí β–γ. Vznikají v plazmatických buňkách jako humorální součást imunitní reakce na určitý antigen. Molekula imunoglobulinu má schopnost specificky vázat příslušný antigen, proti kterému se vytvořila. Po vazbě vzniká imunitní komplex. Kromě toho imunoglobuliny plní další funkce zahrnující např. vazbu komplementu, vazbu na neutrofilní leukocyty a makrofágy, aktivaci fagocytózy. Imunoglobuliny dělíme na 5 tříd – IgG, IgM, IgA, IgD a IgE. U třídy IgG byly popsány ještě podtřídy – IgG-1, IgG-2, IgG-3, IgG-4, jejichž funkce se liší. Rovněž třída IgA není jednotná, tvoří ji podtřídy IgA-1 a IgA-2. Základní struktura molekuly imunoglobulinu je tvořena dvěma stejnými těžkými řetězci (H-řetězce), označovaných podle jednotlivých tříd γ, μ, α, δ a ε, a dvěma lehkými řetězci (L-řetězce) κ a λ, které jsou pro jednotlivé třídy společné. Každá molekula imunoglobulinu obsahuje buď κ nebo λ řetězce. Při první infekci baktériemi či protozoy nastupuje v průběhu 2–3 dnů tvorba protilátek IgM, která je později během 5–7 dnů vystřídána tvorbou IgG se stejnou specifitou. Opakovaná infekce způsobí rychlé zvýšení hodnot IgG a malé zvýšení koncentrace IgM. Výrazné změny množství imunoglobulinů se projeví při elektroforetickém vyšetření jako:
- hypogamaglobulinemie (snížení vrcholu v oblasti γ);
- hypergamaglobulinemie;
- polyklonální (zvýšení vrcholu β-γ globulinu o široké bázi);
- monoklonální (úzký vrchol v oblasti β-γ globulinů).
Hypogamaglobulinemie
Hypogamaglobulinemie vzniká v důsledku zvýšených ztrát imunoglobulinů močí nebo střevem. Jinou závažnou příčinou je pokles tvorby imunoglobulinů, který může postihovat všechny nebo pouze jednotlivé třídy. Tyto defekty humorální imunity mohou být primární nebo sekundární a jsou příčinou závažných imunodeficitních stavů projevujících se opakovanými infekcemi s těžkým průběhem.
Hypergamaglobulinemie
Polyklonální hypergamaglobulinemie
Polyklonální hypergamaglobulinemie se vyvíjí jako odpověď na antigenní stimulaci, při níž dochází k aktivaci více klonů plazmatických buněk, a tím i ke zvýšení koncentrace imunoglobulinů, které postihuje jednu nebo více tříd imunoglobulinů – mluvíme o polyklonální gamapatii.
- Setkáváme se s ní při chronických infekcích, jaterních a autoimunitních onemocněních.
- Při elektroforetickém vyšetření zjišťujeme zvýšení frakce gamaglobulinů vytvářející široký neostře ohraničený pruh v oblasti γ-globulinů.
Monoklonální hypergamaglobulinemie
Monoklonální imunoglobuliny (paraproteiny) jsou imunoglobuliny nebo fragmenty imunoglobulinů produkované jediným klonem plazmatických buněk. Jejich znakem je homogennost molekuly se stejnou primární strukturou; jsou zastoupeny imunoglobuliny se stejnou specifitou, tvořené pouze jediným typem těžkého řetězce a rovněž jediným typem lehkého řetězce.
- Fyzikálně-chemická homogenita paraproteinu se při elektroforéze projeví úzkým vrcholem, obvykle v oblasti β–γ globulinů.
- Monoklonální imunoglobuliny jsou nejčastěji třídy IgG a IgM. Jsou tvořeny buď kompletní molekulou imunoglobulinu, samotnými volnými lehkými řetězci (Bence-Jonesova bílkovina) nebo samotnými těžkými řetězci.
- Bence-Jonesova bílkovina snadno přechází glomerulárním filtrem do moči.
- Nález monoklonálních imunoglobulinů je příznakem maligního onemocnění plazmocytomu (= mnohočetný myelom), který je vyvolán nádorovým bujením jednoho klonu plazmatických buněk, nebo benigní monoklonální gamapatie.
Metody stanovení bílkovin v séru
Základním vyšetřením proteinů v séru nebo plazmě je stanovení jejich souhrnné koncentrace – tzv. celkové bílkoviny. Při nálezu patologických hodnot a v dalších indikovaných případech následuje podrobnější vyšetření, které zahrnuje elektroforézu sérových bílkovin, imunofixaci a cílené stanovení koncentrace vybraných sérových proteinů.
Celková bílkovina
Stanovení celkové bílkoviny v séru je běžná a dostupná metoda. Vyšetření koncentrace celkové bílkoviny v séru nám poskytuje orientační informaci o biosyntéze, utilizaci a exkreci bílkovin. Změnu ve složení sérových bílkovin vyvolávají různá onemocnění, ale pouze některé se projeví odchylkou v hodnotách celkové bílkoviny.
Koncentrace celkové bílkoviny v séru může být ovlivněna těmito základními faktory:
- hydratací organismu;
- změnou biosyntézy jednoho nebo více specifických proteinů;
- rychlostí ztrát jednoho nebo více specifických proteinů.
Hypoproteinemie
Hypoproteinemie je označení pro sníženou koncentraci bílkoviny v séru.
Absolutní hypoproteinemie vzniká v důsledku sníženého množství bílkoviny v séru při:
- zvýšených ztrátách;
- ledvinami;
- gastrointestinálním traktem (např. záněty střeva);
- kůží (popáleniny);
- krvácením;
- do „3. prostoru“ (např. do břišní dutiny při ascitu);
- snížené proteosyntéze v játrech (chronická jaterní onemocnění);
- nedostatečném příjmu bílkoviny potravou při poruchách výživy.
U relativní hypoproteinemie je zachováno normální množství bílkovin, které jsou ale v důsledku retence vody a elektrolytů „naředěné” (stav hyperhydratace). Koncentrace individuálních proteinů jsou snížené ve stejném poměru.
Hyperproteinemie
Hyperproteinemií rozumíme zvýšenou koncentraci celkové bílkoviny v séru.
Absolutní hyperproteinemie je zvýšení koncentrace bílkoviny vyvolané obvykle zvýšenou syntézou některých specifických proteinů, např. imunoglobulinů (plazmocytom).
Relativní hyperproteinemie vzniká jako následek dehydratace organismu při nedostatečném příjmu či nadměrných ztrátách tekutin (těžké průjmy, zvracení). Celkové množství bílkovin je zachováno a koncentrace jednotlivých proteinů je zvýšená proporcionálně.
Princip stanovení celkové bílkoviny
Celkovou bílkovinu v séru stanovujeme biuretovou reakcí.
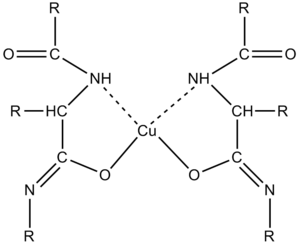
V alkalickém prostředí v přítomnosti měďnatých solí dávají bílkoviny fialové zbarvení, vhodné k fotometrickému stanovení[22][23]. Zjednodušeně se dá říci, že se vytvářejí komplexní sloučeniny Cu2+ s ionty peptidových vazeb[21]. Vzniklý komplex silně absorbuje světlo v oblasti 540–560 nm. Intenzita zbarvení komplexu se měří fotometricky a je přímo úměrná koncentraci bílkovin. Biuretovou reakci obecně poskytují látky obsahující v molekule alespoň dvě peptidové vazby (-CO-NH-) nebo dvě skupiny -CO-NH2. Reakce tedy není specifická pouze pro bílkoviny. Nejjednodušší sloučeninou reagující s měďnatými solemi v alkalickém prostředí je biuret obsahující dvě peptidové vazby. Aminokyseliny a dipeptidy nereagují.
Součástí biuretového činidla je síran měďnatý, který poskytuje Cu2+ pro tvorbu komplexů s peptidovými vazbami, a alkalizující složka (hydroxid), který převede peptidovou vazbu na enolformu a umožní tak účast atomů kyslíku v komplexu. Dalšími složkami činidla jsou vinan draselno-sodný, který zabraňuje jako komplexotvorná látka srážení Cu2+ na Cu(OH)2, a jodid draselný, který chrání Cu2+ před autoredukcí. Citlivost biuretové metody se pohybuje kolem 1–10 g bílkoviny/l.
Referenční rozmezí: Koncentrace celkové bílkoviny v séru (S-celková bílkovina): 65–85 g/l
Albumin
Stanovení koncentrace albuminu v séru patří mezi rozšířená biochemická vyšetření, vhodná zejména u onemocnění jater, ledvin a hodnocení nutričního stavu. Snížení albuminu může doprovázet chronické záněty a zvýšení katabolismu u některých chorobných stavů. Ostatní příčiny snížení nebo zvýšení koncentrace albuminu jsou podobné jako u celkové bílkoviny.
Princip stanovení albuminu
Ve slabě kyselém prostředí se albumin chová jako kation. Může reagovat s aniontovými barvivy a vzniká komplex albumin-barvivo. Navázání barviva je provázeno změnou jeho zbarvení. K vazbě dochází v mírně kyselém prostředí za přítomnosti povrchově aktivních látek.
Používají se organická barviva, která s albuminem reagují podstatně rychleji než s ostatními sérovými bílkovinami. Nejčastěji obsahují skupinu -SO3H. Příkladem může být bromkresolový purpur nebo bromkresolová zeleň.
Referenční rozmezí: Koncentrace albuminu v séru (S-albumin): 35–53 g/l
Pro stanovení albuminu v jiných tekutinách, např. v moči nebo v mozkomíšním moku, se obvykle používají citlivější imunochemické metody (nejčastěji imunoturbidimetrie).
Elektroforéza bílkovin v séru
Princip elektroforézy sérových bílkovin
Elektroforéza (ELFO) je založena na pohybu nabitých částic v elektrickém poli. Stanovované látky musí mít charakter iontů nebo amfolytů. Bílkoviny patří mezi amfolyty, které mohou nabývat kladného i záporného náboje v závislosti na pH pufru, při kterém elektroforéza probíhá. Je-li směs nabitých částic vystavena působení elektrického pole, začnou se molekuly látek pohybovat. Pohyblivost bílkovin je ovlivněna těmito faktory:
- charakterem dělené látky (velikost náboje, tvar a velikost molekul, relativní molekulová hmotnost);
- vlastnostmi prostředí, ve kterém dělení probíhá (hodnota pH, iontová síla, napětí, proud).
Pozitivně nabité molekuly proteinů se lépe adsorbují než negativně nabité molekuly, a proto při elektroforéze proteinů jsou využívány negativní náboje. Izoelektrický bod většiny sérových bílkovin je v oblasti slabě kyselé při pH 5–6. Proto v prostředí alkalického pufru, nejčastěji pH 8,6, budou u sérových bílkovin převažovat záporné náboje a jejich pohyb bude s různou rychlostí směřovat k anodě. Albumin vykazuje nejvyšší negativní náboj a tím i nejrychlejší pohyblivost k anodě.
Elektroforéza může probíhat na různých nosičích. Historicky nejstarším byl chromatografický papír. V klinicko-biochemické praxi se nejčastěji setkáváme s elektroforézou na acetátcelulózových foliích nebo na agarózovém gelu. Při elektroforéze, která využívá jako nosič papír nebo acetátcelulózu, putují molekuly bílkovin roztokem pufru, který je vně nosiče. Molekuly se tedy dělí především podle svého náboje. Podobně se budou dělit bílkoviny i v málo koncentrovaném agarózovém gelu.
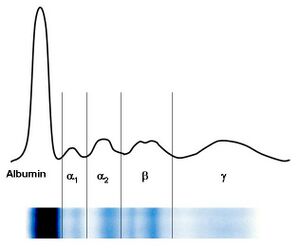
Pomocí elektroforézy se bílkoviny krevního séra rozdělí obvykle na 5–6 frakcí – albuminovou, α1, α2, β, γ frakce se někdy rozliší na β1 a β2. S výjimkou albuminů jsou další frakce tvořeny vždy skupinou bílkovin, které mají přibližně stejnou elektroforetickou pohyblivost.
Provedení
Kapka séra je přidána na sklíčko s elektroforetickým agorózovým gelem a rozprostřena po „startovní čáře“, kolmo na směr budoucího elektrického pole. Poté je vystavena účinkům elektrického pole v elektroforetické vaně. Vlivem elektrického pole začínají proteiny migrovat v agarózovém gelu.
Po uplynutí určité doby (např. 30 minut při napětí 120 V) se bílkoviny v gelu denaturují („fixují“), zpravidla působením alkoholů (metanolu) a kyselin (kyseliny octové). Tím se zabrání jejich difuzi nebo vymytí z gelu v dalších krocích. Poté se bílkoviny obarví vhodným organickým barvivem (např. amidočerní). Poloha jednotlivých frakcí a koncentrace bílkovin v nich se poté hodnotí pomocí denzitometrie.
- Více informací o elektroforéze formou on-line videa najdete např. na stránkách Masarykovy Univerzity.
Hodnocení elektroforézy sérových bílkovin
| Název frakce | Hodnoty v relativních % | Hodnoty v g/l |
|---|---|---|
| Albumin | 55–69 | 35–44 |
| α1 | 1,5–4 | 1–3 |
| α2 | 8–13 | 5–8 |
| β | 7–15 | 4–10 |
| γ | 9–18 | 5–12 |
Charakteristika jednotlivých frakcí
- Zóna prealbuminu
V této oblasti se pohybuje prealbumin (transtyretin), jehož zóna je však velmi diskrétní a těžko hodnotitelná.
- Zóna albuminu
Albumin vytváří poměrně širokou a z obou stran dobře ohraničenou zónu. Při poklesu koncentrace albuminu pod 30 g/l je patrné její oslabení. Vzácně pozorované zdvojení frakce je projevem genetické strukturní odchylky albuminu u heterozygotů – bisalbuminemie nebo vzniká při navázání cizorodé substance na albumin, např. penicilinu.
- Interzóna mezi albuminem a α1-globuliny
Slabé homogenní zbarvení této oblasti je podmíněno α1-lipoproteiny. Podobnou elektroforetickou pohyblivost vykazuje také α1-kyselý glykoprotein, ale zabarvení zóny ovlivňuje minimálně.
- Zóna α1-globulinů
Zónu α1-globulinů ovlivňuje především α1-antitrypsin. Při akutních zánětech je zřetelné zesílení. Klinicky významná je genetická variabilita α1-antitrypsinu, která se v elektroforéze může často zřetelně projevit oslabením, někdy až vymizením jeho zóny se současnou změnou pohyblivosti.
- Interzóna mezi α1 a α2-globuliny
Obvykle je celá slabě homogenně zbarvená.
- Zóna α2-globulinů
Na vytváření této zóny se podílejí především dvě bílkoviny – α2-makroglobulin a haptoglobin. Změny koncentrace α2-makroglobulinu nemají velký diagnostický význam. Haptoglobin vytváří 6 fenotypů, které se liší elektroforetickou pohyblivostí. Elektroforetické vyšetření neumožňuje rozlišení fenotypů haptoglobinu.
- Interzóna mezi α2 a β1-globuliny
Normálně se barví pouze slabě. Při hemolýze vznikají komplexy hemoglobin-haptoglobin, které v této oblasti vytvářejí samostatnou zónu.
- Zóna β1-globulinů
Tvar a intenzita zbarvení zóny β1-globulinů je ovlivněna prakticky pouze transferinem. Intenzita zóny dobře koreluje s celkovou vazebnou kapacitou plazmy pro železo. Při anemii z nedostatku železa a v těhotenství se zvyšuje syntéza transferinu a intenzita zóny se zesílí. Další protein s β1-elektroforetickou pohyblivostí, hemopexin, se špatně barví používanými barvivy a změny v jeho koncentraci se v elektroforéze neprojeví.
- Interzóna mezi β1 a β2-globuliny
V této oblasti nalézáme imunoglobulin IgA, který podmiňuje homogenní zbarvení zóny. Dále zde vytváří typickou linii β-lipoprotein, jejíž přítomnost závisí na jeho koncentraci.
- Zóna β2-globulinů
Na vytváření zóny β2-globulinů se podílí C3 složka komplementu. Podle intenzity zbarvení se dá těžko odhadnout koncentrace C3.
- Zóna γ-globulinů
Charakter zóny γ-globulinů je ovlivněn koncentracemi čtyř podtříd imunoglobulinu IgG. Zvýšení IgG se projeví intenzivnějším zbarvením a rozšířením zóny v obou směrech. Imunoglobulin IgM leží blíže startu. Samostatné nebo současné zvýšení koncentrace IgM pomocí elektroforézy nerozpoznáme.
Klinické využití
Elektroforéza sérových bílkovin (ELFO) se provádí zejména, zjistíme-li patologický výsledek celkové bílkoviny, nebo potřebujeme-li podrobnější informaci o sérových bílkovinách. Zvlášť cenné je pro průkaz:
- dysproteinemie – změna koncentrace a kvalitativního složení jednotlivých bílkovin v séru,
- paraproteinemie – charakterizována přítomností monoklonálních imunoglobulinů.
ELFO u některých patologických stavů
| Typ elektroforeogramu | Komentář | Alb | α1 | α2 | β | γ | Výskyt (příklad) |
|---|---|---|---|---|---|---|---|
| Akutní zánět |
|

|
| ||||
| ↓ nebo N | ↑ | ↑ | N | ||||
| Chronický zánět |
|

|
| ||||
| ↓ nebo N | N | N | N | ↑ | |||
| Chronický aktivní zánět |
|

|
| ||||
| ↓ | ↑ | ↑ | N | ↑ | |||
| Hepatální typ |
|

|
| ||||
| ↓ | ↓ | ↓ | ↓ | ↑ | |||
| Nefrotický typ |
|

|
| ||||
| ↓ | N | ↑ | ↑ | ↓ nebo N | |||
| Hypogamaglobulinemie |
|

|
| ||||
| N | N | N | N | ↓ | |||
| Monoklonální gamapatie |
|

|
| ||||
| ↓ | ↓ | ↓ | ↑ | ↑ | |||
Odkazy
Související články
Reference
- ↑ BURTIS, Carl A a Edward R ASHWOOD. Tietz textbook of clinical chemistry. 2. vydání. Philadelphia : Saunders, 1994. 2326 s. ISBN 0-7216-4472-4.
- ↑ BURTIS, Carl A, Edward R ASHWOOD a David E BRUNS. Tietz textbook of clinical chemistry and molecular diagnostics. 4. vydání. St. Luis : Elsevier Saunders, 2006. 2412 s. ISBN 0-7216-0189-8.
- ↑ DZÚRIK, Rastislav, et al. Štandardná klinickobiochemická diagnostika. 1. vydání. Martin : Osveta, 1990. 443 s.
- ↑ HOMOLKA, Jiří. Klinická biochemie pro praxi : stručná patobiochemie, indikace vyšetření a jejich interpretace. 1. vydání. Praha : Avicenum, 1982. 401 s.
- ↑ KOLEKTIV AUTORŮ,. Lékařská chemie a biochemie : celost. vysokošk. učebnice pro stud. lékařských fakult v ČSFR, stud. obor všeobecné lékařství, dětské lékařství a hygiena. [Díl 2], Praktikum. 1. vydání. Praha, Bratislava : Avicenum, Osveta, 1991. 237 s. ISBN 80-201-0114-4.
- ↑ KRAML, J, et al. Návody k praktickým cvičením z lékařské chemie a biochemie. přepracované vydání. Praha : Karolinum, 1991. ISBN 80-7066-453-3.
- ↑ MASOPUST, J. Klinická biochemie. Požadování a hodnocení biochemických vyšetření I. a II. část. 1. vydání. Praha : Karolinum, 1998. ISBN 80-7184-650-3.
- ↑ MURRAY, R. K, et al. Harperova biochemie. 2. vydání. Jinočany : H+H, 1998. ISBN 80-85787-38-5.
- ↑ RACEK, J, et al. Klinická biochemie. 2. vydání. Praha : Galén, 2006. ISBN 80-7262-324-9.
- ↑ SCHNEIDERKA, P, et al. Stanovení analytů v klinické biochemii 1. část. 1. vydání. Praha : Karolinum, 1998. ISBN 80-7184-761-5.
- ↑ SCHNEIDERKA, P, et al. Vybrané kapitoly z klinické biochemie. 1. vydání. Praha : Karolinum, 1998. 119 s. ISBN 80-7184-505-1.
- ↑ ŠVÍGLEROVÁ, Jitka. Albumin [online]. Poslední revize 2009-02-18, [cit. 2010-10]. <https://web.archive.org/web/20160416224413/http://wiki.lfp-studium.cz/index.php/Albumin>.
- ↑ a b RACEK, Jaroslav, et al. Klinická biochemie. 2. vydání. Praha : Galén, 2006. 329 s. s. 71. ISBN 80-7262-324-9.
- ↑ ZIMA, Tomáš, et al. Laboratorní diagnostika. 2. vydání. Praha : Galén a Karolinum, 2007. 906 s. ISBN 978-80-246-1423-6.
- ↑ ZIMA, Tomáš, et al. Normální hodnoty [online]. Velký lékařský slovník online, [cit. 2020-02-13]. <http://lekarske.slovniky.cz/normalni-hodnoty>.
- ↑ KESSLER, Siegfried. Laboratorní dagnostika. 1. vydání. Praha : Scientia medica, 1993. 252 s. Memorix; s. 52. ISBN 80-85526-12-3.
- ↑ GREGOR, Pavel a Petr WIDIMSKÝ, et al. Kardiologie. 2. vydání. Praha : Galén, 1999. 595 s. s. 168. ISBN 80-7262-021-5.
- ↑ KLENER, Pavel, et al. Vnitřní lékařství. 3. vydání. Praha : Galén a Karolinum, 2006. 1158 s. ISBN 80-7262-430-X.
- ↑ LIU, H. H., J. B. GUO a Y. GENG. Procalcitonin: present and future. Irish Journal of Medical Science (1971 -). 2015, roč. 3, vol. 184, s. 597-605, ISSN 0021-1265. DOI: 10.1007/s11845-015-1327-0.
- ↑ ÚKBLD 1. LF a VFN Praha. Prokalcitonin : vývoj názorů na interpretaci [online]. ©2009. [cit. 2011-06-30]. <http://www.cskb.cz/res/file/akce/sjezdy/2009-Pha/ppt/B1/Kazda.pdf>.
- ↑ a b STRICKLAND, RD, ML FREEMAN a FT GURULE. Copper binding by proteins in alkaline solution. Analytical chemistry [online]. 1961, vol. 33, no. 4, s. 545-552, dostupné také z <https://pubs.acs.org/action/cookieAbsent>. ISSN 0003-2700. DOI: 10.1021/ac60172a019.
- ↑ DOUMAS, B T. Standards for total serum protein assays--a collaborative study. Clin Chem [online]. 1975, vol. 21, no. 8, s. 1159-66, dostupné také z <https://www.ncbi.nlm.nih.gov/pubmed/1169135>. ISSN 0009-9147.
- ↑ DOUMAS, B T, D D BAYSE a R J CARTER, et al. A candidate reference method for determination of total protein in serum. I. Development and validation. Clin Chem [online]. 1981, vol. 27, no. 10, s. 1642-50, dostupné také z <https://www.ncbi.nlm.nih.gov/pubmed/6169466>. ISSN 0009-9147.