Intrakraniální hypertenze
(přesměrováno z Nitrolební hypertenze)
Nitrolební hypertenze je definována jako zvýšení intrakraniálního tlaku (ICP – intracerebral pressure) nad 20 mm Hg. Vzhledem k pevnosti kalvy může vzniknout při zvětšení kteréhokoli ze 3 základních nitrolebních kompartmentů – mozkové tkáně, mozkomíšního moku a množství krve.
Fyziologie a patofyziologie intrakraniálního tlaku[upravit | editovat zdroj]
Mozek představuje pouze 2 % tělesné hmoty, ale cerebrální perfuze představuje 15 % klidového minutového srdečního výdeje, 20 % spotřeby O2. Mozek je svým založením expanzivní struktura a expanduje s každým srdečním úderem. Protože v průběhu venózního odtoku z mozku nejsou přítomny žádné chlopně, jakákoliv změna v nitrohrudním tlaku se promítá do hodnoty ICP. Fenoménem, který dokazuje toto tvrzení je pulzující velká fontanela i u některých zcela zdravých dětí. Výše uvedený úzký vztah intrathorakálního tlaku k intrakraniálnímu je důvodem, proč při umělé plicní ventilaci u pacientů s intrakraniální hypertenzí nastavujeme co nejnižší přípustné hodnoty PEEP.
U dospělého člověka je normální střední hodnota ICP okolo 15 mm Hg, jako širší rozmezí se udává 2–20 mm Hg. U novorozenců tolerujeme hodnoty < 10 mm Hg. Křivka mírně kolísá v závislosti na srdečním cyklu.
Vztah mezi objemem krania a ICP popisuje Monroova-Kellieho doktrína – lebeční dutina má fixní objem vyplněný třemi kompartmenty – mozkovou tkání, mozkomíšním mokem a krví, které jsou prakticky nestlačitelné (vzhledem k vysokému podílu vody v mozkové tkáni).
Zvětšení jednoho z kompartmentů může být vyváženo kompenzačními mechanismy: přesunutím mozkomíšního moku z lebeční dutiny do spinálního kanálu, snížením objemu krve v lebce (především v žilách) a určitou elasticitou mozkové tkáně. Pokud změny probíhají pomalu, elasticita a přestavba mozkové tkáně umožní značnou kompenzaci, například při normotenzním hydrocefalu. Po vyčerpání těchto mechanismů při zvětšování jedné ze složek roste ICP exponenciálně. Počátek selhávání kompenzačních mechanismů lze při monitoraci ICP pozorovat například přechodným zvýšením ICP například při kašli nebo v reakci na odsávání z dýchacích cest, což by mělo být varovným signálem pro rozvoj nitrolební hypertenze.
Mozkový perfuzní tlak[upravit | editovat zdroj]
Mozkový perfuzní tlak (CPP – cerebral perfusion pressure) je definován jako rozdíl mezi arteriálním a žilním tlakem v mozkových cévách. Velikost tohoto tlaku je zásadní pro udržení dobrého krevního zásobení mozkem. Protože tlak v žilách je obtížně monitorovatelný a je prakticky blízký tlaku nitrolebnímu, používá se pro výpočet následující rovnice:
- CPP – mozkový perfuzní tlak
- MAP – střední arteriální tlak (měřený invazivně například v a. radialis)
- ICP – nitrolební tlak
Z této rovnice vyplývá, že při terapii nitrolební hypertenze je třeba kromě monitorace vlastního ICP udržovat i dostatečný arteriální tlak pro udržení adekvátní mozkové perfuze.
Autoregulace mozkového krevního průtoku[upravit | editovat zdroj]
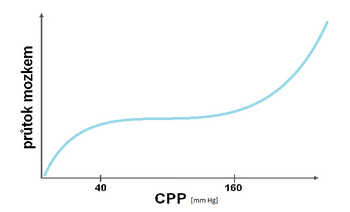
Tato vlastnost brání vzniku ischemie nebo mozkového edému udržováním relativně konstantního mozkového průtoku (CBF – cerebral blood flow) při změnách CPP regulací průsvitu mozkových cév. Fyziologicky je průtok stabilní v rozmezí CPP 40–160 mm Hg. Změny průtoku v závislosti na CPP ukazuje tlakově-průtoková křivka.
Metabolická spotřeba kyslíku mozkem (CMRO2)[upravit | editovat zdroj]
Metabolická spotřeba kyslíku mozkem, CMRO2 (cerebral metabolic rate O2):
- AVDO2 = mozková arteriovenózní diference
- CBF = průtok krve mozkem (cerebral blood flow)
Klinické situace se zvýšenou metabolickou aktivitou jako např. křeče nebo horečka se projeví zvýšením CMRO2, obvykle kompenzovaného zvýšeným mozkovým průtokem. Hypotermie spotřebu kyslíku snižuje. Z tohoto předpokladu vychází pak závěry pro možnosti léčení, tzn. snížení úrovně metabolismu mozku sedací, antipyretiky, antiepileptiky tak, aby byla zachována rovnováha mezi CRMO2 a CBF. Toto je i teoretický předpoklad pro tzv. léčebné barbiturátové kóma.
Cushingův reflex[upravit | editovat zdroj]
- Při nitrolební hypertenzi zjišťujeme vzestup tlaku krve jako reflexní snahu o udržení mozkové perfuze (CPP);
- k tomu vznikne bradykardie z dráždění nervus vagus;
- přibudou-li dechové poruchy, mluvíme o Cushingově trias.
![]() Vzestup tlaku krve při nitrolební hypertenzi je příznak pozdní a alarmující!
Vzestup tlaku krve při nitrolební hypertenzi je příznak pozdní a alarmující!
Intrakraniální tlak - YouTube video
Příčiny nitrolební hypertenze[upravit | editovat zdroj]
Na zákledě Monroovy-Kellieho doktríny může být příčinou zvětšení jednoho ze tří kompartmentů – mozkové tkáně, množství mozkomíšního moku a krve ve lbi. Příčiny se mohou navzájem ovlivňovat – expanzivní proces mozkové tkáně může vést ke vzniku obstrukčního hydrocefalu ultačením likvorových cest nebo vazogenního edému porušením hematoencefalické bariéry. Vazogenní edém může poruchou cirkulace být komplikován cytotoxickým edémem, který může být také důsledkem ischemie z různých příčin.
Změny mozkové tkáně[upravit | editovat zdroj]
Příčinou nitrolební hypertenze ze strany mozkové tkáně mohou například být:
- nádory mozku,
- mozkový absces,
- arachnoidální cysta,
- cysta jiného původu, například echinokoková,
- mozkový edém – zmnožení vody v mozkové tkáni, má více typů:
- cytotoxický edém – při hypoxii mozkových buněk, nejčastěji po úrazu nebo CMP;
- vazogenní edém – při poškození HEB, nejčastěji při nádoru nebo infekci;
- intersticiální edém – při obstrukci odtoku CSF;
- hypoosmolární edém – při poruchách minerálového metabolismu.
Změny likvoru[upravit | editovat zdroj]
Produkce MMM z 80 % probíhá v plexus choroideus, zbytek je produkcí endotelových buněk. Jde o aktivní proces závislý na energii a odpovídajícím enzymovém vybavení. MMM je distribuován do likvorových a subarachnoidálních prostor. Likvorové prostory jsou tvořeny dvěma postranními komorami, třetí komorou, aqueductem, čtvrtou komorou a spinálním centrálním kanálkem. Resorpce probíhá arachnoidálními klky do sinus sagitalis superior. Je podmíněna tlakovým gradientem mezi tlakem mozku a tlakem žilní krve v sinus sagitalis. Další možností je resorpce v oblasti míšního kanálu do venózní pleteně v obalech míšních kořenů. Malá část MMM se drénuje přes bulbus olfactorius a sliznici do hlubokých krčních uzlin.
Zvětšené množství likvoru je přítomno při akutním hydrocefalu, především obstrukčním (např. při kompresi tumorem nebo ucpáním koaguly po subarachnoideálním krvácení). Výše zmíněná arachnoidální cysta je také vyplněna likvorovou tekutinou.
Změny množství krve[upravit | editovat zdroj]
Zvýšené množství krve v nitrolebním prostoru je přítomno při nitrolebním krvácení všech typů (subarachnoideální krvácení, subdurální krvácení, epidurální krvácení, hCMP) a mozkové hyperemii (brain swelling). Při mozkové hyperemii dochází ke ztrátě autoregulace poškozením hypotalamu a mozkového kmene, což vede ke zvýšení průtoku mozkovými cévami, zvýšení objemu krve v mozku, což zvedne ICP a v následku vede k obstrukci venózního odtoku a tedy snížení CPP a mozkové ischemii. Tento stav je častější u dětí.
Klinická symptomatologie a diagnostika[upravit | editovat zdroj]
V anamnéze se ptáme na předchozí úraz, možnou intoxikaci, přítomné konvulze, poruchy dýchání, množství a frekvenci močení, febrilie, poruchy zraku.
Mezi prodromální symptomy nitrolební hypertenze patří:
- bolesti hlavy;
- zvracení/nausea;
- neklid;
- apatie nebo irritabilita;
- u dětí pak dále:
- dráždivý pláč (u kojenců typický „naříkavý“ a vysoce laděný pláč);
- vystouplá velká fontanela;
- rozšíření venózní pleteně na kůži hlavičky.
Zpočátku registrujeme tachykardii, tachypnoe a kolísání systémového tlaku. Při progresi se dostavují poruchy vědomí, vypadávání kmenových reflexů, tonusové poruchy, konvulze.
Typické manifestní symptomy intrakraniální hypertenze představují:
- patologická reakce zornic (zpočátku miosa při hyperventilaci a hyperpnoe, při masivním edému mozku pak mydriáza při lézi jader n. III, anizokorie);
- hyperventilace;
- často kombinace hypertenze s bradykardií (spolu s dechovými poruchami Cushingova trias);
- změny srdeční a dechové frekvence při flexi hlavy;
- porucha vědomí.
Klinickými příznaky při kritické hodnotě ICP jsou hypertenze, bradykardie a bradypnoe končící apnoí.
Klinické vyšetření v pediatrii zahrnuje kompletní pediatrické vyšetření včetně poklepu na kalvu (= příznak prasklého hrnce). V rámci neurologického vyšetření nutno zhodnotit stav vědomí (GCS), šlachookosticové reflexy na DK, vyšetření mozkového kmene (hlavové nervy), stav zornic (mydriáza, anizokorie), pohyblivost bulbů (paréza, diplopie), zhodnocení hybnosti v oblasti nervus facialis.
Mezi kmenové reflexy patří nasopalpebrální reflex (mrknutí při poklepu na kořen nosu) a korneální reflex (mrknutí při podráždění rohovky). Neurologické vyšetření zakončujeme vyšetřením meningeálních známek.
Základním a emergentním vyšetřením při nitrolební hypertenzi je CT hlavy (vyšetření provádíme až po zajištění a stabilizaci pacienta). Známkou edému mozku na CT scanu je setření gyrifikace, zúžení mozkových komor, snížení diference mezi bílou a šedou hmotou mozkovou. Alarmujícím příznakem je vymizení subarachnoidálních prostorů, bohužel se jedná již o příznak pozdní. EEG se odkládá většinou až za CT vyšetření kvůli časové náročnosti. Využít lze i transkraniální dopplerovskou ultrasonografii, u kojenců potom UZV přes "okno" velké fontanely.
Pri unilaterálně působícím procesu může dojít k posunu mozkové hmoty a vzniku herniace mozku.
![]() U pacientů se zvýšeným ICP je vysoké riziko vzniku okcipitálního konu při provedení lumbální punkce s rizikem náhlé zástavy dechu a úmrtí! Lumbální punkce je proto při nitrolební hypertenzi kontraindikována!
U pacientů se zvýšeným ICP je vysoké riziko vzniku okcipitálního konu při provedení lumbální punkce s rizikem náhlé zástavy dechu a úmrtí! Lumbální punkce je proto při nitrolební hypertenzi kontraindikována!
Monitorování intrakraniálního tlaku (ICP)[upravit | editovat zdroj]
K monitorování nitrolebečního tlaku se v dnešní době používají tlakové senzory zaváděné přímo do tkání. Všechny metody mají invazivní charakter s rizikem infekce. Všechny typy čidel zavádí neurochirurg.
Za zlatý standard v monitoraci ICP se povazuje ventrikulostomie – intraventrikulárně zavedený katetr, který umožňuje kromě přesného měření nitrolebního tlaku také odpuštěním mozkomíšního moku tlak regulovat.
V současné době se nejvíce využívá intraparenchymatózní monitoring nitrolebního tlaku (tenký, zavádí se do mozkové tkáně drobným návrtem; vysoká přesnost, jednoduchá instalace). Tlakové čidlo zavádíme z návrtu nad nedominantní hemisférou (1 cm před koronárním švem) a v rovině sagitální proložené zornicí odporující strany.
Pro doplnění v rámci neurointenzivní péče můžeme využít tzv. multimodální ložiskové monitorování, kdy lze intrakraniálně zavést senzory teploty a pO2, pCO2 a pH či mikrodialyzační katetry. Dále je často v rámci multimodálního monitorování využíváno i monitorování jugulární saturace krve kyslíkem (SvjO2), které umožňuje určit arteriovenózní diferenci v mozkovém oběhu.
Indikace měření ICP[upravit | editovat zdroj]
- Traumata mozku:
- GCS ≤ 8 a abnormální CT (hematom, kontuze mozku, edém mozku, komprese bazálních cisteren),
- GCS ≤ 8 s normálním CT při přítomnosti aspoň dvou z těchto podmínek:
- věk > 40 let,
- porucha hybnosti
- systolický TK < 90 mm Hg.
- monitorace po dekompresivní kraniektomii (diskutabilní).
- Netraumatická onemocnění mozku:
- indikováno vzácněji,
- po subarachnoideálním krvácení pro riziko obstrukčního hydrocefalu cestou ventrikulostomie,
- po evakuaci intracerebrálního krvácení po ruptuře aneurysmatu (součást rozhodování o dekompresivní kraniektomii),
- u vrozených hydrocefalů.
- Jiné indikace:
- kritéria se různí, například se uvádí obecné riziko zvýšení ICP nebo podezření na nitrolební hypertenzi, diagnóza nitrolebního procesu, některé zdroje uvádějí neurčené kóma s GCS < 8.
Kontraindikace měření ICP[upravit | editovat zdroj]
Infaustní stavy, koagulační poruchy, zaniklý komorový systém v případě ventrikulostomie.
Komplikace měření ICP[upravit | editovat zdroj]
Riziko infekčních komplikací výrazně stoupá s dobou zavedení čidla, také se zvyšuje s frekvencí evakuace likvoru u ventrikulostomie. Rizika hemoragie jsou u ventrikulostomie 1,1 %, u intraparenchymové monitorace 2,8 %. Obstrukce ventrikulostomie nastává v 6,3 %. Porucha funkce čidla je velmi častá, spojená například s nevhodnou manipulací s pacientem, její frekvence je cca 20 %. Měření ICP také zvyšuje riziko epilepsie, které se u intraparenchymového snímače udává kolem 2–3 %. [1]
Terapie nitrolební hypertenze[upravit | editovat zdroj]
![]() Základem terapie je především odstranění příčiny jejího vzniku!
Základem terapie je především odstranění příčiny jejího vzniku!
Kromě terapie primárního onemocnění se přistupuje k podpůrné terapii, která snižuje riziko sekundárního poškození mozkové tkáně zvyšováním nitrolebního tlaku. Projevem mozkového postižení je v objektivním nálezu klinický obraz poruchy vědomí. Jeho závažností se potom řídíme v indikaci terapie.
Zásady péče a monitorování jsou některými tříděny do odstupňovaných protokolů podle projevů závažnosti postižení. Zařazení některých terapeutických postupů se však v literatuře různí.
Indikací pro intubaci a umělou plicní ventilaci jsou :
- hodnota GCS < 8b. i při spontánním dýchání;
- vymizení ochranných laryngeálních reflexů;
- ventilační insuficience nebo spontánní hyperventilace navozující hypoxickou vazokonstrikci v CNS (pCO2 < 3,5 kPa);
- prohloubení poruchy vědomí o ∆GCS > 2b;
- bilaterální fraktura čelisti;
- masivní krvácení v ústech a křeče.
Základem pro stanovení poruchy vědomí je Glasgow Coma Scale and Score.
Schéma 1. stupně[upravit | editovat zdroj]
- Správné uložení pacienta s elevací horní poloviny těla – poloha hlavy 15–30°, tj. vyhnout se konstrikci krčních žil.
- Zavést intraparenchymové čidlo do CNS pro měření ICP, zajistit arteriální linku pro přímé měření krevního tlaku a zajistit centrální žilní katetr, nejlépe cestou v. subclavia k měření CVP. Za těchto podmínek můžeme vypočítat mozkový perfuzní tlak CPP.
- Cílem by mělo být udržení ICP < 20 torr, u malých dětí < 15 torr, u novorozenců a kojenců < 10 torr a CPP > 50 torr, u novorozenců > 40 torr (kritická je hodnota CPP < 40 torr). Neúměrně vysoká hodnota CPP (> 150 torr) může vést k progresi vazogenního edému.
- Iniciální infuzní terapie – tak, aby byl stabilizován oběh. Používají se krystaloidy 1/1 FR nebo 1/1Ringer (NE 1/1 Hartmann, neboť je lehce hypoosmolární), z koloidů přednostně hydroxyetylškrob. Iniciálně podáváme nejmenší nutné množství tekutin k dosažení a udržení patřičných hodnot MAP.
- UPV – podle hodnot nitrolebečního tlaku. Zpravidla postačuje dosažení hladin kapnie na dolní hranici normy (má protektivní vliv), normoxémie a SaO2 97 %.
- Udržovat normotermii.
- Sledování saturace v jugulárním bulbu ve fázi prvního kroku není podmínkou, může však přispět již v časné fázi terapie k identifikaci prognosticky závažnějších případů (např. při nízké extrakci kyslíku, při navýšení koncentrace laktátu v krvi odebrané z jugulárního bulbu). Hodnotu SvjO2 držíme > 60 %.
- Nutno udržovat i adekvátní extrakraniální homeostázu – tzn. udržovat vyrovnanou vodní bilanci a normotenzi (případně mírnou hypertenzi), glykémie by se měla pohybovat mezi 6–10 mmol/l, Na 145–150 mmol/l, osmolalita séra 295–305 mmol/l.
- Kontinuální analgosedace (fentanyl, sufentanyl, propofol), neboť neklid nemocného, kašel, interference s ventilátorem – to vše může vést k vzestupu ICP.
- Propofol jako anestetikum má výhodu v úvodní fázi terapie vzhledem ke svému krátkému poločasu, rychlému nástupu a možnosti frekventních reevaluací neurologického nálezu.
- Lze uvažovat i o myorelaxaci.
- Manitol – vytváří gradient pro pohyb vody směrem ven z tkáně do cévního řečiště, snižuje krevní viskozitu a vyvolává reflexní vazokonstrikci;
- indikací je zejm. prudký vzestup ICP a náhlé zhoršení neurologického nálezu;
- účinek se projeví za 2 minuty, největší pokles za 20–60 minut;
- jeho podání se může komplikovat rebound fenoménem při extravazaci po poškození mozkových cév, například v rámci vazogenního edému.
- Hypertonický solný roztok NaCl se používá v bolusu pro podobné indikace jako Manitol. Zdá se, že jeho efekt na korekci ICP je krátkodobě lepší, dlouhodobé výsledky však nebyly dostatečně analyzovány.
- Furosemid – snižuje ICP redukcí edému, synergizuje s manitolem, tlumí sekreci likvoru;
- Restrikce přívodu tekutin – pouze u hypoosmotického edému.
- Kortikosteroidy – pouze v omezených indikacích, především u vazogenních edémů a nitrolební hypertenze spojených s nádorem či mozkovou infekcí;
- považováno za základní možnost terapie traumat míchy, avšak důkazy o jejich účinnosti jsou sporné, některé metaanalýzy zmiňují i převahu nežádoucích účinků nad nejistým pozitivním přínosem;
- kortikoidy by neměly být používány u traumat hlavy, nitrolebního krvácení ani ischemických CMP.
- Pokud je vyšší riziko vzniku peptických vředů (podávání např. nesteroidních antiflogistik spolu s glukokortikoidy), podáváme antacida a blokátory H2 receptorů jako prevenci.
Schéma 2. stupně[upravit | editovat zdroj]
- Hyperventilace způsobuje vazokonstrikci mozkových cév (poklesem parciálního tlaku CO2 se sníží ICP).
Alveolární ventilaci zvyšujeme tak, aby bylo dosaženo hodnot pCO2 4,0–4,5 kPa při saturaci venózní krve v jugulárním bulbu > 55 %. Použití samotné hyperventilace bez možnosti monitorování SvjO2 je riskantní – hrozí ischemie mozku při nadměrné vazokonstrikci.
Schéma 3. stupně[upravit | editovat zdroj]
- Thiopental významně sníží metabolické nároky CNS v tzv. barbiturátovém kómatu a sníží tak spotřebu O2 mozkovou tkání. Thiopental snižuje CMRO2, tedy mozkový metabolismus (až o 50 %), vede k poklesu krevního průtoku mozkem. Mezi jeho další účinky patří snížení hladin excitatorních aminokyselin v CNS (glutamát), rovněž působí stabilizačně na buněčné membrány.
- Hypotermie snižuje ICP dvojím mechanismem. Dochází ke snížení CMRO2, důsledkem je pokles CBF a CBV (ovlivnění vazogenního edému). Druhým mechanismem je stabilizující efekt hypotermie na buněčné membrány (ovlivnění cytotoxického edému). Ideální je TT 33–34° C. Užíváme hypotermii lokální (obložení hlavy ledem) nebo celkovou. Hypotermie inhibuje funkci neutrofilů a proto je zvýšené riziko infekce. Hypotermie je indikována po selhání konvenční terapie nitrolební hypertenze.
- Drenáž mozkomíšního moku pomocí ventrikulostomie pomůže snížení ICP zmenšením kompartmentu MMM.
- Dekompresní kraniotomie může být posledním možným řešením ke snížení nitrolební hypertenze. O indikaci k výkonu v této fázi rozhoduje anesteziolog společně s neurochirurgem. Metoda je vhodná u pacientů, kteří splňují některá nebo všechna následující kritéria :
- difuzní mozkový edém na CT;
- doba < 48 hod od inzultu;
- žádné dlouhé epizody ICP > 40 torr;
- GCS > 3 b.;
- sekundární zhoršení klinického stavu;
- rozvoj příznaků mozkové herniace nereagující na manitol.
Dekompresivní kraniotomie - YouTube video
Hodnocení výsledků léčby[upravit | editovat zdroj]
Výsledky léčby se hodnotí tzv. Glasgow Outcome Scale (GOS) po 6 měsících:
- přežití s dobrým výsledkem = schopen nezávislého života s minimálním či žádným neurologickým postižením;
- střední porucha mozkových funkcí = neurologické a intelektuální postižení s možností nezávislého života;
- těžká porucha mozkových funkcí = při vědomí, ale zcela závislý na pomoci v denních aktivitách;
- vegetativní stav;
- smrt.
Odkazy[upravit | editovat zdroj]
Související články[upravit | editovat zdroj]
Externí odkazy[upravit | editovat zdroj]
- Intrakraniální hypertenze a EKG (TECHmED)
- Monitoring pacientů s těžkým poraněním mozku Martin Smrčka 2011
Nitrolební hypertenze
Syndrom nitrolební hypertenze
Reference[upravit | editovat zdroj]
- ↑ ŠEVČÍK, Pavel, et al. Intenzivní medicína. 3. vydání. Galén, 2014. 1195 s. s. 459–465. ISBN 9788074920660.
Použitá literatura[upravit | editovat zdroj]
- SMITH, Edward R, et al. Evaluation and management of elevated intracranial pressure in adults [online]. UpToDate, Poslední revize 2020-04-26, [cit. 2020-05-14]. <https://www.uptodate.com/contents/evaluation-and-management-of-elevated-intracranial-pressure-in-adults>.
- ZEMAN, Miroslav, et al. Speciální chirurgie. 2. vydání. Praha : Galén, 2004. 575 s. ISBN 80-7262-260-9.
- NEVŠÍMALOVÁ, Soňa, Evžen RŮŽIČKA a Jiří TICHÝ. Neurologie. 1. vydání. Praha : Galén, 2005. s. 163-170. ISBN 80-7262-160-2.
- AMBLER, Zdeněk. Základy neurologie. 6. vydání. Praha : Galén, 2006. s. 171-181. ISBN 80-7262-433-4.
- SAMEŠ, M, et al. Neurochirurgie. 1. vydání. Praha : Jessenius Maxdorf, 2005. ISBN 80-7345-072-0.
- HAVRÁNEK, Jiří: Intrakraniální hypertenze.
- Otázky J. Beneše, zdroj: přednášky