Buněčná signalizace
Buněčnou signalizací označujeme komunikaci mezi buňkami.
Reguluje:
- vývoj buněk a jejich organizaci do tkání,
- růst a dělení buněk,
- koordinaci buněčných funkcí.
Typy signalizace
Endokrinní (hormonální)
Buňky vylučují signální molekuly (především hormony), které se dostanou do krve a oběhovým systémem k cílové buňce, na jejíž receptor se naváží.
- Působení – vzdálené.
- Rychlost – v minutách.
Parakrinní
Buňky uvolňují do ECT chemické látky (např. růstové faktory), které působí jako lokální mediátory a ovlivní buňky v nejbližším okolí. Tímto způsobem fungují například signální molekuly, které regulují zánět v místě infekce nebo buněčnou proliferaci při hojení ran.
Autokrinní
Secernovaná signální molekula se váže na receptor buňky, která ji vyprodukovala.
Synaptická
Tato signalizace je specifická pro nervovou soustavu živočichů. Nervová buňka produkuje chemický signál (neurotransmiter), který se přenáší k jiné nervové buňce synaptickou štěrbinou.
- Rychlost − až 100 m/s[1].
Způsoby buněčné komunikace
Přímým kontaktem
- Spojovací komplexy zajišťují kontinuitu buněk, které spolu sousedí. U živočišných buněk pomocí nexů (gap junctions), u rostlinných buněk pomocí plazmodezmat.
- Interakce povrchových buněčných molekul.
Prostřednictvím signálních molekul
Signální molekuly jsou látky, které jsou schopné přenosu signálu. Lze je rozdělit podle chemické povahy do několika skupin:
- Lipofilní signální molekuly:
- steroidní hormony,
- thyroidní hormony,
- deriváty mastných kyselin (eikosanoidy),
- retinoidy (retinal).
- Peptidové a proteinové signální molekuly:
- peptidové hormony (např. liberiny, statiny, inzulin, glukagon, vazopresin),
- růstové faktory a cytokiny.
- Deriváty aminokyselin:
- Malé anorganické molekuly a ionty:
- Nukleotidy:
Mechanismus účinku signálních molekul
Závisí na tom, zda je signální molekula rozpustná ve vodě (hydrofilní) nebo v tucích (hydrofobní). Cytoplazmatická membrána buněk je prostupná pro hydrofobní (= lipofilní) signální molekuly a pro malé anorganické molekuly jako např. NO. Tyto molekuly se váží na cytoplazmatické nebo jaderné receptory, které většinou působí jako transkripční faktory řízené ligandy a po navázání signální molekuly ovlivňují transkripci genů. Pro hydrofilní signální molekuly (peptidy, proteiny) a deriváty aminokyselin je cytoplazmatická membrána nepropustná a proto jejich signalizace musí probíhat přes receptory nacházející se v cytoplazmatické membráně cílových buněk (tzv. membránové receptory). Po navázání signální molekuly (ligandu) na membránový receptor dochází k signální transdukci, tedy k přenosu signálu od receptoru do nitra buňky. Následuje intracelulární signalizace, která často zahrnuje druhé posly nebo specifické proteinkinázy. Ty následně regulují aktivitu efektorových proteinů a dojde ke změně chování buňky. Efektorovými proteiny mohou být enzymy ovlivňující metabolismus, transkripční faktory, složky cytoskeletu nebo iontové kanály.
Stádia signalizace
- Produkce signální molekuly signalizující buňkou (na základě nadřazené stimulace – např. hormony řízené hypothalamo-hypofyzární osou, nebo při změně koncentrace určitých molekul – např. glukosy nebo iontů).
- Přijetí signálu cílovou buňkou → signální molekula se váže na receptor.
- Přenos signálu (= signální transdukce) – může být jednokrokový nebo zahrnuje kaskádu změn molekul (tzv. signalizační dráha).
- Signál spouští specifickou odpověď.
- Degradace signální molekuly.
Typy membránových receptorů
Liší se signálem, který je vytvářen uvnitř buňky po navázání extracelulární signální molekuly na receptor.
![]() Na membránové receptory se váží pouze hydrofilní látky. Hydrofobní látky procházejí membránou bez specifických přenašečů a váží se na své receptory až v cytoplazmě nebo v jádře (nejznámější hydrofobní látky jsou steroidy a hormony štítné žlázy).
Na membránové receptory se váží pouze hydrofilní látky. Hydrofobní látky procházejí membránou bez specifických přenašečů a váží se na své receptory až v cytoplazmě nebo v jádře (nejznámější hydrofobní látky jsou steroidy a hormony štítné žlázy).
Enzymotropní receptory (katalytické receptory, receptory spojené s enzymy nebo receptory s vlastní enzymatickou aktivitou)
Jsou to proteiny, které prochází fosfolipidovou dvojvrstvou membrány pouze jednou. Skládají se z extracelulární části proteinu s vazebným místem pro signální molekulu, transmembránového α-helixu, cytoplazmatické části, která buď obsahuje vlastní enzymatickou aktivitu, nebo je spojena s enzymem. Receptor je buď ligandem řízený enzym, nebo protein, který se spojuje s enzymem. Mnoho receptorů obsahuje cytoplazmatickou část, která funguje jako tyrosinová proteinkináza. Po navázání signální molekuly se spojí 2 receptorové proteiny a vytvoří se dimer. Tím se aktivují tyrosinkinázové části receptoru, které fosforylují tyrosiny (pomocí fosfátových skupin z ATP) vlastního receptoru. Fosforylované tyrosiny slouží jako vazebná místa pro různé proteiny, které se po navázání stávají sami aktivními. Dochází tak například k aktivaci signální molekuly Ras (GTP-vázající protein), která následně aktivuje další proteinkinázy a ve finále nastává změna genové exprese. Ukončení signálu je katalyzováno protein-tyrosin-fosfatázou, nebo mohou být aktivované receptory endocytovány a odbourány v lyzosomech. Na receptory s tyrosinkinázovou aktivitou se váží např. růstové faktory nebo inzulin, podrobněji níže. Do skupiny enzymotropních receptorů patří i receptory s serin/threonin kinasovou, guanylátcyklasovou či tyrosinfosfatasovou aktivitou.
Receptory s tyrosinkinasovou aktivitou
Jsou převážně receptory většiny růstových a diferenciačních faktorů jako je například EGF (epidermální růstový faktor), PDGF (od destiček odvozený růstový faktor), IGF-1 (insulinu podobný růstový faktor) a receptor pro insulin. Po vazbě ligandu k receptoru dochází k jeho aktivaci a k přenosu fosfátové skupiny z ATP na specifické tyrosiny. Fosforylovány jsou buď tyrosiny samotných receptorových proteinů (autofosforylace) nebo tyrosiny specifických buněčných proteinů (nitrobuněčných proteinkinas). Tím je zahájena kaskáda nitrobuněčného přenosu signálu.
Ras proteiny patří mezi významné intracelulární signální proteiny, které se prvořadě podílejí na přenosu signálu od receptoru s tyrosinkinasovou aktivitou do nitra buňky, kde se uvádějí v činnost serin/threoninovou fosforylační kaskádu. Ras proteiny jsou ukotveny v cytoplazmatické části plasmatické membrány. Patří do rodiny monomerických GTPas (na rozdíl od G proteinů – trimerické GTPasy). Aktivace a funkce monomerických a trimerických GTPas je však obdobná. Nacházejí se v neustálém přechodu mezi aktivním stavem, kdy je na ně vázán GTP, a inaktivním stavem, kdy je vázán GDP. Ras proteiny jsou fosforylovány (aktivovány) receptorovými tyrosinkinasami, inaktivovány fosfatasami a hydrolýzou GTP, kterou samy uskutečňují.
Fosforylace tyrosinů Ras proteinů, kterou vykonávají receptorové tyrosinkinasy na cytoplasmatické straně plasmatické membrány, je záhy ukončena defosforylací specifickými tyrosinfosfatasami. Aktivované proteiny Ras se také samy inaktivují hydrolýzou navázaného GTP na GDP. Stimulace buněk k proliferaci a diferenciaci však vyžaduje dlouhodobou signalizaci. Další přenos signálu je zajištěn fosforylací serinů a threoninů MAP-proteinkinas (mitogen-activated protein kinases). Fosforylace serinů a threoninů má delší trvání než fosforylace tyrosinů proteinů Ras.
Aktivní komplex Ras/GTP se váže k Raf-kinase (MAP-kinasa 1) a aktivuje ji fosforylací serinů a threoninů.
Do regulace aktivity Raf-kinasy jsou také zapojeny další proteinkinasy:
- aktivaci Raf-proteinkinasy zvyšuje Src-proteinkinasa fosforylací thyrosinů;
- proteinkinasa C fosforylací serinů;
- fosforylace serinů proteinkinasou A má inhibiční účinek
Aktivní Raf-kinasa aktivuje fosforylací MAP-kinasu 2 a ta aktivuje MAP-kinasu 3, která vstupuje do jádra. Zde dochází k aktivaci regulačního proteinu, který stimuluje aktivitu genů podílejících se zejména na regulaci buněčné proliferace.
Aktivované Ras proteiny fosforylují a tím aktivují kaskádu tří typů MAP-kinas. Navázáním první MAP-kinasy (označované Raf) k aktivovanémuu Ras proteinu dojde k její fosforylaci a tím aktivaci. Ta pak katalyzuje serin/threoninovou fosforylaci další MAP-kinasy a tento enzym aktivuje další (třetí) MAP-kinasu Aktivace poslední MAP-kinasy v kaskádě fosforylací MAP- kinas vyžaduje fosforylaci jak threoninu, tak tyrosinu. Takto aktivovaná třetí MAP-kinasa po vstupu do jádra fosforyluje nejprve regulační protein, který je vázán ke krátké sekvenci DNA v regulační oblasti genů časné odpovědi – genu myc, jun a fos. Tím dochází k jejich transkripci.
Produkty genů pozdní odpovědi se účastní regulace buněčné proliferace. Patří mezi ně například hlavní složky řídícího systému buněčného cyklu – cykliny a cyklin-dependentní proteinkinasy.
Receptory s tyrosinfosfatasovou aktivitou
Specifická aktivita těchto enzymů zajišťuje, že fosforylace tyrosinů trvá velmi krátkou dobu, a že v klidových buňkách je tyrosinů fosforylováno jen malé množství. Příkladem receptoru s tyrosinfosfatasovou aktivitou je membránový glykoprotein CD45, který se nachází na povrchu bílých krvinek. Účastní se aktivace T a B lymfocytů po setkání s cizími antigeny.
Receptory s guanylátcyklasovou aktivitou
Jde například o receptor vázající atriální natriuretické peptidy (ANPs), což je skupina peptidových hormonů. Nacházejí se v buňkách ledvin a v buňkách hladké svaloviny krevních cév. Atriální natriuretické peptidy jsou secernovány svalovými buňkami srdeční předsíně při vzestupu krevního tlaku. Stimulují ledviny k exkreci Na+ a vody a navozují relaxaci svalových buněk ve stěnách krevních cév. Oba tyto účinky vedou ke snížení krevního tlaku.
Receptory mají extracelulární oblast pro vazbu ANPs a intracelulární guanylátcyklasovou katalytickou doménu. Vazba ligandu s receptorem aktivuje cyklasu k produkci cyklického 3‘,5‘-GMP (cGMP). cGMP se váže k cGMP-dependentní proteinkinase a tím ji aktivuje k fosforylaci serinů a threoninů specifických proteinů, které se podílejí na dalším přenosu signálu a realizaci konečného projevu.
Receptory s připojenou tyrosinkinasovou aktivitou
Liší se od receptorů s tyrosinkinasovou aktivitou tím, že tyrosinkinasa je v tomto případě kódována dalším samostatným genem (např. protoonkogenem src) a je nekovalentně připojena k cytoplasmatické části receptorového polypeptidického řetězce. Tyto receptory tvoří velkou heterogenní skupinu. Jsou to například receptory pro většinu cytokinů, které regulují proliferaci a diferenciaci buněk hemopoetického systému; antigen-specifické receptory na T a B lymfocytech; receptory hormonů (např. růstový hormon, prolaktin) a další.
Antigen je prezentován molekulami MHC a rozeznán receptory T lymfocytů (TCR); TCR je aktivován a předává signál prostřednictvím signálních molekul do jádra. Následně dochází k expresi cytokinů.
Sekretovaný cytokin se váže a aktivuje membránový receptor B lymfocytu s připojenou tyrosinkinasovou aktivitou. Tyrosinkinasa je kódována protoonkogenem src.
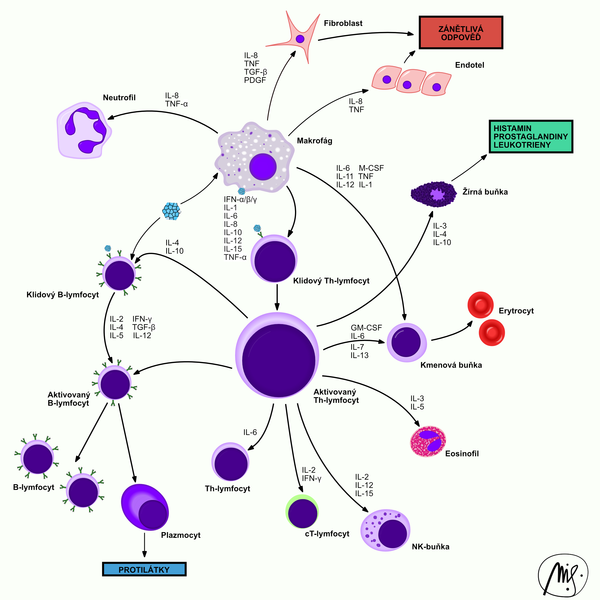
Receptory spojené s iontovými kanály (ionotropní receptory)
Některé receptorové proteiny regulují navázáním signální molekuly činnost iontových kanálů. Jejich otevírání a zavírání je vlastní signalizační odpovědí. Po navázání nervového mediátoru se změní konformace receptoru a iontový kanál se uzavře nebo naopak otevře pro specifické ionty, které se pohybují po svém elektrochemickém gradientu a dochází ke změně membránového potenciálu. Tento typ buněčné signalizace se vyskytuje v tzv. vzrušivých tkáních - nervové soustavě a svalech.
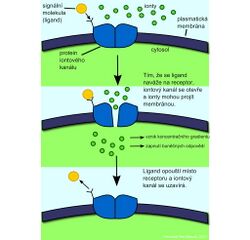
Receptory spojené s G-proteinem (GPCR = G-protein–coupled receptor)
Receptor je polypeptidový řetězec, který sedmkrát prochází membránou. V klidovém stavu se G-protein s receptorem pravděpodobně ani nedotýká. Je tvořen třemi podjednotkami α, β, γ. Na α podjednotce je v klidu navázán GDP. Po navázání ligandu se receptor spojí s G-proteinem a GDP je nahrazeno GTP. Ukončení signálu je doprovázeno hydrolýzou GTP zpět na GDP (α podjednotka má GTPázovou aktivitu). Cílem působení aktivovaného G-proteinu (jeho disociované α podjednotky nebo βγ komplexu) mohou být iontové kanály nebo enzymy v membráně. Nejčastěji je aktivována adenylátcykláza (tvorba cAMP) a fosfolipáza C (tvorba IP3 a DAG).
Obecné schéma signální dráhy
Hormon → membránový receptor → G-protein → adenylátcykláza → cAMP → proteinkináza A →
- fosforylace enzymů ovlivňujících metabolismus (rychlé účinky);
- fosforylace genových regulačních proteinů → ovlivnění transkripce genů (pomalé účinky).
Druzí poslové a jejich funkce
Druzí neboli sekundární poslové (anglicky second messengers) jsou malé, neproteinové, ve vodě rozpustné molekuly. Označují se druzí, protože první posel je signální molekula, která se váže na receptorový protein. Jsou součástí přenosu signálu v dráhách zahajovaných jak receptory spojenými s G-proteinem, tak enzymotropními receptory. Vznikají z lehce dosažitelných substrátů a mají krátký biologický poločas. Mezi druhé posly patří cAMP, kalciové kationty, cGMP, inositol-1,4,5-trisfosfát, diacylglycerol, fosfatidylinositol-3,4,5-trisfosfát a další. S výjimkou kalciových kationtů jsou druzí poslové syntetizováni specifickými enzymy po stimulaci membránových receptorů. Následně aktivují proteinkinázy, které fosforylují aminokyseliny serin nebo threonin v různých intracelulárních proteinech. Fosforylace mění aktivitu těchto proteinů ve smyslu aktivace nebo inhibice. Aktivita druhých poslů je omezená a jsou degradovány různými enzymy.
| Druhý posel | Substrát | Enzym | Efektor | Degradace |
|---|---|---|---|---|
| cAMP | ATP | adenylátcykláza (AC) | proteinkináza A (PKA) | fosfodiesterázy (PDE) |
| cGMP | GTP | guanylátcykláza (GC) | proteinkináza G (PKG) | fosfodiesterázy (PDE) |
| kalciové kationty (Ca2+) | – | uvolnění z ER po stimulaci IP3 | kalmodulin | zpětná resorpce do ER pomocí Ca2+ ATP-ázy |
| inositol-1,4,5-trisfosfát (IP3) | fosfatidylinositol-4,5-bisfosfát (PIP2) | fosfolipáza C (PLC) | proteinkináza C (PKC) | fosfatázy – defosforylace na inositol |
| diacylglycerol (DAG) | fosfatidylinositol-4,5-bisfosfát (PIP2) | fosfolipáza C (PLC) | proteinkináza C (PKC) | lipázy – vznik glycerolu a volných mastných kyselin |
| fosfatidylinositol-3,4,5-trisfosfát (PIP3) | fosfatidylinositol-4,5-bisfosfát (PIP2) | fosfatidylinositol-3-kináza (PI3K) | proteinkináza B (PKB) | fosfatáza PTEN – odštěpení fosfátu v poloze 3 |
Cyklický adenosinmonofosfát (cAMP)
Cyklický AMP je tvořen z ATP enzymem adenylátcyklázou, která je zakotvena v cytoplazmatické membráně a aktivuje se přes G-protein po vazbě signální molekuly na membránový receptor. cAMP pak přenáší signál z cytoplazmatické membrány k metabolickým pochodům v cytoplazmě. Přenosová molekula následující cAMP je obvykle proteinkináza A (cAMP-dependentní proteinkináza), která fosforyluje další proteiny. PKA-regulované proteiny se podílejí například na řízení metabolismu sacharidů a lipidů, transportu vody a iontů v ledvinách atd. cAMP nepřetrvává v buňce dlouho a je přeměněn fosfodiesterázou na AMP (adenosinmonofosfát).
Cyklický guanosinmonofosfát (cGMP)
Vzniká obdobně jako cAMP, tj. je tvořen enzymem guanylátcyklázou z GTP. Guanylátcyklázová aktivita je aktivována např. atriovým natriuretickým peptidem (ANP)[2]. cGMP aktivuje proteinkinázu G (cGMP-dependentní proteinkinázu), která fosforyluje cílové proteiny. Signální transdukci zahrnující cGMP využívají např. tyčinky v oční sítnici nebo buňky hladké svaloviny kavernózních těles penisu.
Druzí poslové odvození z fosfatidylinositol-4,5-bisfosfátu
Fosfatidylinositol-4,5-bisfosfát (PIP2, též PtdIns(4,5)P2) je fosfolipid nacházející se v cytoplazmatické membráně. Z fosfatidylinositol-4,5-bisfosfátu mohou být syntetizováni druzí poslové, kteří ovlivňují 2 odlišné proteinkinázy.
Fosfatidylinositol-3,4,5-trisfosfát
Fosfatidylinositol-3,4,5-trisfosfát (PIP3, též PtdIns(3,4,5)P3) je syntetizován fosforylací PIP2 enzymem fosfatidylinositol-3-kinasou (PI3K). Zůstává vázán ve vnitřním listu cytoplazmatické membrány a zde aktivuje fosfatidylinositol-dependentní kinasu 1 (PDK1), která fosforyluje (a tím aktivuje) proteinkinázu B. Proteinkináza B (PKB, též nazývaná AKT) fosforyluje proteiny regulující proliferaci, buněčný cyklus a apoptózu.
Diacylglycerol a inositol-1,4,5-trisfosfát
Signální molekula se naváže na receptor, a to vede k aktivaci enzymu fosfolipázy C, který štěpí fosfatidylinositol-4,5-bisfosfát na 1,2-diacylglycerol (DAG) a inositol-1,4,5-trisfosfát (IP3, též Ins(1,4,5)P3). Oba jsou druhými posly. IP3 difunduje cytosolem, naváže se na kalciový kanál v endoplazmatickém retikulu a tím ho otevírá. Kalciové kationty se uvolňují z endoplazmatického retikula a zvyšují hladinu Ca2+ v cytosolu. DAG zůstává zanořený v cytoplazmatické membráně. DAG a kalciové ionty společně aktivují proteinkinázu C, která následně fosforyluje proteiny asociované s cytoskeletem a tím ovlivňuje kontrakci, migraci a sekreci v buňkách.
Kalciové kationty
Ca2+ je častější sekundární posel než cAMP. Zvyšování koncentrace Ca2+ způsobuje kontrakci svalové buňky nebo sekreci určitých látek. Buňky stále obsahují určité množství Ca2+, ale extracelulární hladina je daleko vyšší než intracelulární. Intracelulární hladina se zvyšuje otevřením kalciových kanálů v endoplazmatickém retikulu, které je způsobené navázáním IP3 na tyto kanály. Kalciové kationty by se mohly považovat za třetí posly. Kalciové kationty aktivují další proteiny buď přímo nebo pomocí kalmodulinu, proteinu vázajícího Ca2+. Kalmodulin s navázanými kalciovými ionty aktivuje CaM-kinázy, které fosforylují další proteiny.
Odkazy
Související články
Reference
- ↑ BRUCE, Alberts, D BRAY a A JOHNSON, et al. Základy buněčné biologie. 1. vydání. Ústí nad Labem : Espero Publishing, 1998. 630 s. ISBN 80-902906-0-4.
- ↑ MATOUŠ, Bohuslav, et al. Základy lékařské chemie a biochemie. 1. vydání. Praha : Galén, 2010. 540 s. ISBN 978-80-7262-702-8.
Použitá literatura
- GOETZ, Petr, et al. Vybrané kapitoly z lékařské biologie, díl 2.. 1. vydání. Praha : Karolinum, 2002. ISBN 80-246-0320-9.
- BRUCE, Alberts, D BRAY a A JOHNSON, et al. Základy buněčné biologie. 1. vydání. Ústí nad Labem : Espero Publishing, 1998. 630 s. ISBN 80-902906-0-4.
- MATOUŠ, Bohuslav, et al. Základy lékařské chemie a biochemie. 1. vydání. Praha : Galén, 2010. 540 s. ISBN 978-80-7262-702-8.
- KOOLMAN, Jan a Klaus-Heinrich RÖHM. Barevný atlas biochemie. 1. vydání. Praha : Grada, 2012. 512 s. ISBN 978-80-247-2977-0.