Inzulin
| Inzulin | |
 | |
| Prekurzor | preproinzulin, proinzulin |
|---|---|
| Žláza | endokrinní pankreas |
| Struktura | heterodimer složený ze dvou řetězců (α a β, spojené disulfidovými můstky) |
| Cílový orgán/tkáň | kosterní svalovina, myokard, tuková tkáň, játra |
| Receptor | inzulinový receptor |
| Účinky | zvyšuje vstup glukózy do buněk a proteosyntézu, inhibuje uvolňování glukagonu a tvorbu MK; v játrech: glykogeneze, tvorba TAG, glykolýza, snížená tvorba glukózy a ketolátek; ve svalech: glykogeneze, glykolýza |
| OMIM | 176730 |
Inzulin patří mezi pankreatické hormony. Je produkovaný v specializovaných buňkách pankreatických ostrůvků – tzv. B-buňky. Jedná se o peptidový hormon, reguluje energetický metabolismus. Inzulin je nazýván také hormonem sytosti, nadbytku. Choroby nějakým způsobem spojené s inzulinem (problém v syntéze, problém s buňkami ostrůvků, poruchy receptorů a jejich signalizace) jsou v naší populaci poměrně rozšířené – i laik zná „cukrovku“, tedy diabetes mellitus (DM).
Stavba pankreatického ostrůvku
B-buňky (60 % z buněk ostrůvků) se nachází převážně v centru, A-buňky (25 %, produkují glukagon), naopak, nejprve na periferii. Arteriola přichází do centra, tam se větví a kapiláry směřují k okrajům myšlené deformované koule. Takto je možné, aby uvolněný inzulin působil na A-buňky, zatímco glukagon se většinou nestihne dostat k B-buňkám (poločas rozpadu 1–3 min, kromě toho je obvykle většina glukagonu vychytaná játry). Toto je dobré si uvědomit, když budeme hovořit o regulaci sekrece hormonů.
Historie
Inzulin izolovali již v roce 1921 pánové Banting a Best (jako tzv. „ostrůvkový faktor“) z pankreatické tkáně. Patří mu (mezi proteiny) mnohá prvenstva – byl to první protein, u kterého byl podán důkaz hormonální činnosti, první protein, který byl krystalizovaný a sekvenovaný, první uměle syntetizovaný v laboratoři. Na druhé straně – o jeho intracelulárním působení a různých molekulárních mechanizmech víme vcelku málo.
Struktura
Molekula inzulinu je heterodimer složený ze dvou řetězců (α a β, spojené disulfidovými můstky). V celé molekule jsou tři místa, ve kterých záměna aminokyseliny vyvolá neúčinnost – umístění disulfidových vazeb, hydrofóbní zbytky C-konce β-řetězce a hydrofóbní zbytky obou konců α-řetězce. (Substituce aminokyselin jsou jinak velmi časté, ale pokud k nim dochází mimo zmíněná tři místa, prakticky nemění biologickou účinnost.)
Syntéza
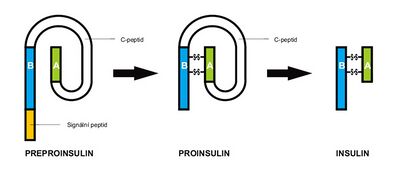
Syntéza inzulinu – tak jako každého proteinu – začíná v jádře transkripcí a pokračuje na ribozomech RER translací – vzniká preproinzulin. Od inzulinu se liší pre- sekvencí (hydrofóbní AMK, slouží jako usměrňovač, t.j. aby molekula cestovala do cisteren RER) a spojujícím C-peptidem (sekvence AMK, která spojuje N-konec α-řetězce a C-konec β-řetezce). Pre- sekvence je odstraněna v RER, vzniká proinzulin. Ten má vhodnou konformaci na to, aby se zoxidovaly -SH skupiny cysteinů a vznikly tak disulfidové můstky mezi α- a β-řetězcem. Následně je proinzulin transportovaný do GA, kde začíná proteolýza (odstranění C-peptidu). Inzulin, malé množství proinzulinu (poměr inzulin/proinzulin je 5:1), C-peptid a minoritní množství dalších látek jsou poté balené do sekrečních granul a po příslušném signálu fúzují s cytoplazmatickou membránou a uvolňují svůj obsah do ECT.
Sekrece inzulinu
Sekrece probíhá následujícím mechanismem:
- v případě nárůstu hladiny glukózy v plazmě (stav po jídle) – a tedy úměrně i v B-buňkách pankreatu – dojde ke změně membránového potenciálu (depolarizaci);
- depolarizace je způsobena nahromaděním ATP v B-buňkách, které vede k uzávěru ATP-dependentních-K+ kanálů, takže se draslík v buňce hromadí. ATP vzniká v dýchacím řetězci, Acetyl-CoA pro citrátový cyklus prochází z pyruvátdehydrogenázové reakce. Pyruvát vzniká aerobní glykolýzou;
- jelikož začíná metabolismus glukózy v B-buňkách glukokinázou (Km = 10 mmol/l, ten stejný enzym se nachází ještě v hepatocytech), je potřeba, aby hladina glukózy stoupla v plazmě na hodnotu cca 8–10 mmol/l. Tímto mechanismem je zajištěno, aby velké množství ATP vznikalo pouze při vysokých hladinách glukózy (transportér pro Glc SLC2A2 je aktivní při vyšších hladinách, normální hladina Glc je 3,6–5,5 mmol/l);
- v důsledku depolarizace se otevírají Ca2+ kanály, stoupne hladina vápníku v cytoplazmě B-buněk a dojde k fosforylaci cytoskeletu – sekreční granula splývají s membránou (Ca2+ je potřeba jako kofaktor pro kinázy);
- postprandiální sekrece probíhá ve dvou „fázích“ (resp. dva píky na křivce hladiny inzulinu v plazmě v závislosti na času) – ranná a pozdní fáze;
- na myších bylo pozorováno, že sekreci inzulinu zvyšuje také osteokalcin (glykoprotein produkovaný osteoblasty v kosti), stejně jako proliferaci B-buněk. V lidském těle zatím není jasné, co způsobuje komunikaci mezi kostmi a regulací energetického metabolismu. V současnosti je zřejmé, že inaktivace tzv. PTPRV genu (kóduje tyrozinfosfatázu přítomnou v kmenových buňkách, Sertoliho buňkách a osteoblastech) má pozitivní vliv na proliferaci B-buněk a sekreci inzulinu;
- na druhé straně je sekrece inzulinu inhibovaná somatostatinem;
- v klinice je důležité stanovení množství C-peptidu jako markeru endogenní produkce inzulinu. Využívá se k rozlišení cukrovky prvního a druhého typu, zejména u pacientů léčených exogenně podávaným inzulinem.
Mechanismus účinku
Inzulinový receptor
Na membráně cílových buněk je receptor – heterotetramer. Podjednotka α je uložena extracelulárně, váže hormon. Podjednotku β tvoří transmembránový protein a jeho intracelulární část vykazuje tyrozinkinázovou aktivitu. Podjednotky jsou kovalentně spojené disulfidovými vazbami v poměru α2-β2.
Převod signálu
V případě navázání inzulinu dojde k oligomerizaci, shluknou se dva (či více) receptorů k sobě, následně se změní konformace molekul – důsledkem je autofosforylace intracelulárních častí sousedních polovin receptorů. Syntéza receptoru a následná degradace probíhá s poločasem rozpadu do 12 hodin. K převodu signálu slouží adaptorové proteiny – v případě inzulinu IRS-1 (inzulin receptor substrate). O druhém poslovi inzulinu se vedou spory. Celá kaskáda končí fosforylací/defosforylací cílových proteinů, popř. způsobuje vystavení transportních proteinů nebo působí na DNA (viz další odstavec). Dochází taktéž k internalizaci („pohlcení“) komplexu hormon-receptor.
Degradace
Inzulin je degradovaný (zejména v játrech, z části v ledvinách a placentě) enzymem inzulinázou, popř. glutathion-inzulin-transhydrogenázou (játra), receptor je znovu vystavený na membráně.
Down-regulation
V případě, že je koncentrace inzulinu vysoká, klesá citlivost tkání na inzulin (tzv. „down-regulation“ – snížení počtu receptorů na membránách). To se podílí na vzniku inzulinové rezistence u DM II.
Působení inzulinu
Inzulin zvyšuje transport glukózy z krve do buněk kosterní svaloviny, myokardu a tukové tkáně. Děje se tak díky tomu, že hormon způsobí vystavení glukózových transportérů GLUT4 (ty byly zatím připravené v pohotovosti v ICT) na membráně. Děje se tak zejména v buňkách kosterní svaloviny, kardiomyocytech a adipocytech. Různými metodami (subcelulární frakcionace, elektronová a fluorescenční mikroskopie) bylo prokázáno, že v nepřítomnosti inzulinu je v těchto tkáních většina (cca 95 %) množství GLUT4 umístěna intracelulárně.
Jelikož se inzulin vyplavuje po jídle – za hladovění (nebo několik hodin po jídle) klesá jeho hladina – glukóza je během většiny dne (člověk je všeobecně připravený spíše na přežívání nedostatku než nadbytku…) šetřena pro mozek právě díky tomu, že se do svalů a do tuku nedostane, resp. dostane v malém množství (chybí GLUT4 na membráně, protože chybí inzulin).
Účinky na energetický metabolismus
Jsou odvozeny od stavu, ve kterém se člověk nachází po jídle. Tělo dostalo dávku glukózy, kterou je potřeba zpracovat. Proto bude aktivní glykolýza, glykogeneze, lipogeneze a ukládání lipidů v adipocytech. Samozřejmě, pokud je třeba, glukóza se ihned spotřebuje (např. pracujícím svalem, mozek žije téměř pouze z glukózy…). Inzulin snižuje množství cAMP, resp. inhibuje přeměnu neaktivní adenylátcyklázy na aktivní. Díky tomu:
- nevznikne proteinkináza A (zůstane v inaktivním stavu jako PKB), která by přeměnila aktivní glykogensyntázu na inaktivní glykogensyntázu;
- zůstane inaktivní fosforyláza, která je řídícím enzymem glykogenolýzy;
- na lipogenezi působí aktivací acetyl-CoA-karboxylázy a zároveň nízkou hladinou cAMP inhibuje lipolýzu.
Působením na DNA indukuje inzulin biosyntézu enzymového komplexu syntázy mastných kyselin a snižuje syntézu fosfoenolpyruvátkarboxykinázy (regulační enzym glukoneogeneze). V játrech inhibuje ketogenezi, způsobuje růst buněk.
Je dobré si uvědomit, že na metabolismus jako takový musíme nahlížet jako na velký celek. Jak ovlivníme metabolickou dráhu v nějaké buňce, v jiných buňkách to nezůstane bez odezvy. Proto na jedné straně vidíme přímé působení inzulinu (jednoduše navázáním se na receptor v membráně), na druhé straně nenápadné nepřímé zásahy do děje (např. blokáda lipolýzy v adipocytech způsobí v játrech nedostatek FFA, proto budou játra zpracovávat zejména glukózu).
Kromě toho má inzulin pozitivní vliv na růst a replikaci buněk, na hojení ran (poznámka: v kulturách fibroblastů způsobuje inzulin schopnost růstových faktorů (FGF, PDGF, EGF…) stimulovat buněčný cyklus).
Fetální období
Inzulin se začíná tvořit v 10. týdnu a působí také na fetální organogenezi (placenta je pro inzulin nepropustná, proto se tam mateřský inzulin nedostane).
Inzulin v terapii
Odkazy
Související články
- Inzulinoterapie
- Hormony lidského těla: ADH • Estrogeny • Erytropoetin • Gestageny • Glukagón • Glukokortikoidy • Choriový gonadotropin • Inzulin • Katecholaminy • Kalcitonin • Noradrenalin • Parathormon • Prostaglandiny • Renin-angiotenzin-aldosteronový systém • Růstový hormon • Testosteron
- C-peptid
- Diabetes mellitus
- Hepatogenní diabetes a metabolizmus sacharidů
Externí odkazy
Použitá literatura
- DUŠKA, František. Biochemie v souvislostech, 1.díl – základy energetického metabolizmu. 1. vydání. Praha : Karolinum, 2006. ISBN 80-246-1116-3.
- MURRAY, Robert K.. Harperova biochemie. 2. vydání. Jinočany : H&H, 1998. ISBN 80-7319-013-3.
- MOORE, Keith L. a PERSAUD. Zrození člověka: embryologie s klinickým zaměřením. 1. vydání. Praha : ISV, 2002. 564 s. ISBN 80-85866-94-3.
- GUYTON, Arthur C. a John E. HALL. Textbook of medical physiology. 11. vydání. Philadelphia : Elsevier Saunders, 2006. 1116 s. ISBN 0-8089-2317-X.
- LENEY, Sophie E. a Jeremy M. TAVARÉ. The molecular basis of insulin-stimulated glucose uptake: signalling, trafficking and potential drug targets. Journal of Endocrinology. 2009, vol. 72, no. 203, s. 1-2, ISSN 1479-6805.