Poruchy cyklu močoviny
(přesměrováno z Vrozené poruchy metabolismu močoviny)
Poruchy cyklu močoviny (malého Krebsova cyklu, ornithinového, ureosyntetického cyklu) tvoří skupinu enzymatických poruch, jejichž důsledkem je nahromadění dusíku ve formě amoniaku, který je pro organismus velice toxický a způsobuje ireverzibilní poškození mozku.
Klinická manifestace těchto nemocí bývá již první dny života. Hyperamonémie způsobuje křeče, zvracení a kóma. U starších dětí se tyto poruchy projevují nejčastěji psychomotorickou retardací, neprospíváním, zvracením, poruchami chování, opakovanými mozečkovými ataxiemi a bolestmi hlavy.
U každého pacienta s neurologickými symptomy neznámého původu je nezbytné monitorovat hladinu amoniaku v krvi. Četnost poruch cyklu močoviny je přibližně 1:30 000.[1][2]
Patogeneze[upravit | editovat zdroj]
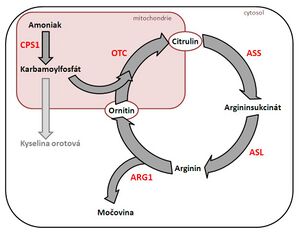
Cyklus močoviny slouží k vylučování nadbytečného dusíku (amoniaku) ve formě močoviny. Močovina je totiž netoxická, dobře rozpustná ve vodě a difuzibilní. Močovina představuje hlavní organickou složku moči.
Pokud je kvůli enzymatickému defektu porušen cyklus močoviny, dochází k rozvoji hyperamonémie, hromadění aminokyselin před enzymatickým blokem a naopak ke snížení koncentrace aminokyselin za enzymatickým blokem.
Obvykle bývá také zvýšená hladina glutaminu v plazmě. To vzhledem k tomu, že je v tomto případě využívána alternativní cesta přeměny amoniaku, který se za pomoci glutaminsynthetasy a substrátu glutamátu přeměňuje na glutamin. Zvýšený obsah glutaminu v astrocytech vede osmotickým efektem k jejich bobtnání a k edému mozku.
Při hromadění karbamoylfosfátu se tvoří orotová kyselina, která je důležitým diagnostickým markerem. Je zvýšena při poruchách všech enzymů kromě CPS1, kdy se ani karbamoylfosfát nevytvoří, proto není konverze možná.[2]
Rozdělení[upravit | editovat zdroj]
Zahrnuje 5 dědičně podmíněných poruch:
| poškozený enzym | umístění | typ dědičnosti | incidence | OMIM | odkazy | |
|---|---|---|---|---|---|---|
| Hyperamonémie I | karbamoylfosfátsyntetáza (CPS1) | mitochondrie | AR dědičná | vzácná (asi 24 případů) | #237300 | [1] |
| Hyperamonémie II | ornitinkarbamoyltransferáza (OTC) | mitochondrie | X vázaná, projevy mohou být i u heterozygotních dívek | #311250 | [2] | |
| Citrulinémie | argininsukcinátsyntetáza (ASS) | cytosol | AR dědičná | 1:70 000–1:100 000 | #215700 | [3] |
| Argininsukcináturie | argininsukcinát lyáza (ASL) | cytosol | AR dědičná | 1:70 000–1:100 000 | #207900 | [4] |
| Argininémie | argináza (ARG1) | cytosol | AR dědičná | vzácná (50 případů) | #207800 | [5] |
Klinický obraz[upravit | editovat zdroj]

Poruchy cyklu močoviny se obvykle vyskytují ve 2 formách – časné a pozdní.
Časné formy se projevují krátce po narození hyperamonemickým komatem, metabolickou acidózou, jaterním selháním, křečemi a edémem mozku.
Pozdní formy se projevují nechutenstvím, zvracením, neprospíváním, hypotonií a poruchami psychomotorického vývoje.
Hyperamonémie (typ I)[upravit | editovat zdroj]
Jedná se o defekt karbamoylfosfátsynthetázy, který se vyskytuje ve dvou formách: těžké (letální neonatální) a mírnější s pozdějším nástupem.
Letální neonatální forma se projevuje těžkým poškozením mozku, hyperamonemickým kómatem a ketoacidózou. U mírnější formy může nastat hyperamonemické kóma, Reye-like syndrom, zvracení, hypotonie, neprospívání a psychomotorická retardace[3].
Při rozboru laboratorního vyšetření nacházíme nízké koncentrace argininu a citrulinu a vysoké koncetrace glutaminu. Naopak uracil a kyselina orotová jsou v normě.
Citrulinémie (typ I)[upravit | editovat zdroj]
Jedná se o defekt argininosukcinátsyntházy vyskytující se ve dvou formách. První je neonatální, projevující se hyperamonemickým kómatem a laktátovou acidózou. Druhá forma je chronická juvenilní, jejíž příznaky jsou nechutenství, zvracení, hypotonie, růstová a psychomotorická retardace a křeče.
Rozlišujeme ještě dva typy citrulinémie. Typ II je charakteristický deficitem mitochondriálního přenašeče aspartátu a glutamátu (citrinu), z toho vyplývá intramitochondriální deficit aspartátu. U typu III je typický částečný deficit argininsukcinátsyntetázy s vysokou reziduální aktivitou enzymu [4]
Laboratorně nacházíme nízké koncentrace argininu, ale vysoké koncetrace citrulinu i glutaminu, uracil a kyselina orotová jsou zvýšené.
Argininsukcináturie[upravit | editovat zdroj]
Jedná se o defekt argininsukcinát lyázy, který se vyskytuje ve dvou formách, a to časné a pozdní. Časná forma se projevuje těžkým hyperamonemickým kómatem krátce po narození a je často fatální. U pozdní formy můžeme během dětství pozorovat hypotonii, neprospívání, nechutenství, chronické zvracení a poruchy chování. Další projevy mohou být hepatomegalie a lomivost vlasů (trichorrhexis nodosa)[5].
Laboratorně nacházíme nízkou koncetraci argininu a zvýšené koncetrace glutaminu a citrulinu, v moči prokážeme zvýšení koncentrace kyseliny orotové a uracilu.
Argininémie[upravit | editovat zdroj]
Jedná se o defekt arginázy I, mezi jehož příznaky patří spastická diplegie, epilepsie, psychomotorická retardace, hyperaktivita, iritabilita, neutišitelný pláč, anorexie, zvracení a zřídka se vyskytující symptomatická hyperamonémie přecházející do kómatu.
Laboratorně prokážeme hyperargininemii a zvýšené vylučování kyseliny orotové močí.edoucím příznakem je hyperamonemie.
Pokud se podíváme na ABR, nalézáme nejprve respirační alkalózu a později metabolickou acidózu.
Dalším důležitým ukazatelem jsou aminokyseliny v plazmě (chromatografie), kdy ve výsledcích nalézáme zvýšenou koncentraci glutaminu a kyseliny glutamové a málo argininu (až na argininaemii), dále zvýšenou koncentraci aminokyseliny před enzymatickým defektem a snížené koncentrace aminokyselin za defektem (např. málo citrulinu a hodně orotátu → OTC - stejně jako u každého enzymatického bloku).
Orotová kyselina v moči je zvýšena při poruchách všech enzymů kromě CPS1.
Provádíme stanovení enzymatické aktivity z jaterní tkáně a analýzu mutací[2].
Diferenciální diagnostika hyperamonémie[upravit | editovat zdroj]
Poruchy můžeme rozlišit na vrozené a získané.
Mezi vrozené defekty patří poruchy cyklu močoviny, organické acidurie, poruchy transportu nebo oxidace mastných kyselin, hyperinzulinizmus a hyperamonemický syndrom.
Do získaných řadíme Reyův syndrom, jaterní selhání jiné etiologie, tranzitorní hyperamonémie novorozence (je hlavně u NNPH). Léčba je uskutečňována za pomoci valproátu em[2].
Terapie[upravit | editovat zdroj]
První pomoc spočívá v přeměně katabolismu na anabolismus (i.v. vysoké dávky glukózy s inzulinem, vysokokalorická parenterální výživa) a detoxikaci. Benzoát sodný aktivuje alternativní cesty vylučování dusíku. Fenylbutyrát, který se metabolizuje na fenylacetát, se postará o vázání glutaminu a umožňuje jeho vylučování ledvinami. Při poruše vědomí je třeba ke snížení amoniaku použít eliminační metodu (hemodialýza, hemodiafiltrace). Dále substituujeme aminokyseliny (obvykle arginin a citrulin - platí jen ve vybraných defektech).
Celoživotně musí být snížen příjem bílkovin na 0–1,2 g/kg/den a zároveň musí dojít k jejich substituci za pomoci směsí esenciálních AMK. Při těžkém metabolickém postižení je nutná transplantace jater[2].
Prognóza[upravit | editovat zdroj]
Při včasné terapii (kromě těžkých forem OTC) může být dobrá, při rozvoji těžkého hyperamonického komatu (většinou nad 300 μmol/l amoniaku při normě kolem 50 až 70 μmol/l) v novorozeneckém věku je vysoké riziko postižení[2].