Retroviry
(přesměrováno z Retroviry:HIV a HTLV-1)
Retroviry patří do skupiny neobvyklých virů. Jsou obalené fosfolipidovou membránou, mají onkogenní potenciál, vyvolávají neblahá, často fatální onemocnění a mohou reprogramovat buněčnou DNA. V nukleokapsidě nesou dvě identické molekuly ssRNA(+) a enzym reverzní transkriptázu, která přepisuje genom retroviru nejdříve do ssDNA(−). Vzniklý RNA-DNA hybrid je štěpen RNázou H a zbylé fragmenty RNA slouží jako primery pro syntézu druhého vlákna DNA. Takto vzniklá dvouřetězcová cDNA je pomocí virové integrázy po vstupu do jádra integrována do buněčné DNA ve formě proviru. Provirus má na obou svých koncích dlouhé koncové repetice, které jsou silnými promotory a obsahují také polyadenylační signál. Integrace proviru do hostitelského genomu nejen zajišťuje expresi virových mRNA, ale také ovlivňuje expresi okolních genů, což může vyvolat rakovinné bujení.
Klasifikace[upravit | editovat zdroj]
Retroviry jsou klasifikovány do tří podčeledí: Oncovirinae, Lentivirinae a Spumavirinae nebo do dvou podčeledí: Spumaretrovirinae a Orthoretrovirinae a to podle morfologických rozdílů, exprese genů a zpracování virových genů.
Do Orthoretrovirinae patří všechny onkogenní retroviry a na základě jejich morfologických rysů a složitosti genomu jsou dále roztříděny do sedmi skupin:
- jednoduché − alfa-, beta- a gammaretroviry;
- složité − delta-, epsilon-, lentiviry a spumaviry.
Hlavním rozdílem mezi nimi je to, že složité retroviry mají ve svém genomu navíc geny pro nestrukturní proteiny, které usnadňují replikaci viru nebo neutralizují nespecifickou a specifickou imunitu v průběhu infekce.
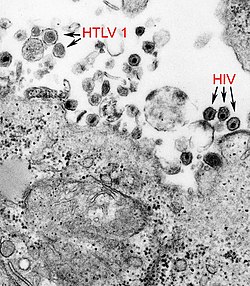
HTLV-1[upravit | editovat zdroj]
Jedním ze složitých retrovirů je HTLV-1, který patří mezi deltaretroviry. Kromě obvyklých strukturních genů (gag, pol a env) má ve svém genomu i několik otevřených čtecích rámců v pX oblasti na 3´ konci. V této oblasti jsou zakodóvány regulující proteiny (např. Tax – silný enhancer exprese virových genů a maligní transformace) a 3 přídatné proteiny (p12, p13 a p30 – důležité pro virovou infekčnost). Maligní transformace je způsobena nepřetržitou stimulací proliferace nakažených buněk a buněčnou nesmrtelností in vitro.
HIV[upravit | editovat zdroj]
Nejsložitějším retrovirem je HIV, jehož genom má devět genů. Patří mezi lentiviry. Produkty nestrukturních genů, regulační proteiny, jsou zapojeny do transaktivace exprese virové mRNA, regulují sestřih virové pre-mRNA a potlačují imunitní reakci. Strukturní geny kódují kapsidový polyprotein Gag, reverzní transkriptázu Pol a obalový glykoprotein Env. Env (respektive jeho povrchová podjednotka gp120) rozpoznává buněčný receptor CD4 a koreceptor CCR5, po interakci s nimi dochází ke změně konformace Env, splynutí virové a buněčné membrány a vstupu virionu do cytoplazmy buňky.
HIV, HTLV-1 a hematoencefalická bariéra[upravit | editovat zdroj]
HIV (lentivirinae) je příčinou AIDS a HTLV-1 (onkovirinae) je vyvolavatelem ATL (adult T-cell leukemia), což jsou velice těžká a komplexní onemocnění. Zároveň musíme podotknout, že různé neuropatologické změny probíhají i na úrovni hematoencefalické bariéry.
HAM/TSP[upravit | editovat zdroj]
Mezi ně patří i HAM/TSP (HTLV-1 associated myelopathy/tropical spastic paraparesis). To je vzacné (vzniká u méně než 3 % nakažených osob HTLV-1 virem) pomalu progredující neurologické onemocnění, pro které jsou charakteristické depozita imunoglobulinu a fibrinogenu v mozkovém parenchymu a přechod infikovaných lymfocytů přes hematoencefalickou bariéru. V jednom výzkumu s lidskými mozkovými endoteliálními buňkami bylo demonstrováno, že infikované lymfocyty jsou schopné změnit strukturu tight junctions, zvýšit paracelulární permeabilitu a transcelulární migraci. Toto je dosažitelné sekrecí IL-1alfa a TNF-alfa. Kromě toho cerebrální endoteliální buňky mohou být infikovány HTLV-1 virem, což je potvrzeno pitvou míchy od HAM/TSP pacientů, a to je dalším mechanizmem změn hematoencefalické bariéry (taková infekce je in vitro proliferativní) a vchodu virů do CNS.
Mechanismy HAD a HIVE[upravit | editovat zdroj]
V průběhu infekce HIV virem jsou také přítomné neuropatologické změny hematoencefalické bariéry. I když infekce endoteliálních buněk HIV virem je důvodem pro další výzkumy, existuje domněnka, že takové infekce mohou mít škodlivý účinek na funkčnost této bariéry tím, že tyto infikované buňky mohou vylučovat metaloproteázy, cytokiny a virový protein Tat, nebo přejít do apoptózy.
Virový protein Tat, který je vylučován infikovanými buňkami (nejen endoteliálními), je schopen projít buněčnou membránu a je detekovatelný v séru a mozkomíšním moku infikovaných HIV pacientů. Jeho nežádoucí účinek je zprostředkován aktivací extracelulární signál-regulující kinázy ½(ERK1/2 dráha). Rezultující zvýšený oxidační stres může způsobit zvýšení intracelulární koncentrace kalcia, což způsobuje dysfunkci mitochondrií a následnou apoptózu endoteliálních buněk. Apoptóza endoteliálních buněk byla pozorována u některých pacientů AIDS. Kromě toho, že glykoprotein gp120 je nástrojem adsorpce virionů na buněčné receptory, také indukuje vylučování metaloproteázy-2, oxidační stres a degradaci ZO-1 a occludinu spolu se změnami exprese claudinů. Takovým způsobem je funkce hematoencefalické bariéra zhoršena a infiltrace infikovanými monocyty zvýšena.
Během asymptomatické fáze HIV infekce je přítomna chronická aktivace imunitního systému doprovázená dysregulací sekrece cytokinů. V této fázi HIV může být detekován v mozkomíšním moku. Sem se dostane migrací aktivovaných a infikovaných CD4+ T-buněk, monocytů nebo dendritických buněk z periferie. Až se dostanou do CNS, začne replikace virů doprovázená masivní sekrecí cytokinů a chemokinů v CNS. Funkce cerebrálních endoteliálních buněk je velice narušená kvůli této chronické aktivaci a to se projeví zvýšenou expresí buněčných adhezivních markerů jako ICAM-1 (intercellular adhesion molecule-1), sekrecí metaloproteáz, které indukují ztenčení lamina basalis. To všechno usnadňuje extravazaci mononukleárních buněk do CNS.
Neurologické symptomy spojené s HIV infekcí jsou HAD (HIV-associated dementia) a HIVE (HIV-encephalitis). Tyto symptomy se mohou vyskytovat i bez přítomnosti oportunistických infekcí. Typické pro ně jsou kognitivní a motorické poruchy: slabost svalů končetin, poruchy paměti, deprese a demence.
Odkazy[upravit | editovat zdroj]
Související články[upravit | editovat zdroj]
Externí odkazy[upravit | editovat zdroj]
Použitá literatura[upravit | editovat zdroj]
- BEDNÁŘ, M. a V. FRANKOVÁ, et al. Lékařská Mikrobiologie. 1. vydání. Praha : Marvil, 1996. ISBN 8023802976.
- TALARO, K. a A. TALARO. Foundations in Microbiology. 2. vydání. USA : WCB McGraw-Hill, 1996. ISBN 0-697-16054-8.
- US National Library of Medicine. HTLV-1 and Innate Immunity [online]. ©2011. [cit. 2013]. <https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3185810/>.
- US National Library of Medicine. Blood-brain barrier and retroviral infections [online]. ©2012. [cit. 2013]. <https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3396701/>.
- US National Library of Medicine. Cell Surface Markers in HTLV-1 Pathogenesis [online]. ©2011. [cit. 2013]. <https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3185802/>.
- THE JOURNAL OF INFECTION IN DEVELOPING COUNTRIES. Tumorigenesis related to retroviral infections [online]. ©2011. [cit. 2013]. <https://jidc.org/index.php/journal/article/view/22112727/622>.