Maligní nádory skeletu
Maligní nádory skeletu jsou nádory s tendencí k metastazování + lokální destrukci kosti.
- podle věku: Ewingův sarkom (10–20 let), osteosarkom (15–25 let), maligní fibrózní histiocytom (20–30 let), chondrosarkom (nad 50 let), kostní metastázy (nad 40 let)
- léčba obecně: biopsie → CHT (Ewing + RT) → široká resekce/amputace → adjuvantní CHT
Osteosarkom
Osteosarkom je maligní nádor patřící mezi primární kostní nádory (2. nejčastější primární maligní nádor kosti po vyloučení mnohočetného myelomu). Nejčastěji postihuje dlouhé kosti dolní končetiny v blízkosti kolenního kloubu. Osteosarkom roste v kosti, kterou destruuje a dostává se do měkkých tkání v okolí kosti. Záhy také metastazuje a to především hematogenně do plic, do dalších kostí a do mozku. Patří mezi nejčastější maligní kostní nádory, spolu s chondrosarkomem. Maximum výskytu je mezi 10. a 20. rokem života. Každým rokem je osteosarkom diagnostikován u 4 dětí z jednoho miliónu.[1]
Klasifikace
- Centrální (dřeňový, konvenční) osteosarkom: je vysoce maligní nádor (nejčastější maligní nádor kostí), vyskytuje se u jedinců do 20 let (v této věkové skupině je jedním z nejčastějších nádorů) nebo u starších jedinců na podkladě Pagetovy choroby, fibrosní dysplasie a podobných patologických kostních procesů, může postihnout kteroukoli kost (častěji femur, tibii, humerus, na přechodu diafýzy v metafýzu). Brzy metastázuje (hlavně do plic, mozku, jiných kostí). Klinicky se projevuje trvalou tupou bolestí, mírným zduřením kosti a mírnou horečkou. Nádor začíná růst ve dřeni metafýzy, infiltruje kortex až pod periost a pak může prorůstat až do přilehlých měkkých tkání. Mikroskopicky je patrná tvorba osteoidu (nemineralizované základní hmoty) nádorovými buňkami (nádor vychází z osteoblastů), v různém poměru jsou zastoupeny kostní, chrupavčitá a vazivová tkáň (popř. se širokými cévními prostory – teleangiektatický osteosarkom – nejzhoubnější forma osteosarkomu), podle toho, který typ tkáně převažuje, dělí se osteosarkomy na:
- fibroplastický – vřetnobuněčné vazivo;
- chondroplastický – nádorová chrupavčitá tkáň s atypickými vřetenobuněčnými elementy;
- osteoplastický – ostrůvky nebo trámečky osteoidu (může být mineralisován), nádorové osteoblasty mají atypická nebo polymorfní jádra (jediný znak toho, že jde o nádorový proces).
- Periferní (povrchový) osteosarkom: tvoří bolestivou protuberanci na povrchu kosti. Na RTG je patrná sekundární periostální osifikace. Zahrnuje např. parosteální (juxtakortikální) osteosarkom s velmi dobrou prognózou, osteosarkom o vysokém stupni malignity a periostální osteosarkom.[2]
Klinický obraz
- bolest v postižené kosti, typicky klidová a noční (tj. bez vazby na zátěž),
- s růstem nádoru se objevuje tuhé zduření, které nemusí být na pohmat bolestivé (typicky kolem kolenního kloubu),
- v pokročilém stadiu patologická zlomenina příslušné kosti,
- nespecifické celkové příznaky – noční pocení, teplota, úbytek na váze,
- kašel a obtížné dýchání – plicní metastázy[1].
Diagnostika
- biochemickým markerem kostních nádorů jsou zvýšené hladiny fosfatáz[2],
- prostý rtg snímek (typicky okrsky osteolýzy i novotvořené kosti, rozrušuje kortikalis, neohraničený, má periostální reakci, Codmanův trojúhelník = prostor ohraničený nadzvednutým periostem, povrchem kosti a nádorem), NMR,
- definitivní diagnóza histologicky (sarkomové stroma, tvorba osteoidu nádorovými osteoblasty),
- CT plic a scintigrafické vyšetření skeletu – metastázy[1].
Léčba
- chemoterapie (adriamycin, vysokodávkovaný MTX, leukovorin, cisPt, BCD, ifosfamid),
- radikální chirurgické odstranění nádoru (amputace nebo limb saving surgery),
- osteosarkomy jsou obecně málo citlivé k radioterapii[1].
Prognóza
Pacienti s radikálně operovaným nádorem a dobrou odpovědí na chemoterapii mají až 80% šanci na vyléčení.[1].
Ewingův sarkom
Ewingův sarkom (EWS) patří mezi sarkomy Ewingovy skupiny: EWS, PNET (primitivní neuroektodermální tumor), Askinův tumor (Ewing na hrudní stěně).
Jedná se o 2. nejčastější maligní kostní nádor u dětí a adolescentů, nejvyšší výskyt v období 5–30 let. Časně metastazuje do plic.
Nejčastěji se vyvíjí v kostní dřeni diafýzy dlouhých kostí (hl. femur, tibie). Často imituje akutní osteomyelitidu, subfebrilií, leukocytózou, zvýšenou sedimentací, bolestivostí, vč. pozitivity scintigrafie.
Klinický obraz: bolest, otok, patologická zlomenina.
Rentgenový obraz: osteolytické změny s permeativní destrukcí kosti + periostální reakcí.
Terapie: 1. neoadjuvantní CHT VIDE (vinCRISTine, iFOSFamide, DOXOrubicin, etoposide), 2. radikální chirurgická resekce, 3. intraoperační/následná RT, 4. adjuvantní CHT.
Prognóza: 5leté přežití 60–76% (bez metastáz).
Chondrosarkom
Chondrosarkom je jeden z nejčastějších maligních nádorů kosti, jde o nádor dospělého věku.
- V metafýze proximální části humeru, femuru, tibie, i jinde.
- Vzniká primárně, nebo malignizací enchondromu, exostózy.
- Typicky: muž 40–70 let, stěžuje si na bolesti gluteální krajiny, oblasti kyčelního kloubu nebo na bolesti stejnostranného stehna/kolene, na postiženou končetinu napadá, bolesti se postupně zhoršují a neustupují v klidu.
- Rentgenový obraz: nitrokostní osteolytická léze s ostrůvky kalcifikací.
- Histologický obraz: lobulárně uspořádané masy chrupavčité tkáně s buněčnými atypiemi.
- Terapie: jedinou léčbou chirurgické odstranění nádoru: široká/radikální resekce nádoru, ev. metastasektomie při solitárním postižení plic.
Mnohočetný myelom
Plazmocelulární myelom, neboli plazmocytom, je maligní nádorové onemocnění vycházející z plazmatických buněk. Obvykle se nachází v kostní dřeni, kde destruuje kost a může způsobovat patologické fraktury. Pokud je ložisek více, nazýváme jej mnohočetný myelom (Kahlerova nemoc). Nádorové buňky produkují bílkovinné řetězce – paraprotein. Vzácně existují však i nesekreční myelomy, u kterých nelze paraprotein v séru prokázat.
Patologie
Makroskopie
Myelom má podobu tmavě červených osteolytických ložisek v kostní dřeni (kalva, obratle, pánev, diafýzy humeru, femuru).
Komplikace
- Patologické fraktury (v případě obratlů hrozí míšní léze).
- AL amyloidóza.
- Myokard – poruchy rytmu, srdeční selhání.
- Tlusté střevo – malabsorbce.
- Ledviny – renální selhání (proteinurie, periorbitální otoky, uremie).
- Játra, cévy, uzliny…
- Jazyk – makroglosie.
- Myelomová ledvina – ucpání tubulů bílkovinnými řetězci – Bence Jonesova bílkovina.
Pacienta ohrožuje na životě
- Selhání orgánu postiženého amyloidózou,
- bronchopneumonie – rozvíjí se po fraktuře obratle a míšní lézi,
- infekce při generalizaci nádoru v kostní dřeni (stejné jako u leukemie).
Klinická část
Epidemiologie
Toto onemocnění postihuje častěji muže než ženy (v poměru 1,5:1). Incidence stoupá od 50. roku života, věkový medián je 70 let. Incidence v ČR je 3-4:100 000 obyvatel/rok. Etiologie onemocnění není známa.[3] V dětství se téměř nevyskytuje, u mladých velmi vzácně.
Klinický obraz
Počáteční období může být zcela asymptomatické (u indolentních lymfomů), u >70 % nemocných ovšem dominuje bolest v zádech, žebrech. Bolest je vázána na fyzickou aktivitu.
Klinický obraz je tvořen souborem příznaků skrývajících se pod zkratkou CRAB:
- Calcium – hyperkalcemie, která souvisí s odbouráváním kostní hmoty. Hyperkalcemie způsobuje také deprese, letargii a slabost.
- Renal failure – selhání ledvin v důsledku tubulopatie, méně častý projev myelomu,
- Anemia – normocytární normochromní anémie je nejčastějším příznakem, je spojena s hubnutím, únavou, dušností a bledostí
- Bone – postižení kostí – velmi časté, nádorové buňky v kostní dřeni produkují osteoklasty aktivující faktory, což vede k osteolýze kostí a vzniku patologických fraktur, které se vyskytují až u 70 % pacientů.
Ke klinickému obrazu příspívají i náchylnost k infekcím, projevy hyperviskózního syndromu (bolest hlavy, poruchy visu) a palpovatelné infiltráty nad osteolytickými ložisky (zvláště na lebce).
Vyšetřovací metody
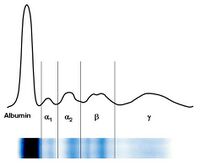
- stanovení paraproteinu v krvi – elektroforéza plazmatických bílkovin (viz obrázek), koncentrace paraproteinu v séru je obvykle > 30 g/l,
- stanovení volných řetězců (FLC) – nejcitlivější metoda, odhalí i nesekretorický myelom, kdy stanovení paraproteinu by vyšlo negativně, normální poměr lehkých řetězců kappa:lambda je 2:1, v případě myelomu je to například 350:1,
- RDG – neslouží k primární diagnóze, po jejím stanovení se sledují ložiska k předvídání patologických zlomenin a k posouzení odpovědi na léčbu. Postižena je často lebka, páteř, ale myelom může být prakticky v kterékoli kosti. Používaný rentgenový screening dnes pomalu nahrazuje celotělové LDCT, v některých pracovištích MRI, aktivitu kostních lézí nejlépe zhodnotí metody nukleární medicíny,
- stanovení Bence Jonesovy bílkoviny v moči,
- vyšetření kostní dřeně – počet plazmocytů obvykle převyšuje 10 % ze všech jaderných buněk ve dřeni, dále imunohistochemické a cytogenetické vyšetření (výskyt delecí, trizomií, které mají prognostický význam),
- cytogenetické vyšetření - početní a strukturální změny chromosomů, důležité pro prognózu
- laboratorní vyšetření,
- normocytární normochromní anémie, mírná leukopenie a trombocytopenie
- často zvýšená sedimentace,
- hyperkalcemie,
- renální funkce – zvýšená urea a kreatinin,
- vyšetření LD, thymidinkinázy a beta2-mikroglobulinu, hyperurikémie – jejich zvýšené hodnoty mají negativní prognostický význam.
Klinická stádia a varianty
Klinická stádia
Klasifikace dle Durieho a Salmona[4]:
- klinické stádium I – koncentrace paraproteinu IgG < 50 g/l, nebo IgA < 30 g/l, proteinurie < 4 g/24 hodin, bez osteolytických změn bez hyperkalcemie,
- klinické stádium II – hodnoty jsou mezi stadii I a III,
- klinické stádium III – koncentrace paraproteinu IgG > 70 g/l, nebo IgA >50 g/l, proteinurie > 12 g/24 hodin, mnohočetné ložiska v kostech, hyperkalcemie > 2,75 mmol/l, koncentrace hemoglobinu < 85 g/l,
- subklasifikace A, B podle hodnoty sérového kreatininu (postižení funkce ledvin),
- subklasifikace A – sérový kreatinin ≤ 177 μmol/l,
- subklasifikace B – sérový kreatinin > 177 μmol/l.
Klinické varianty
Asymptomatický myelom,
- doutnající myelom,
- indolentní myelom,
- mnohočetný myelom stadia I,
symptomatický myelom,
- mnohočetný myelom stadia II a III,
- solitární plazmocytom.
Terapie
- Pokud je myelom asymptomatický, neléčí se, pouze se sleduje,
- pokud je symptomatický, léčí se:
- mladší pacienti jsou indikováni k autologní transplantaci krvetvorných buněk,
- starší pacienti jsou indikováni k chemoterapii,
- chemoterapie – standardně se používá cyklofosfamid a dexametazon (případně thalidomid), od r. 2009 v ČR registrován pro primoléčbu bortezomib[5]
- radioterapie – u bolestivých kostních ložisek,
- paliativní léčba – u pacientů se závaznými komorbiditami, melfalan a prednizon, případně radioterapie.
Ostatní vzácnější malignity skeletu
Odkazy
Související články
Reference
- ↑ Skočit nahoru k: a b c d e FN Brno. Osteosarkom [online]. Klinika dětské onkologie FN Brno, [cit. 2011-01-02]. <https://www.fnbrno.cz/detska-nemocnice/klinika-detske-onkologie/informace-pro-pacienty/t2698>.
- ↑ Skočit nahoru k: a b PASTOR, Jan. Langenbeck's medical web page [online]. [cit. 18.04.2010]. <https://langenbeck.webs.com/>.
- ↑ ČEŠKA, Richard a Tomáš ŠTULC, et al. Interna. 2. vydání. 2015. 909 s. ISBN 978-80-7387-895-5.
- ↑ ČEŠKA, Richard, et al. Interna. 1. vydání. Praha : Triton, 2010. 855 s. s. 710. ISBN 978-80-7387-423-0.
- ↑ https://www.myeloma.cz/index.php?pg=mnohocetny-myelom--lecba--bortezomib-velcade
Použitá literatura
- DUNGL, P., et al. Ortopedie. 1. vydání. Praha : Grada Publishing, 2005. ISBN 80-247-0550-8.
- SOSNA, A., P. VAVŘÍK a M. KRBEC, et al. Základy ortopedie. 1. vydání. Praha : Triton, 2001. ISBN 80-7254-202-8.
- GALLO, Jiří, et al. Ortopedie pro studenty lékařských a zdravotnických fakult. 1. vydání. Olomouc : Univerzita Palackého v Olomouci, 2011. ISBN 978-80-244-2486-6.