Hemoglobin a jeho deriváty (LF MU)
(přesměrováno z Hemoglobin a jeho deriváty)
| Tento článek je určen pro výuku na LF MU. Pro toto téma je ve WikiSkriptech základní článek na stránce Hemoglobin. |
Hemoglobin je červené krevní barvivo, které zajišťuje transport kyslíku z plic do tkání a transport CO2 a protonů z periferních tkání do dýchacích orgánů.
Koncentrace hemoglobinu u zdravého dospělého muže je přibližně 150 g/l, u dospělé ženy asi 140 g/l. Jeden gram hemoglobinu může navázat až 1,34 ml kyslíku.[1]
Struktura hemoglobinu
Je to tetramerní protein tvořený čtyřmi podjednotkami. Vždy dvě a dvě podjednotky jsou identické. Ve fyziologicky se vyskytujících hemoglobinech jsou zastoupeny čtyři typy polypeptidových řetězců α, β, γ, a δ, které se liší počtem a sledem aminokyselin. Tetramer je tvořen dvěma α řetězci a dvěma dalšími typy řetězců, které udávají charakter celé molekuly hemoglobinu. U dospělých převládá hemoglobin A, na jehož struktuře se podílejí kromě dvou α řetězců (141 aminokyselin) dva β řetězce (146 aminokyselin).
Součástí každé podjednotky je polypeptidový řetězec, na který je navázán kovalentně jeden hem. Základem molekuly hemu je protoporfyrin, tvořený 4 pyrrolovými jádry spojenými methenylovými můstky s centrálně vázaným železem. Hemové železo je celkově šestivazné – čtyřmi koordinačními vazbami je spojeno s atomy dusíku pyrrolových jader. Další koordinační valencí se železo váže s imidazolovou skupinou aminokyseliny histidinu v globinovém řetězci. Šestá valence Fe je určena pro molekulu kyslíku (O2).
Hemoglobin v krvi
Stanovení hemoglobinu v krvi patří k nejzákladnějším laboratorním vyšetřením. Koncentrace hemoglobinu v krvi je hlavním kritériem pro posouzení, zda jde o anemii. Termín anémie (chudokrevnost) se používá při poklesu hemoglobinu nebo erytrocytů pod dolní limit fyziologických hodnot. Anemie patří k velmi častým klinickým nálezům. Jde o stav, který vede ke snížení vazebné kapacity pro kyslík a k následné poruše tkáňového dýchání.
Příčiny anémie
Anemie vzniká za situace, kdy erytropoéza není schopna krýt požadavky na tvorbu nových červených krvinek. Vyvíjí se v důsledku krevních ztrát nebo zvýšeného zániku červených krvinek či nedostatečné tvorby červených krvinek. Následující přehled uvádí některé konkrétní příčiny anémií:
- Anemie ze zvýšených ztrát krve:
- Akutní ztráta krve.
- Chronická ztráta krve.
- Anemie ze zvýšeného rozpadu erytrocytů (hemolytické stavy).
- Autoimunitní hemolytické anémie (přítomnost protilátek proti vlastním erytrocytům).
- Porucha membrány erytrocytů (odchylka ve složení erytrocytové membrány).
- Dědičné enzymové defekty erytrocytů (pyruvátkináza, glukóza-6-fosfátdehydrogenáza).
- Nestabilní hemoglobiny – hemoglobinopatie (např. hemoglobin S u srpkovité anémie).
- Anemie ze snížené tvorby erytrocytů.
- Nedostatek látek potřebných pro erytropoézu (nedostatek železa, nedostatek vitaminu B12, nedostatek kyseliny listové, nedostatek erytropoetinu – chronická renální onemocnění, nedostatek dalších látek např. vitaminů B1, B6).
- Anemie v důsledku chemického, fyzikálního a radiačního poškození.
- Anemie při chronických zánětlivých, infekčních a nádorových onemocněních.
Zvýšení hodnot hemoglobinu se označuje jako polyglobulie. Může být projevem výraznější dehydratace (relativní polyglobulie). S výraznější polyglobulií se nejčastěji setkáme u stavů spojených s chronickou hypoxií, např. při plicních onemocněních, vzácněji při pobytech ve vysokých nadmořských výškách apod. Vzácně může být způsobena některými myeloproliferativními stavy, např. polycytemia vera.
Princip stanovení hemoglobinu v krvi
Oxidace hemoglobinu na methemoglobin:
| HbFeII | + | [FeIII(CN)6]3− | → | HbFeIII | + | [FeII(CN)6]4− |
| Hemoglobin | Methemoglobin |
Přeměna methemoglobinu na kyanmethemoglobin:
| HbFeIII | + | CN− | → | HbFeIIICN | |
| Methemoglobin | Kyanmethemoglobin |
Fotometrické stanovení je založeno na oxidaci dvojmocného železa v hemoglobinu hexakyanoželezitanem draselným na trojmocné železo. Vzniklý methemoglobin se v další reakci s kyanidem draselným přeměňuje na velmi stálý kyanmethemoglobin s jediným širokým absorpčním maximem ve viditelné oblasti při 540 nm.
Hodnocení: Referenční rozmezí koncentrace hemoglobinu v krvi(B hemoglobin)pro dospělého muže je 130–180 g/l a pro ženu 120–160 g/l.
Úkol: Stanovení hemoglobinu v krvi (pdf)
Hemoglobin v moči
Močí zcela zdravých lidí se vyloučí až milion erytrocytů za den. Toto velmi malé množství nelze prokázat běžnými chemickými zkouškami. Výskyt většího množství erytrocytů (hematurie, erytrocyturie) nebo průnik volného hemoglobinu, příp. svalového myoglobinu, do definitivní moči (hemoglobinurie, resp. myoglobinurie) je téměř vždy patologickým nálezem. Makroskopickou hematurii pozorujeme pouhým okem; moč má narůžovělé zbarvení (přirovnává se k vodě z vypraného masa) a spektroskopicky v ní lze prokázat hemoglobin. V moči bývá nejméně 1 g hemoglobinu na litr. U masivní hemoglobinurie může mít moč až zbarvení černého piva (degradace hemoglobinu na hematin). Mikroskopická hematurie je prokazatelná pouze biochemicky.
Stanovení hemoglobinu v moči
Hemoglobin katalyzuje, podobně jako peroxidáza, oxidaci (dehydrogenaci) některých substrátů (např. derivátů benzidinu) peroxidem vodíku:
Nejedná se však o enzymovou aktivitu (katalýzu podmiňuje hemové železo), a proto se neztrácí ani po tepelné denaturaci. Hovoříme o pseudoperoxidázové aktivitě, která se využívá k citlivým, ale nespecifickým důkazům hemoglobinu nebo stopových množství krve. Výhodné je ke sledování reakce použít chromogenní substrát, tj. látku poskytující dehydrogenací výrazně zbarvený produkt (často benzidin nebo jeho nekancerogenní deriváty, aminofenazon apod.).
Reagenční zóna diagnostických proužků obsahuje chromogen (např. tetrametylbenzidin) se stabilizovaným peroxidem vodíku (např. kumenhydroperoxidem). V přítomnosti volného hemoglobinu (hemoglobinurie) se indikační zóna zbarví rovnoměrně modře. Pokud jsou v moči přítomny erytrocyty (erytrocyturie), vytvářejí se intenzivně zelenomodře zbarvené tečky až skvrny.
S hemoglobinurií se můžeme setkat u intravaskulární hemolýzy. K častější erytrocyturii vede jak poškození glomerulární membrány (glomerulární hematurie), tak krvácení z jakékoliv části vývodných cest močových. Často ji nacházíme u infekcí močových cest, urolitiázy a nádorů urogenitálního traktu.
Kromě hemoglobinu poskytuje pseudoperoxidázovou reakci i myoglobin, který se může do moči vylučovat při rozpadu kosterního svalstva (rabdomyolýza, crush-syndrom). Pozitivita zkoušky může být způsobena i peroxidázami leukocytů či některých bakterií, kvasinek nebo plísní, které se mohou vyskytovat v moči zejména při infekcích močových cest. Chceme-li vyloučit možnost falešně pozitivní reakce účinkem buněčných peroxidáz, je nutno reakci provádět s povařenou močí.
Kontaminace odběrové nádoby silnými oxidačními činidly rovněž vyvolává falešnou pozitivitu reakce. Na druhé straně může přítomnost silně redukujících látek (např. kyselina askorbová) zpomalit až zastavit pseudoperoxidázovou reakci a být tak příčinou falešně negativních výsledků.
Úkol: Průkaz krve a krevního barviva v moči (pdf)
Hemoglobin ve stolici – okultní krvácení
Průkaz okultního (skrytého) krvácení slouží k záchytu časných fází kolorektálního karcinomu, kdy je možná radikální a efektivní léčba. Vyšetření spočívá v zachycení stop krve ve stolici, používají se různé metodické postupy:
- Metody využívají pseudoperoxidázové aktivity hemoglobinu. Pacient musí držet 3 dny před vyšetřením dietu, vyloučit ze stravy nedovařené maso, salámy, banány, rajčata, nesmí užívat léky obsahující kyselinu askorbovou nebo acetylsalicylovou. Poté si pacient sám odebírá vzorky ze tří po sobě jdoucích stolic a aplikuje je na testovací karty. Vyhodnocení se provádí v laboratoři, princip je podobný jako u diagnostických proužků hemoPHAN
- Další metody jsou založeny na imunochemickém průkazu hemoglobinu pomocí protilátky proti lidskému hemoglobinu. Imunochemické metody jsou citlivější a specifičtější, není zapotřebí držet před vyšetřením dietu. Pozitivní výsledky musí být ověřeny dalšími diagnostickými metodami.
Úkol: Test na okultní krvácení v zažívacím traktu (pdf)
Deriváty hemoglobinu
K derivátům hemoglobinu se řadí následující typy:
Oxyhemoglobin a deoxyhemoglobin
Hemoglobin nesoucí kyslík se označuje jako oxyhemoglobin (oxyHb). Každá molekula Hb může vázat 4 molekuly kyslíku. Po uvolnění kyslíku hovoříme o deoxyhemoglobinu (deoxyHb). V obou formách je železo dvojmocné, neboť pouze hemoglobin obsahující FeII+ může reverzibilně vázat a přenášet molekulu kyslíku. Oxygenace molekuly hemoglobinu mění elektronový stav komplexu FeII+-hem, což se projeví změnou barvy tmavě červeného odstínu typického pro žilní krev na jasně červenou barvu tepenné krve. V lidském organismu je asi 98,5 %[2]kyslíku vázáno právě na hemoglobin.
Karbaminohemoglobin
Karbaminohemoglobin je hemoglobin, na kterém je navázaný CO2. Oxid uhličitý se váže na globinový řetězec hemoglobinu. Vazba CO2 na hemoglobin snižuje afinitu hemoglobinu ke kyslíku.
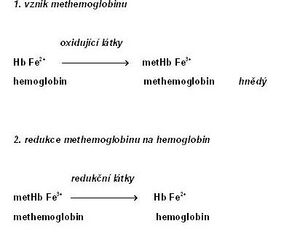
Methemoglobin
Methemoglobin (metHb; též hemiglobin nebo ferihemoglobin[1]) je charakterizován přítomností trojmocného železa, které vzniká oxidací dvojmocného železa v hemoglobinu[3]. Methemoglobin ztrácí schopnost reverzibilně vázat kyslík. Na jeho místě váže FeIII+ šestou koordinační vazbou molekulu vody. Barva methemoglobinu je čokoládově hnědá.
Methemoglobin je v erytrocytech v malém množství přítomen i fyziologicky (asi 1–3 % celkové koncentrace hemoglobinu[4]). Děje se tak především účinkem dusitanů, které vznikají z dusičnanů obsažených v potravě. Zpětnou redukci methemoglobinu na hemoglobin zajišťuje především NADH-dependentní cytochrom-b5 reduktáza (též methemoglobinreduktáza). Menší roli hraje NADPH-dependentní methemoglobinreduktáza, která je závislá na dodávce NADPH z pentózového cyklu a na přítomnosti dalšího elektronového přenašeče (např. flavinu).[5] Neenzymové mechanismy zahrnují působení glutathionu a kyseliny askorbové.
Zvýšená koncentrace methemoglobinu v krvi se označuje jako methemoglobinemie. Příčiny vzniku jsou různé:
- Dědičná methemoglobinemie je obvykle způsobena vrozeným defektem NADH-dependentní methemoglobinreduktázy nebo přítomností abnormálního hemoglobinu M.
- Získaná methemoglobinemie je nejčastější formou methemoglobinemie. Může být vyvolána působením oxidujících látek[6]:
- otravou některými látkami (nitrobenzen, anilin a jeho deriváty – např. některá barviva),
- působením některých léků (lokální anestetika – benzokain, dále fenacetin, sulfonamidy),
- zvýšeným obsahem dusičnanů a dusitanů ve vodě a v potravinách.
Na zvýšený obsah těchto látek jsou zvláště citliví novorozenci v důsledku nezralosti redukčních systémů a zvýšeného podílu fetálního hemoglobinu, který se snáze oxiduje. Methemoglobinemie se projevuje cyanózou s charakteristickým šedohnědým odstínem a hypoxií.
| Hodnoty methemoglobinu | Příznaky |
|---|---|
| 0–2 % | normální hodnota |
| < 10 % | cyanóza |
| < 35 % | cyanóza a další příznaky (bolest hlavy, dušnost) |
| 70 % | smrtelná koncentrace |
Součástí terapie získané methemoglobinemie je podávání některých redukčních činidel – methylénové modři nebo kyseliny askorbové.
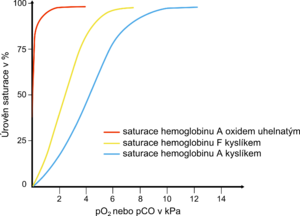
Karbonylhemoglobin
Karbonylhemoglobin (COHb, karboxyhemoglobin) vzniká vazbou oxidu uhelnatého na hemoglobin. Vytvořená vazba je 250–300krát silnější než vazba kyslíku. Karbonylhemoglobin nemůže transportovat kyslík a v důsledku snížené schopnosti krve přenášet kyslík se vyvíjí buněčná hypoxie. V nadbytku kyslíku je vazba oxidu uhelnatého na hemoglobin reverzibilní. Proto je při otravě oxidem uhelnatým nejdůležitější inhalace O2.
V malém množství se COHb může vyskytnout i u zdravých osob. U obyvatel měst se prokazují hodnoty kolem 2 %, u silných kuřáků může COHb stoupnout až na 10 % z celkového hemoglobinu. Několikaminutový pobyt v prostředí obsahující 0,1 % CO může zvýšit koncentraci karbonylhemoglobinu na 50 %.
Oxid uhelnatý vzniká při nedokonalém spalování paliv, dále je obsažen ve výfukových plynech a v kouři při požárech v uzavřených místnostech.
| Hodnoty COHb v % | Příznaky |
|---|---|
| 10 | při větší námaze dušnost |
| 20–40 | bolesti hlavy, dušnost, únava, zvracení |
| 40–60 | hyperventilace, tachykardie, synkopa, křeče |
| 60–80 | kóma, smrt |
Karbonylhemoglobin se vyznačuje karmínově červeným zbarvením. Proto není zachytitelný běžnou oxymetrií. Těla ponechaná v atmosféře s vysokou koncentrací CO mohou mít „zdravě“ růžovou barvu pleti. U dosud žijících pacientů se však otrava nemusí na barvě pleti vůbec projevit. Ve srovnání s hemoglobinem je karbonylhemoglobin odolnější vůči chemickým vlivům, působením různých činidel se mění pomaleji.
Spektrofotometrie derivátů hemoglobinu
Hemoglobin a jeho deriváty mají ve viditelné oblasti světla charakteristická absorpční spektra, kterých se využívá k jejich analýze a rychlé identifikaci. Pro všechny hemoproteiny jsou typická výrazná absorpční maxima v oblasti 400–430 nm, tzv. Soretův pás. Další absorpční vrcholy jsou podstatně nižší. Oxyhemoglobin je charakterizován dvěma neúplně oddělenými maximy v oblasti 540 a 578 nm. Deoxyhemoglobin má jedno absorpční maximum při 555 nm. Hlavní absorpční maximum methemoglobinu je při 630 nm a druhý nevýrazný vrchol při 500 nm je závislý na pH. Reakcí methemoglobinu s kyanidem draselným mizí maximum při 630 nm, neboť vzniká kyanmethemoglobin. Pokles absorbance při 630 nm je úměrný koncentraci methemoglobinu. Kyanmethemoglobin vykazuje široké absorpční maximum při 540 nm, kterého se využívá při stanovení koncentrace hemoglobinu v krvi. Spektrum karbonylhemoglobinu se podobá spektru oxyhemoglobinu, ale poloha vrcholů je posunuta směrem k nižším vlnovým délkám.
| Derivát hemoglobinu | Absorpční maxima [nm] |
|---|---|
| Hemoglobin redukovaný | 431, 555 |
| Oxyhemoglobin | 414, 540, 578 |
| Methemoglobin | 404, 500, 630 |
| Karbonylhemoglobin | 420, 538–540, 568–569 |
| Kyanmethemoglobin | 421, 540 |
Stanovení karbonylhemoglobinu:
Stanovení karbonylhemoglobinu v krvi patří mezi základní toxikologická vyšetření. Je objektivním kritériem při hodnocení akutních i chronických otrav oxidem uhelnatým.
- Spektrofotometrické hodnocení. Karbonylhemoglobin lze stanovit rychle spektrofotometricky na základě odečtení posunu absorpčního maxima ředěné krve od 586 nm[7]. Posun maxima ve spektru je závislý na poměru COHb a O2Hb ve vzorku.
- Reakce s taninem. Orientačně lze karbonylhemoglobin stanovit reakcí s taninem nebo Ajatinem (asi od 10 % COHb). Tanin vytváří v přítomnosti karbonylhemoglobinu jahodově červenou sraženinu. V nepřítomnosti karbonylhemoglobinu je zbarvení sraženiny hnědošedé.
- Analyzátory acidobazické rovnováhy. Analýzu toxikologicky nejdůležitějších derivátů hemoglobinu COHb a metHb umožňují rovněž moderní analyzátory acidobazické rovnováhy, které mají zabudovaný fotometrický systém pro jejich měření.
Úkol: Spektrofotometrické vyšetření hemoglobinu a jeho derivátů (pdf)
Úkol: Orientační stanovení karbonylhemoglobinu (pdf)
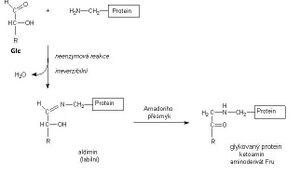
Glykovaný hemoglobin HBA1
Glykovaný hemoglobin vzniká neenzymovou reakcí mezi hemoglobinem a glukózou v krvi. Jeho tvorba je ireverzibilní.
Hladina glykovaného hemoglobinu proto odráží koncentraci glukózy v krvi po celou dobu existence erytrocytu, tj. asi 120 dní, a využívá se k posouzení úspěšnosti léčby/kompenzace diabetu v období 4–8 týdnů před vyšetřením. Nejčastěji se stanovuje forma stabilní frakce HBA1c.
- Terminologie
- Glykovaný hemoglobin – suma sacharidových adduktů na N-terminálním konci nebo ε aminoskupinách lysinu v hemoglobinu.
- HbA1 – suma různých minoritních frakcí hemoglobinu (glykovaných), včetně HbA1c, HbA1a1/a2, HbA1b1/b2/b3, HbA1d1/d2/d3 a HbA1e.
- HbA1c – glukózový adukt valinu na N-terminálním konci β-globinu; odpovídá tzv. stabilnímu ketoaminu (N-[1-deoxyfruktózyl]hemoglobinu).
Glykovaný hemoglobin je možné stanovit pomocí iontoměničové chromatografie s následnou spektrofotometrií.
- Hodnocení
- Množství glykovaného hemoglobinu se vyjadřuje v % celkového hemoglobinu nebo nyní nově v mmol/mol dle IFCC (International Federation of Clinical Chemistry).
- Referenční meze
- u zdravých dospělých do hodnoty 39 mmol/mol, (2,8–4,0 %)[8]
- diabetiků svědčí koncentrace HbA1c do 45 mmol/mol (4,5 %) o vynikající kompenzaci diabetu, do 60 mmol/mol (6,0 %) o přijatelné a vyšší hodnoty o neuspokojivé kompenzaci diabetu[9]
Úkol: Stanovení glykovaného hemoglobinu (pdf)
Železo
Železo je jedním z nejdůležitějších prvků v lidském organismu. V těle dospělého člověka je obsaženo více než 70 mmol (4,0–4,5 g) železa. U žen je toto množství nižší než u mužů, což se přičítá ztrátám krve při menses.
| Forma | Funkce | Protein | Množství v g |
|---|---|---|---|
| Aktivní železo | transport kyslíku | hemoglobin | 2,5–3,0 |
| myoglobin | 0,3 | ||
| přenos elektronů | cytochromy, cytochromoxidáza | 0,2 | |
| rozklad peroxidu vodíku | kataláza, peroxidáza | ||
| Zásobní železo | feritin, hemosiderin | 0,8–1,0 | |
| Transportní železo | transferin | 0,003 | |
Metabolismus železa
Přítomnost železa je nezbytná pro funkci buněk. Jako součást hemu se účastní transportu kyslíku a jako součást cytochromů podmiňuje přenos elektronů v dýchacím řetězci. Nežádoucím účinkem železa jako přechodného a velmi reaktivního prvku je účast v radikálových reakcích, při nichž vznikají tzv. reaktivní formy kyslíku. Ty mohou poškozovat buněčné membrány, proteiny a DNA.
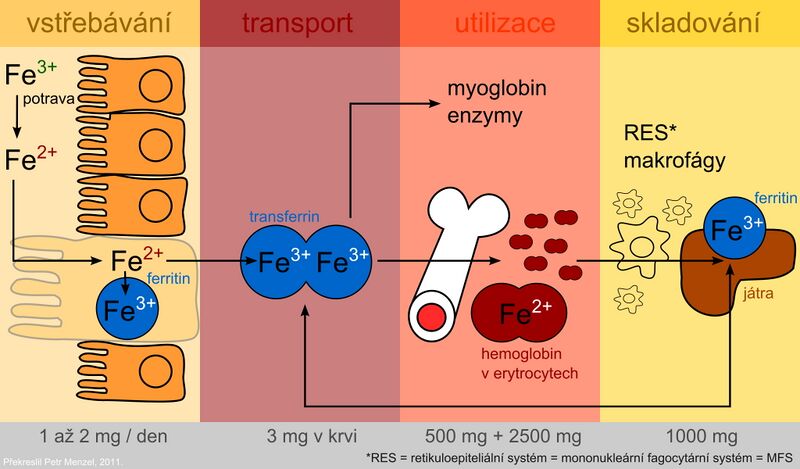
Železo se absorbuje jako Fe2+ aktivním transportem v duodenu a v horní části jejuna, a to dvěma způsoby:
- na porfyrin vázané Fe ve formě stabilního lipofilního komplexu;
- FeII+ – cheláty rozpustné ve vodě.
Jen nepatrná část se vstřebává v ionizované formě.
Ve stravě bývá průměrně 10–50 mg železa za den, ale vstřebá se pouze 10–15 %. Ve sloučeninách hemu (maso) se absorbuje lépe, nehemové Fe v rostlinné stravě mnohem hůře. Kromě toho rostliny obsahují oxaláty, fytáty, taniny a jiné fenolické sloučeniny, jež tvoří s Fe nerozpustné nebo chelátové komplexy, které se těžko vstřebávají. Askorbová kyselina na druhé straně absorpci železa zlepšuje.
Po vychytání střevní mukózou se část železa inkorporuje do zásobní formy – feritinu v intestinálních buňkách. Část absorbovaného železa přestupuje do plazmy, kde je transportováno ve vazbě na transferin. Důležitou roli při přenosu železa přes bazolaterální membránu enterocytů má protein ferroportin (nachází se i v membráně makrofágů a hepatocytů). Je to hlavní místo regulace homeostázy železa v organismu. Klíčovým faktorem regulace je protein hepcidin, který je syntetizován v játrech. Vazbou na ferroportin inhibuje transport železa z buněk a tím přispívá k jeho sekvestraci v nich. Hladina hepcidinu se zvyšuje při zánětu. Hepcidin je částečně zodpovědný i za anémii chronických chorob. Mutace genu pro hepcidin vedou k juvenilní hemochromatóze typu 2B.
Plazmatické železo je zachycováno buňkami cílových tkání prostřednictvím receptoru pro transferin a buď je zabudováno do hemu nebo uloženo do zásoby ve formě feritinu. Využití specifické transportní bílkoviny transferinu a zásobního proteinu feritinu pro uskladnění železa představuje ochranné mechanismy, které mají zamezit toxickému působení oxidoredukčně aktivního železa.
Při deskvamaci odumřelých slizničních buněk odchází nezužitkované železo stolicí spolu s nevstřebaným železem.
Metabolismus železa - YouTube video
Vyšetření metabolismu železa
V praxi se běžně setkáváme s onemocněními spojenými se změnami metabolismu a utilizace železa. Laboratorní vyšetření metabolismu železa zahrnuje následující vyšetření:
- železo v séru
- sérový transferin a vazebná kapacita pro železo
- sérový feritin
- transferinový receptor
Uvedené parametry jsou důležitými diagnostickými ukazateli pro průkaz poklesu či nárůstu zásob železa ještě ve stádiích, která nejsou doprovázena výraznými klinickými projevy.
Stanovení železa v séru
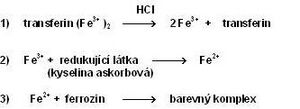
Pro stanovení železa v séru se používají kolorimetrické metody, atomová absorpční spektrofotometrie a další speciální techniky. Nejužívanější jsou fotometrické metody, založené na reakci železa s komplexotvornou látkou. Všechny postupy zahrnují následující kroky:
- Uvolnění Fe3+ z vazby na transferin pomocí kyselin nebo tenzidů (např. HCl).
- Redukce Fe3+ na Fe2+, která je nezbytná pro reakci s komplexotvorným činidlem. K redukci se používá např. kyselina askorbová.
- Reakce Fe2+ s komplexotvorným činidlem obsahujícím reaktivní skupiny –N=C–C=N– za vzniku barevného komplexu. Ionty kovu vytvářejí cheláty s dvěma atomy dusíku. V současnosti se využívají především dvě komplexotvorné látky – bathofenentrolin a ferrozin (3-(2-pyridyl)-5,6-bis(4-sulfofenyl)-1,2,4-triazin – PST, chráněný název FerroZine®), který má vyšší absorpční koeficient a je lépe rozpustný ve vodě.
- Hodnocení
- Koncentrace sérového železa podléhají cirkadiánnímu rytmu a jsou ovlivněny i dalšími faktory. To omezuje diagnostický význam tohoto parametru. Je špatným ukazatelem tkáňových zásob železa a je nutné ho vždy posuzovat v kombinaci se sérovým transferinem a vazebnou kapacitou pro železo. Snížené koncentrace doprovázejí nedostatek železa, způsobený např. velkými nebo opakovanými krevními ztrátami, nedostatečným příjmem železa potravou nebo narušenou absorpcí. Nález není specifický, neboť se sníženými hladinami se setkáváme rovněž u akutní infekce nebo chronických zánětlivých onemocněních (přesun železa do tkání). Vysoké hladiny železa se vyskytují u hemochromatózy (viz níže), při předávkování nebo intoxikaci železem, při zvýšeném rozpadu erytrocytů a u některých jaterních onemocnění.
- Referenční hodnoty
- muži: 9–29 μmol/l
- ženy: 7–28 μmol/l
Sérový transferin a vazebná kapacita pro železo
Železo je transportováno krví ve vazbě na specifický protein s β1-elektroforetickou pohyblivostí – transferin, který je syntetizován v játrech. Rychlost jeho tvorby je nepřímo úměrná zásobám železa v organismu; zvyšuje se při nedostatku železa a při nadbytku klesá. Biologická funkce transferinu spočívá ve schopnosti snadno tvořit netoxické komplexy se železem a přenášet Fe absorbované sliznicí tenkého střeva do kostní dřeně nebo do zásobních forem (feritinu nebo hemosiderinu). Každá molekula transferinu váže dva atomy Fe3+ (1 g transferinu váže 25,2 μmol železa). Transferin může být stanoven přímo pomocí imunochemických metod nebo nepřímo jako schopnost transferinu vázat železo – tzv. vazebná kapacita pro železo. Celková vazebná kapacita pro železo (TIBC – total iron binding capacity) je množství železa, které je transferin schopen vázat v případě, že všechna vazebná místa jsou obsazena. Obvykle je železem nasycena pouze 1/3 transferinu – vázaná kapacita. Volný transferin bez navázaného železa představuje volnou vazebnou kapacitu (2/3 transferinu), která je k dispozici pro transport železa při zvýšených požadavcích.
Přepočet mezi koncentrací transferinu a celkovou vazebnou kapacitou:
- Celková vazebná kapacita [μmol/l] = transferin [g/l] · 25,2.
Referenční rozmezí pro koncentraci transferinu v séru (S-transferin) je 2,0–3,6 g/l a pro celkovou vazebnou kapacitu je 50–70 μmol/l.
Saturace transferinu
Z hodnot koncentrace železa a transferinu můžeme vypočítat saturaci transferinu (TfS), která je definována jako poměr sérové koncentrace železa k celkové vazebné kapacitě transferinu pro železo. Jedná se o citlivý parametr pro odhalení latentního nedostatku železa.
- Hodnocení saturace transferinu
- fyziologické hodnoty: 25–50 %
- snížení saturace při nedostatku železa: < 15 %
- zvýšení saturace při nadbytku železa: > 50 %
Feritin a hemosiderin
Feritin je nejdůležitější zásobní protein pro železo. Molekula feritinu je přizpůsobena vázat velké množství Fe3+ v rozpustné a netoxické formě pro organismus. Feritin je tvořen vnějším proteinovým obalem z 24 podjednotek – apoferitinem (Mr 440 000), ohraničujícím dutinu, ve které může být soustředěno až 4500 atomů železa ve formě oxyhydroxidu železitého (FeO·OH)n v mikrokrystalické podobě s fosfáty (FeO·OPO3H2). Vstup a výstup atomů železa umožňují póry mezi jednotlivými podjednotkami obalu molekuly feritinu. Normálně je jeho kapacita využita asi z 20 %. Ukládá se do buněk v játrech, slezině a střevní sliznici.
V krevním séru se feritin nachází ve velmi nízké koncentraci. Sérové koncentrace feritinu jsou měřítkem zásob železa v organismu. Nízké koncentrace indikují vyčerpání celkové tělesné rezervy železa a slouží k časnému odhalení anémie z nedostatku železa ještě v prelatentní fázi. Zvýšené koncentrace feritinu jsou doprovodným jevem vysokých tkáňových zásob železa. Dále se s nimi setkáváme u mnohých pacientů s onemocněním jater, některými maligními nádory (nádorový marker) nebo zánětlivými onemocněními (pozitivní reaktant akutní fáze).
Referenční rozmezí pro koncentraci feritinu v séru (S-feritin) je pro muže 30–300 μg/l a pro ženy 20–120 μg/l.
Hemosiderin je dalším zásobním proteinem pro železo. Vzniká agregací denaturovaného feritinu s dalšími komponentami. Vytváří partikule o velikosti 1 až 2 μm, které jsou při použití barvení na železo viditelné ve světelném mikroskopu. Hemosiderin obsahuje větší množství železa než feritin, ale vzhledem ke špatné rozpustnosti ve vodě je obtížně dostupné. Tvoří se za situace, kdy množství železa v organismu převýší skladovací kapacitu feritinu.
Transferinový receptor
Železo transportované krví transferinem je zachycováno buňkami prostřednictvím specifického transferinového receptoru (TfR). V určitém stádiu vývoje se nachází na povrchu všech buněk, nejvíce je však exprimován na povrchu prekursorů buněk červené řady v kostní dřeni. TfR je transmembránový protein, který je tvořen dvěma identickými podjednotkami, spojenými disulfidovou vazbou. Oddělením extracelulárních domén receptoru se do cirkulace uvolňuje tzv. solubilní (rozpustná) frakce transferinového receptoru (sTfR), který může být v podobě dimeru nebo monomeru. Buňky reagují na snížení zásob železa syntézou zvýšeného množství transferinových receptorů.
Zvýšení sTfR je spolehlivým ukazatelem nedostatku železa pro krvetvorbu. Se zvýšenými hladinami sTfR se setkáváme u anemií z nedostatku železa nebo u hemolytických anemií. Cenné je stanovení sTfR u anemických pacientů, u nichž je zvýšen feritin z důvodů reakce akutní fáze. Stanovení koncentrace sTfR je možno využít i u pacientů s transplantovanou kostní dření pro sledování průběhu erytropoézy.
Ke stanovení se používají imunochemické metody.
Poruchy metabolismu železa
Nedostatek železa (sideropenie)
Nedostatek železa v organismu bývá zpravidla způsoben jeho nedostatečným vstřebáváním ze střeva nebo chronickými ztrátami krve. Může vyústit v sideropenickou anémii (hypochromní mikrocytární anémie), která patří mezi nejčastější hematologická onemocnění. Anémie je však zpravidla pozdní příznak postupně se vyvíjející sideropenie. V krevním obraze se projeví až po téměř úplném vymizení železa. Proto je potřebné odhalit nedostatek železa v časném stádiu, které ještě není doprovázeno anémií.
Na základě stanovení základních parametrů metabolismu železa rozlišujeme tři stupně nedostatku:
- Prelatentní nedostatek železa je označení pro stav, kdy dochází k postupnému poklesu zásob, ale ještě není ovlivněna dodávka železa do erytroblastů kostní dřeně. Asi u poloviny nemocných jsou hladiny feritinu v séru snížené pod 12 μg/l.
- Při latentním nedostatku železa jsou jeho zásoby v podstatě vyčerpány. Feritin je snížen pod dolní hranici normy a je v tomto stádiu již doprovázen i snížením hladiny železa v séru a sníženou dodávkou do erytroblastů kostní dřeně. Zvyšuje se vazebná kapacita pro železo. Citlivým ukazatelem latentního nedostatku železa je pokles saturace transferinu pod 15 %. Nerozvíjí se však ještě anémie.
- Při manifestním nedostatku železa dochází k rozvoji anémie s poklesem hodnot hemoglobinu pod dolní hranici normy. U anémie z nedostatku železa je typický nález nízkého sérového železa a feritinu, je zvýšená koncentrace transferinu (vazebná kapacita pro železo). U hemolytických anémií nebo při nadbytku železa je naopak sérové železo zvýšené, současně je snížená celková vazebná kapacita pro železo.
| Prelatentní nedostatek železa | Latentní nedostatek železa | Manifestní nedostatek železa |
|---|---|---|
| snižování zásobního železa – pokles feritinu | nedostatek zásobního železa – pokles feritinu | nedostatek zásobního železa – pokles feritinu |
| snížení sérového železa | snížení sérového železa | |
| pokles saturace transferinu pod 15 % | pokles transferinu pod 10 % | |
| zvýšení celkové vazebné kapacity pro železo | zvýšení celkové vazebné kapacity pro železo | |
| zvýšení sTfR | zvýšení sTfR | |
| snížení koncentrace hemoglobinu – anémie |
Nadbytek železa
Organismus není vybaven exkreční cestou pro železo, a proto se za určitých okolností může přebytečné železo hromadit ve tkáních. Včasná diagnostika může zabránit poškození tkání nadbytkem železa. Přetížení železem se rozvíjí většinou velmi pomalu. Rozlišujeme 3 stádia:
- Ve stádiu prelatentního nadbytku železa se zvyšuje jeho obsah v orgánech, ale bez překročení jejich zásobní kapacity.
- V období latentního stádia přetížení železem je překročena zásobní kapacita buněk, ale ještě není poškozena funkce orgánů, zvyšuje se hladina feritinu i hladina železa v séru a stoupá saturace transferinu nad 55 %.
- Ve fázi manifestního nadbytku železa jsou již poškozeny některé orgány.
| Prelatentní nadbytek železa | Latentní nadbytek železa | Manifestní nadbytek železa |
|---|---|---|
| zvyšování zásob železa – zvýšení feritinu | zvyšování zásob železa – zvýšení feritinu nad 300 μg/l | zvyšování zásob železa – zvýšení feritinu (při těžkém postižení nad 2000 μg/l) |
| zvýšení železa v séru | výrazné zvýšení železa v séru | |
| zvýšení saturace transferinu nad 55 % | zvýšení saturace transferinu (při těžkém postižení může převýšit 90 %) |
Hemochromatóza
Hromadění železa v tkáních souvisí s onemocněním, které označujeme jako hemochromatóza.
- Primární hemochromatóza je dědičné onemocnění způsobené zvýšenou resorpcí železa ze střeva. Přebytečné železo se ukládá v parenchymatózních orgánech jako jsou játra, srdce, pankreas, nadledviny. V postižených orgánech působí toxicky a narušuje jejich funkci tím, že může katalyzovat chronické reakce vedoucí k tvorbě volných radikálů. Hlavními klinickými projevy jsou hyperpigmentace kůže, hepatosplenomegalie a diabetes mellitus.
- Sekundární hemochromatóza se může vyvinout jako následek např. opakovaných transfúzí, nadbytečného příjmu přípravků obsahujících železo nebo hemolytické anémie. V biochemickém obraze nalézáme zvyšující se hladiny feritinu a železa v séru, stoupá saturace transferinu při jeho současném poklesu.
Otrava železem
Náhodné požití většího množství přípravků hrozí dětem (tablety podobné lentilkám). Smrtelná dávka pro dítě je 600 mg. Pro dospělého je příjem železa 40 mg/ kg toxikologicky závažný, příjem 60 mg/kg je smrtelný[10].
Příznaky zahrnují nevolnost, zvracení (i zvracení krve), bolesti břicha, průjem (někdy krvavý). Velké ztráty tekutin jsou příčinou šoku, selhání ledvin a smrti. Pokud nemocný přežije tuto fázi otravy, může po 12 hodinách upadnout do bezvědomí, křečí a jaterního selhání. Přežije-li i tuto druhou fázi, otrava může zanechat trvalé následky (poškození střeva).
- Léčba akutní otravy
- Výplach žaludku.
- Nasogastrální sondou podat chelační činidlo deferoxamin
 (5–10 g do 50–100 ml vody).
(5–10 g do 50–100 ml vody). - Zvážit intravenózní podání desferoxaninu k vyvázání vstřebaného železa. V moči se objeví růžově červený komplex deferoxaminu se železem. Léčbu je třeba opakovat do té doby, než se barva moči vrátí k normě[10].
Úkol: Stanovení Fe v séru kolorimetrickou metodou (pdf)
Odkazy
Související články
Reference
- ↑ Skočit nahoru k: a b ŠVÍGLEROVÁ, Jitka. Hemoglobin [online]. Poslední revize 2009-02-18, [cit. 2010-11-11]. <https://web.archive.org/web/20160416205421/http://wiki.lfp-studium.cz/index.php/Hemoglobin>.
- ↑ KITTNAR, Otomar a ET AL.. Lékařská fyziologie. 1. vydání. Praha : Grada, 2011. 790 s. s. 131. ISBN 978-80-247-3068-4.
- ↑ ŠVECOVÁ, D a D BÖHMER. Vrozená a získaná methemoglobinémia a ich liečba. Časopis lékařů českých. 1998, vol. 137, s. 168-170, ISSN 1803-6597.
- ↑ RICHARD, Alyce M, James H DIAZ a Alan David KAYE. Reexamining the risks of drinking-water nitrates on public health. Ochsner J [online]. 2014, vol. 14, no. 3, s. 392-8, dostupné také z <https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4171798/?tool=pubmed>. ISSN 1524-5012.
- ↑ XU, F, K S QUANDT a D E HULTQUIST. Characterization of NADPH-dependent methemoglobin reductase as a heme-binding protein present in erythrocytes and liver. Proc Natl Acad Sci U S A [online]. 1992, vol. 89, no. 6, s. 2130-4, dostupné také z <https://www.ncbi.nlm.nih.gov/pmc/articles/PMC48610/?tool=pubmed>. ISSN 0027-8424.
- ↑ CORTAZZO, Jessica A a Adam D LICHTMAN. Methemoglobinemia: a review and recommendations for management. J Cardiothorac Vasc Anesth [online]. 2014, vol. 28, no. 4, s. 1043-7, dostupné také z <https://www.ncbi.nlm.nih.gov/pubmed/23953868>. ISSN 1053-0770 (print), 1532-8422.
- ↑ LEDVINA, M. Rychlé spektrofotometrické stanovení karbonylhemoglobinu v krvi. Biochem Clin Bohemoslov. 1987, vol. 16, s. 493-495, ISSN 0139-9608.
- ↑ ČEŠKA, Richard a Tomáš ŠTULC, et al. Interna. 2. vydání. TRITON, 2022. 870 s. ISBN 978-80-7387-885-6.
- ↑ Doporučený diagnostický a léčebný postup pro všeobecné praktické lékaře. Diabetes mellitus. 2005. Dostupné také z URL <https://www.svl.cz/files/files/Doporucene-postupy-2003-2007/Diabetes-mellitus.pdf>.
- ↑ Skočit nahoru k: a b ŠEBKOVÁ, Sylva. Otrava železem [online]. ©2003. Poslední revize 2003-10-06, [cit. 2021-08-16]. <http://medicina.cz/clanky/5819/34/Otrava-zelezem/>.






![\mathrm{H}_2\mathrm{O}_2 + \mathrm{H}_2\mathrm{A}\ \xrightarrow[\mathrm{nebo\ hemoglobin\ a\ jin\acute{e}\ l\acute{a}tky}]{\mathrm{peroxid\acute{a}zy}}\ 2\ \mathrm{H}_2\mathrm{O} + \mathrm{A}](https://wikimedia.org/api/rest_v1/media/math/render/svg/23377fd4d265df004d50c7657f43bcbbe4cdc8ff)




![{\displaystyle {\mbox{Saturace transferinu}}[\%]={\frac {{\mbox{S-}}{\check {\mbox{z}}}{\mbox{elezo}}[\mu {\mbox{mol/l}}]}{{\mbox{ S-transferin }}[{\mbox{g/l}}]\times 25,2}}\times 100}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d5561698408db44cd3fac37bce267b80cb6c8529)


