Deriváty hemoglobinu
(přesměrováno z Deoxyhemoglobin)
K derivátům hemoglobinu se řadí následující typy:
Oxyhemoglobin a deoxyhemoglobin
Hemoglobin nesoucí kyslík se označuje jako oxyhemoglobin (oxyHb). Každá molekula Hb může vázat 4 molekuly kyslíku. Po uvolnění kyslíku hovoříme o deoxyhemoglobinu (deoxyHb). V obou formách je železo dvojmocné, neboť pouze hemoglobin obsahující FeII+ může reverzibilně vázat a přenášet molekulu kyslíku. Oxygenace molekuly hemoglobinu mění elektronový stav komplexu FeII+-hem, což se projeví změnou barvy tmavě červeného odstínu typického pro žilní krev na jasně červenou barvu tepenné krve. V lidském organismu je asi 98,5 %[1]kyslíku vázáno právě na hemoglobin.
Karbaminohemoglobin
Karbaminohemoglobin je hemoglobin, na kterém je navázaný CO2. Oxid uhličitý se váže na globinový řetězec hemoglobinu. Vazba CO2 na hemoglobin snižuje afinitu hemoglobinu ke kyslíku.
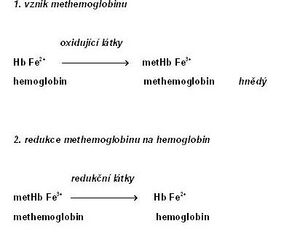
Methemoglobin
Methemoglobin (metHb; též hemiglobin nebo ferihemoglobin[2]) je charakterizován přítomností trojmocného železa, které vzniká oxidací dvojmocného železa v hemoglobinu[3]. Methemoglobin ztrácí schopnost reverzibilně vázat kyslík. Na jeho místě váže FeIII+ šestou koordinační vazbou molekulu vody. Barva methemoglobinu je čokoládově hnědá.
Methemoglobin je v erytrocytech v malém množství přítomen i fyziologicky (asi 1–3 % celkové koncentrace hemoglobinu[4]). Děje se tak především účinkem dusitanů, které vznikají z dusičnanů obsažených v potravě. Zpětnou redukci methemoglobinu na hemoglobin zajišťuje především NADH-dependentní cytochrom-b5 reduktáza (též methemoglobinreduktáza). Menší roli hraje NADPH-dependentní methemoglobinreduktáza, která je závislá na dodávce NADPH z pentózového cyklu a na přítomnosti dalšího elektronového přenašeče (např. flavinu).[5] Neenzymové mechanismy zahrnují působení glutathionu a kyseliny askorbové.
Zvýšená koncentrace methemoglobinu v krvi se označuje jako methemoglobinemie. Příčiny vzniku jsou různé:
- Dědičná methemoglobinemie je obvykle způsobena vrozeným defektem NADH-dependentní methemoglobinreduktázy nebo přítomností abnormálního hemoglobinu M.
- Získaná methemoglobinemie je nejčastější formou methemoglobinemie. Může být vyvolána působením oxidujících látek[6]:
- otravou některými látkami (nitrobenzen, anilin a jeho deriváty – např. některá barviva),
- působením některých léků (lokální anestetika – benzokain, dále fenacetin, sulfonamidy),
- zvýšeným obsahem dusičnanů a dusitanů ve vodě a v potravinách.
Na zvýšený obsah těchto látek jsou zvláště citliví novorozenci v důsledku nezralosti redukčních systémů a zvýšeného podílu fetálního hemoglobinu, který se snáze oxiduje. Methemoglobinemie se projevuje cyanózou s charakteristickým šedohnědým odstínem a hypoxií.
| Hodnoty methemoglobinu | Příznaky |
|---|---|
| 0–2 % | normální hodnota |
| < 10 % | cyanóza |
| < 35 % | cyanóza a další příznaky (bolest hlavy, dušnost) |
| 70 % | smrtelná koncentrace |
Součástí terapie získané methemoglobinemie je podávání některých redukčních činidel – methylénové modři nebo kyseliny askorbové.
Karbonylhemoglobin
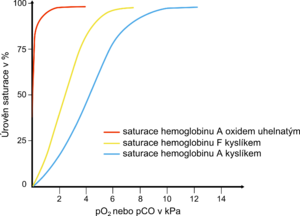
Karbonylhemoglobin (COHb, karboxyhemoglobin) vzniká vazbou oxidu uhelnatého na hemoglobin. Vytvořená vazba je 250–300krát silnější než vazba kyslíku. Karbonylhemoglobin nemůže transportovat kyslík a v důsledku snížené schopnosti krve přenášet kyslík se vyvíjí buněčná hypoxie. V nadbytku kyslíku je vazba oxidu uhelnatého na hemoglobin reverzibilní. Proto je při otravě oxidem uhelnatým nejdůležitější inhalace O2.
V malém množství se COHb může vyskytnout i u zdravých osob. U obyvatel měst se prokazují hodnoty kolem 2 %, u silných kuřáků může COHb stoupnout až na 10 % z celkového hemoglobinu. Několikaminutový pobyt v prostředí obsahující 0,1 % CO může zvýšit koncentraci karbonylhemoglobinu na 50 %.
Oxid uhelnatý vzniká při nedokonalém spalování paliv, dále je obsažen ve výfukových plynech a v kouři při požárech v uzavřených místnostech.
| Hodnoty COHb v % | Příznaky |
|---|---|
| 10 | při větší námaze dušnost |
| 20–40 | bolesti hlavy, dušnost, únava, zvracení |
| 40–60 | hyperventilace, tachykardie, synkopa, křeče |
| 60–80 | kóma, smrt |
Karbonylhemoglobin se vyznačuje karmínově červeným zbarvením. Proto není zachytitelný běžnou oxymetrií. Těla ponechaná v atmosféře s vysokou koncentrací CO mohou mít „zdravě“ růžovou barvu pleti. U dosud žijících pacientů se však otrava nemusí na barvě pleti vůbec projevit. Ve srovnání s hemoglobinem je karbonylhemoglobin odolnější vůči chemickým vlivům, působením různých činidel se mění pomaleji.
Spektrofotometrie derivátů hemoglobinu
Hemoglobin a jeho deriváty mají ve viditelné oblasti světla charakteristická absorpční spektra, kterých se využívá k jejich analýze a rychlé identifikaci. Pro všechny hemoproteiny jsou typická výrazná absorpční maxima v oblasti 400–430 nm, tzv. Soretův pás. Další absorpční vrcholy jsou podstatně nižší. Oxyhemoglobin je charakterizován dvěma neúplně oddělenými maximy v oblasti 540 a 578 nm. Deoxyhemoglobin má jedno absorpční maximum při 555 nm. Hlavní absorpční maximum methemoglobinu je při 630 nm a druhý nevýrazný vrchol při 500 nm je závislý na pH. Reakcí methemoglobinu s kyanidem draselným mizí maximum při 630 nm, neboť vzniká kyanmethemoglobin. Pokles absorbance při 630 nm je úměrný koncentraci methemoglobinu. Kyanmethemoglobin vykazuje široké absorpční maximum při 540 nm, kterého se využívá při stanovení koncentrace hemoglobinu v krvi. Spektrum karbonylhemoglobinu se podobá spektru oxyhemoglobinu, ale poloha vrcholů je posunuta směrem k nižším vlnovým délkám.
| Derivát hemoglobinu | Absorpční maxima [nm] |
|---|---|
| Hemoglobin redukovaný | 431, 555 |
| Oxyhemoglobin | 414, 540, 578 |
| Methemoglobin | 404, 500, 630 |
| Karbonylhemoglobin | 420, 538–540, 568–569 |
| Kyanmethemoglobin | 421, 540 |
Stanovení karbonylhemoglobinu:
Stanovení karbonylhemoglobinu v krvi patří mezi základní toxikologická vyšetření. Je objektivním kritériem při hodnocení akutních i chronických otrav oxidem uhelnatým.
- Spektrofotometrické hodnocení. Karbonylhemoglobin lze stanovit rychle spektrofotometricky na základě odečtení posunu absorpčního maxima ředěné krve od 586 nm[7]. Posun maxima ve spektru je závislý na poměru COHb a O2Hb ve vzorku.
- Reakce s taninem. Orientačně lze karbonylhemoglobin stanovit reakcí s taninem nebo Ajatinem (asi od 10 % COHb). Tanin vytváří v přítomnosti karbonylhemoglobinu jahodově červenou sraženinu. V nepřítomnosti karbonylhemoglobinu je zbarvení sraženiny hnědošedé.
- Analyzátory acidobazické rovnováhy. Analýzu toxikologicky nejdůležitějších derivátů hemoglobinu COHb a metHb umožňují rovněž moderní analyzátory acidobazické rovnováhy, které mají zabudovaný fotometrický systém pro jejich měření.
Odkazy
Reference
- ↑ KITTNAR, Otomar a ET AL.. Lékařská fyziologie. 1. vydání. Praha : Grada, 2011. 790 s. s. 131. ISBN 978-80-247-3068-4.
- ↑ ŠVÍGLEROVÁ, Jitka. Hemoglobin [online]. Poslední revize 2009-02-18, [cit. 2010-11-11]. <https://web.archive.org/web/20160416205421/http://wiki.lfp-studium.cz/index.php/Hemoglobin>.
- ↑ ŠVECOVÁ, D a D BÖHMER. Vrozená a získaná methemoglobinémia a ich liečba. Časopis lékařů českých. 1998, vol. 137, s. 168-170, ISSN 1803-6597.
- ↑ RICHARD, Alyce M, James H DIAZ a Alan David KAYE. Reexamining the risks of drinking-water nitrates on public health. Ochsner J [online]. 2014, vol. 14, no. 3, s. 392-8, dostupné také z <https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4171798/?tool=pubmed>. ISSN 1524-5012.
- ↑ XU, F, K S QUANDT a D E HULTQUIST. Characterization of NADPH-dependent methemoglobin reductase as a heme-binding protein present in erythrocytes and liver. Proc Natl Acad Sci U S A [online]. 1992, vol. 89, no. 6, s. 2130-4, dostupné také z <https://www.ncbi.nlm.nih.gov/pmc/articles/PMC48610/?tool=pubmed>. ISSN 0027-8424.
- ↑ CORTAZZO, Jessica A a Adam D LICHTMAN. Methemoglobinemia: a review and recommendations for management. J Cardiothorac Vasc Anesth [online]. 2014, vol. 28, no. 4, s. 1043-7, dostupné také z <https://www.ncbi.nlm.nih.gov/pubmed/23953868>. ISSN 1053-0770 (print), 1532-8422.
- ↑ LEDVINA, M. Rychlé spektrofotometrické stanovení karbonylhemoglobinu v krvi. Biochem Clin Bohemoslov. 1987, vol. 16, s. 493-495, ISSN 0139-9608.