Kolorektální karcinom
(přesměrováno z Karcinom tlustého střeva a konečníku)
| kolorektální karcinom | |
| C18, C19, C20 | |
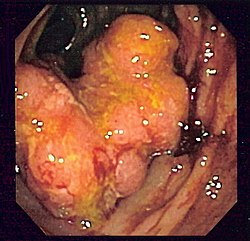
 Histologie: tubulární adenokarcinom, barveno HE | |
| Lokalizace | tlusté střevo a rectum |
|---|---|
| Incidence v ČR | 36,79/100 000 obyv. (2012) |
| Maximum výskytu | 70–80 let |
| Prognóza | viz text |
| Histologický typ | adenokarcinom (95 %) |
| Součást syndromu | Lynchův syndrom, Familiární adenomatózní polypóza |
| Terapeutické modality | chirurgie, radioterapie, chemoterapie |
Kolorektální karcinom (KR-CA) je maligní nádorové onemocnění zaujímající třetí příčku mezi celosvětově nejčastěji se vyskytujícími malignitami. V roce 2012 bylo celosvětově diagnostikováno téměř 1,4 milionu nových případů. [1] V ČR incidence KR-CA rok od roku stoupá. [2] Vedle vysoké a neustále stoupající incidence má toto onemocnění i vysokou mortalitu způsobenou zejména převládající diagnostikou onemocnění až v pokročilých stádiích, kdy jsou léčebné postupy omezené. Proto je dnes snaha o efektivní screening u obyvatel nad 50 let. Z hlediska prognózy a léčebného postupu je vhodné od sebe odlišovat karcinom tračníku a karcinom rektosigmatu a rekta.
Epidemiologie
KR-CA je onemocnění vyskytující se především ve vyspělých zemích. Nejvyšší incidence z hlediska kontinentů je v Evropě a Oceánii, zatímco nejnižší je v Africe a Asii. Mezi čtyři země s celosvětově nejvyšším výskytem KR-CA u obou pohlaví v roce 2012 patřily Jižní Korea, Slovensko, Maďarsko a Nizozemí. [1]
Česká republika zaujímá přední příčky v celosvětové incidenci, ať už u mužského (v roce 2012 4. místo)[1] nebo ženského pohlaví (v roce 2012 16. místo)[1]. Z hlediska dlouhodobého vývoje v České republice incidence kolorektálního karcinomu v posledních 30 letech stále roste, během stejného období rostla i mortalita.[3] V roce 2013 byla v ČR incidence zhoubných nádorů tlustého střeva a konečníku (diagnóza C18–C21) 76,74/100 000 obyvatel [4] a mortalita 35,35/100 000 obyvatel. [4] Aktuální informace o incidenci a mortalitě KR-CA v ČR můžete najít na stránkách Institutu biostatistiky a analýz Masarykovy univerzity.
Symptomatologie
Klinický obraz KR-CA závisí na jeho lokalizaci v tlustém střevě a způsobu růstu, může být tedy velmi různorodý.
Nejvýraznějším projevem je obturace střeva, pokud nádorová masa vyplní celé střevní lumen – klinicky pak pacient přichází s ileem. Časnějšími a ne tak klinicky výraznými projevy obturace střeva mohou být nadměrná plynatost, změna defekačního stereotypu, kolikovité bolesti nebo subileózní stav. Ne zřídka se stává, že je nádor objeven až při ileózních komplikacích. [2]
Dalším klinicky výrazným projevem je krvácení z nádoru do GIT, buď mikroskopické nebo makroskopické. Mikroskopického krvácení si pacient ani nemusí všimnout, proto využíváme jako screeningové vyšetření test okultního krvácení do stolice (TOKS), který detekuje i malé množství krve ve stolici. Pokud je krvácení masivnějšího rozsahu nebo probíhá dlouhodobě, může mít pacient příznaky anémie.
Akutní peritonitida způsobená perforací nádoru patří mezi vzácnější projevy onemocnění, stejně tak jako penetrace nádoru do okolí a vznik hmatné rezistence.
Specifickým příznakem KR-CA vyskytující se v oblasti konečníku jsou tenesmy.
Etiologie
KR-CA se vyskytuje ve sporadické a v hereditární formě, kdy má jedinec pro rozvoj onemocnění vyšší genetickou predispozici než zbytek populace. Jedná se především o Lynchův syndrom I a II a familiární adenomatózu tlustého střeva (FAP). Hereditární podklad se diagnostikuje asi v 10 % onemocnění[5], dominuje tak sporadický výskyt (90 %).
Nicméně i u sporadické formy KR-CA známe rizikové faktory (RF), které i geneticky nezatíženému jedinci zvyšují pravděpodobnost onemocnění. Jako u většiny nádorových onemocnění i u KR-CA, je jedním z hlavních RF vyšší věk, nejohroženější jsou zejména osoby od 70 do 80 let. Dále pak:
- jiná onemocnění tlustého střeva – výskyt střevních adenomů v anamnéze a chronické střevní záněty, zejména ulcerózní kolitida;
- hyperinzulinémie;
- obezita;
- kouření;
- stravovací návyky – riziková je zejména častá konzumace červeného masa, nadměrný příjem živočišných tuků a nedostatečný příjem vlákniny ve stravě.
Vedle RF jmenujme faktory protektivní. Patří sem již zmíněná vláknina, omega–3 polynenasycené mastné kyseliny, kyselina listová a užívání hormonální antikoncepce.
Screening
Stejně jako u všech ostatních hojně se v populaci vyskytujících malignit byla i v případě kolorektálního karcinomu (KR-CA) snaha vytvořit v rámci sekundární prevence efektivní screening pro záchyt časných fází onemocnění. V ideálním případě prekanceróz (adenomů). Mezi hlavní problémy stále dosti vysoké mortality KR-CA patří totiž fakt, že ve většině případů je diagnostikován až ve velmi pokročilém stádiu. KR-CA už tak dnes můžeme označit jako jednu ze tří malignit, pro kterou je u nás prováděn celoplošný screening (dále pro karcinom prsu a karcinom děložního čípku), který efektivně snižuje morbiditu i mortalitu tohoto onemocnění v populaci.
- Screeningové metody
Mezi základní screeningové metody KR-CA u nás patří:
- Test okultního krvácení do stolice (TOKS) – dle čtyř randomizovaných studií byla díky zavedení TOKS snížena mortalita na KR-CA u lidí ve věku 50–80 let o 15–33 %. [6]
- Primární screeningová kolonoskopie – také prokazatelně snižuje riziko mortality KR-CA.[6]
- Postup screeningu
Screening KR-CA je prováděn a hrazen pojišťovnou pro asymptomatické muže a ženy ve věku nad 50 let. Ze screeningového programu jsou ovšem vyjmuti všichni rizikoví pacienti s pozitivní osobní nebo rodinnou anamnézou, pro tyto jedince jsou vypracovány zvláštní dispenzární programy odvislé od jejich rizika. [7]
Jedince v rámci screeningu KR-CA dělíme na dvě skupiny podle věku a v rámci těchto dvou skupin se liší vyšetřovací postup:
- Osoby ve věku 50–54 let
- Jednou ročně je pacientovi proveden buď u praktického lékaře nebo gynekologa TOKS. Pokud je výsledek testu negativní (TOKS-), provede se stejný test pacientovi znovu po jednom roce. V případě pozitivního výsledku (TOKS+) je pacient odeslán do specializovaného zařízení na screeningovou kolonoskopii. Pokud je nález na kolonoskopii negativní, dostaví se pacient na další screeningové vyšetření až za 10 let, pokud je pozitivní, je pacient z hlediska screeningu KR-CA zařazen do vysoce rizikové skupiny se zvláštním dispenzárním programem. [7]
- Osoby nad 55 let
- U těchto osob se vedle TOKS užívá i primární screeningová kolonoskopie. Pacient má možnost výběru.
- TOKS – v případě TOKS- je buď test opakován po dvou letech, a nebo je provedena primární screeningová kolonoskopie. V případě TOKS+ je pacient stejně jako v předchozí skupině odeslán na screeningovou kolonoskopii. [7]
- Primární screeningová kolonoskopie – je alternativní metodou k TOKS. V případě negativního výsledku je provedena znovu za 10 let, v případě výsledku pozitivního je pacient z hlediska screeningu KR-CA zařazen do vysoce rizikové skupiny se zvláštním dispenzárním programem. [7]
Význam koloskopického vyšetření v rámci screeningu se patrně zvýší s rozvojem neinvazivních virtuálních kolonoskopických metod. [6]
Nově se do praxe zavádějí molekulárně-genetické screeningové techniky, které mají podstatně vyšší citlivost. Jsou založené na průkazu mutací a aberantních metylací typických pro buňky adenokarcinomu nebo pokročilého adenomu[8].
Diagnostika
Anamnestické údaje
Ačkoli by se mohlo zdát, že v době moderních technologií jako je CT, MRI a PET CT je odebírání anamnézy něco archaického, existuje celý soubor příznaků, který může především praktického lékaře navést ke správné diagnóze. Symptomy často vycházejí z lokalizace nádoru na tlustém střevě:
- viditelná čerstvá krev ve stolici – objevuje se především u aborálně lokalizovaných nádorů (dif. dg.: hemoroidy, IBD);
- anemizace – poměrně častý jev, vzniká důsledkem chronického krvácení nevelkého rozsahu z exulcerovaného nádoru, typické především pro nádory céka a pravé poloviny kolon, kde má střevo větší průsvit, a proto má nádor dostatek času pro svůj růst, než začne způsobovat potíže typu poruchy pasáže;
- změny frekvence vyprazdňování – může se jednat jak o obstipaci tak průjmy, opět je typičtější spíše pro levou polovinu tračníku (descendens, sigmoideum, rektum, které mají užší průsvit než předchozí části tračníku), pacient například sdělí lékaři, že celý život chodil na stolici každý den a poslední 2 měsíce stěží dvakrát týdně;
- tenesmy – u karcinomu rekta;
- hubnutí – sice vcelku nespecifický příznak, ale častý u řady onkologických onemocnění (nejen GIT);
- dyspeptické obtíže, celková slabost, kachektizace, …
- perforace střeva nebo ileus mohou být naneštěstí také stavem, který vede ke zjištění malignity, jedná se o pokročilé případy, je to velmi negativní prognostické znamení.[9][10][11]
Vyšetřovací metody
- Fyzikální vyšetření
Příznaky celkové anémie jako bledost spojivek a kůže, kachektizace [10]. Vyšetření per rectum samotné může odhalit nádor v oblasti recta a nebo odhalit krev ve stolici[10], proto by nemělo být v případě podezření na patologii GIT opomíjeno praktickými lékaři a už vůbec ne chirurgy. Význam vyšetření per rectum jako screeningového vyšetření nebyl doložen, u symptomatického jedince je ale základním vyšetřením, které by mělo být provedeno vždy. [10]
- Koloskopie
Přínos tohoto vyšetření je téměř nedocenitelný, jedná se o vyšetření první volby. Kromě diagnostiky (vizualizace a odebrání biopsie) totiž umožňuje v některých zvláštních případech i kurativní zákrok spočívající ve snesení prekancerozy nebo dokonce nádoru (T1). Pomocí koloskopie lze použít i endosonografickou sondu, díky které lze v rámci stagingu (karcinomu rekta především) zjišťovat hloubku infiltrace ve stěně střeva, případně i jiných orgánech. Dále lze pomocí koloskopie aplikovat do místa nádoru tuš, která chirurgům usnadní hledání během operace.
- Dvojkontrastní irrigografie
Jedná se o RTG vyšetření břicha s dvojitým kontrastem (baryová suspenze a vzduch), provádí se ve chvílích, kdy z důvodu obturace lumen nebo špatných anatomických poměrů není možné provést kolonoskopii. Vyšetření je nutné doplnit o rektoskopii, kvůli případným nádorům rekta. Nevýhodou je zejména fakt, že nelze odebrat bioptické vzorky ani odstranit případné polypy.
- Laboratoř
Kromě známek anémie (hypochromní, mikrocytární) z chronického krvácení[10] jsou nasnadě nádorové markery. V případě kolorektálního karcinomu jde především o sérové koncentrace CEA a Ca 19–9[10]. Je velmi důležité si uvědomit, že jejich přínos není v diagnostice onemocnění, protože jsou nespecifické. Například zvýšené Ca 19–9 se vyskytuje nejen u karcinomu pankreatu a žlučových cest, ale dokonce i u benigní obstrukce žlučových cest. Přínos je tedy ve sledování účinků terapie (klesá = účinná chemoterapie, stoupá = relaps onemocnění) a potom také prognostický přínos. Vysoké CEA v době diagnózy onemocnění je negativní prognostický faktor.
- CT
CT vyšetření má svůj význam v zjišťování uzlinových a vzdálených metastáz, především v játrech, plicích, kostech a CNS. Definitivně se tak určí strategie terapie (kurativní resekce versus paliace, užití neoadjuvance, adjuvance). Provádíme CT břicha a u karcinomu rekta i předoperační CT malé pánve, pro zhodnocení rozsahu tumoru, případného metastatického šíření. Dle výsledků se rozhoduje o případné neoadjuvantní radioterapii u rozsáhlejších karcinomů rekta.
- MRI
Magnetická rezonance dominuje u karcinomu rekta. Zde je nezbytně důležité zjistit míru infiltrace orgánů malé pánve (močový měchýř, ureter, vagina, ale i os sacrum), udělat staging a rozhodnout o typu resekce.
- Ultrasonografie
Klasická sonografie břicha má význam u zjišťování postižení jater metastázami, zejména předoperačně a ke zhodnocení retroperitoneálních uzlin.
- Endosonografie
Endoskopická sonografie má význam především u karcinomů rekta. Díky této technice lze zjistit hloubku invaze nádorového postižení, tj. do které vrstvy střevní stěny až zasahuje, nebo nepostihuje-li blízké lymfatické uzliny či okolní orgány. Slouží tak ke stanovení stagingu onemocnění a plánování následného chirurgického výkonu.
- RTG hrudníku
Slouží k vyloučení metastatického postižení plic, provádíme v zadopřední projekci. Dále jako předoperační vyšetření.
Patologie
Prekancerózy
Za prekancerózu jsou považovány dysplastické adenomy (nádorové polypy) a další intraepitelové neoplázie, například DALM (Dysplasia Associated Lesions or Masses) u ulcerózní kolitidy. Riziko jejich maligního zvratu úzce souvisí se stupněm dysplazie.

Makroskopie
Na základě charakteru růstu lze odvodit možné komplikace onemocnění. Z hlediska makroskopie rozdělujeme KR-CA na tři skupiny:
- exofytické (polypózní) – hlavní riziko je obstrukce lumen střeva (ileus) a vzácně invaginace střeva;
- vyhloubené (exulcerované) – riziko je hlavně krvácení a perforace střevní stěny s následnou peritonitidou;
- ploché (infiltrující) – dlouho mohou zůstávat klinicky němé.
Jako anulární karcinom nazýváme hlavně levostranné karcinomy rostoucí po celém obvodu střeva a vedoucí tak poměrně brzy ke stenózám se všemi důsledky. Naopak pravostranné karcinomy rostou především exofyticky.
- Lokalizace nádorů dle četnosti [5]
- levý tračník – 64 %;
- rektum – 30 %;
- sigmoideum – 26 %;
- colon descendens – 8 %;
- colon transverzum – 13 %;
- colon ascendens – 9 %;
- caecum – 14 %.
Mikroskopie
Mikroskopicky se jedná především o adenokarcinom (v 95 % [1] ), rozlišujeme pak jejich diferenciaci:
- G1 – dobře diferencovaný (tubulární nebo papilární);
- G2 – středně diferencovaný;
- G3 – nízce diferencovaný (solidně uspořádané) – s horší prognózou.
Dále máme ještě několik vzácnějších typů KR-CA – mucinózní (hlenotvorný) adenokarcinom (pro který je, jak název napovídá, typická tvorba extracelulárního hlenu), karcinom adenoskvamoźní a karcinom z prstenčitých buněk.
Staging
Ke klasifikaci KR-CA běžně používáme 2 klasifikační systémy
- TNM klasifikaci,
- Dukes systém.[12]
| Stádium | Popis |
| Stádium A | tumor ohraničen střevní stěnou |
| Stádium B | tumor zasahuje nebo proniká serózou |
| Stádium C1 | tumor + pozitivní perikolické lymfatické uzliny |
| Stádium C2 | tumor + pozitivní perivaskulární uzliny |
| Stádium D | vzdálené metastázy |
- Srovnání TNM klasifikace a Dukes systému [2]
| Stádium 0 | Tis | N0 | M0 | Dukes A |
| Stádium 1 | T1 | N0 | M0 | Dukes A |
| T2 | N0 | M0 | DukesA | |
| Stadium 2 | T3 | N0 | M0 | Dukes B |
| T4 | N0 | M0 | Dukes B | |
| Stadium 3 | T1–4 | N1–3 | M0 | Dukes C |
| Stadium 4 | T1–4 | N1–3 | M1 | Dukes D |
Metastazování
KR-CA metastazuje, jako většina karcinomů, primárně lymfogenně – do lokálních lymfatických uzlin. Později pak do vzdálených lymfatických uzlin a hematogenně nejčastěji do jater a plic. Pokročilé onemocnění se může šířit po peritoneu (tzv. karcinomatóza peritonea). Karcinomy rekta mají tendenci prorůstat do okolních orgánů (vagina, uterus, ureter, močový měchýř, ale i os sacrum). U žen je typický i výskyt metastáz ve vaječnících. Metastatický proces a komplikace s ním související může být v některých případech odhalen i dříve než samotný primární nádor.
Terapie
Způsob léčby KR-CA lze určit až po kompletním vyšetření pacienta a stanovení stagingu onemocnění. Každý pacient by měl být zkonzultován na indikačním semináři a výsledná léčba by měla být výsledkem konsenzu onkologa, chirurga, gastroenterologa, popřípadě i patologa. Terapeutický postup se také musí vždy odvíjet od celkového zdravotního stavu pacienta a jeho přání.
Mezi léčebné modality využívané k léčbě KR-CA patří metody endoskopické, chirurgické a onkologické. Zpravidla se nejdříve přistupuje k odstranění nádorové masy, buď endoskopicky nebo častěji chirurgicky, a poté následuje systémová onkologická léčba. Popřípadě u rozsáhlých tumorů předchází chirurgickému řešení ještě neoadjuvantní onkologická terapie.
Mírně se liší postupy terapie u KR-CA lokalizovaného v kolon a v rektu.
Endoskopická léčba
Nezastupitelný je její význam zejména v diagnostice onemocnění a následné dispenzarizaci pacientů po léčbě. Využívá se zejména ke kurativní léčbě prekanceróz (adenomů) nebo velmi časných stádií KR-CA (carcinoma in situ, pT1), popřípadě k paliativní léčbě ke zprůchodnění stenóz střeva způsobených nádorem (zavedení stentu).
- Kurativní léčba
Dle rozsahu léze užíváme:
- polypektomii (EPE),
- endoskopickou mukozální resekci (EMR),
- endoskopickou submukózní disekci (ESD) – odstranění polypu dohromady i se submukózou.
U pacientů s diagnózou KR-CA pT1 rozhodujeme mezi endoskopickým nebo chirurgickým řešením podle dalších parametrů. U příznivých nádorů dostačuje endoskopická léčba, nicméně u tzv. vysokorizikových pT1 karcinomů přistupujeme k následnému chirurgickému řešení. Kritéria vysokorizikového karcinomu:
- inkompletní odstranění nebo odstranění po částech (ne en block);
- vzdálenost od resekčních okrajů 1 mm a menší;
- nízká diferenciace;
- průkaz invaze do lymfatických cév v histologickém preparátu.
U těchto nemocných provádíme chirurgickou resekci s radikální lymfadenektomií stejně jako u pokročilejších stádií KR-CA.
- Paliativní léčba
Aplikace metalického stentu se využívá buď u akutních střevních obstrukcí k přečkání doby do operačního řešení, popřípadě u inoperabilních a generalizovaných karcinomů v posledních stádiích ke zlepšení kvality života pacienta. Podle různých studií je ale prospěšnost těchto postupů poněkud sporná. Měla by se využívat pouze u pečlivě indikovaných případů po mezioborové konzultaci. U pacientů indikovaných k biologické léčbě bevacizumabem je prokázáno vyšší riziko perforací. [13]
Chirurgická léčba
Stále jedinou kurativní léčbou kolorektálního karcinomu je onkoradikální resekce (s výjimkou velmi časných stádií řešitelných endoskopicky, viz předchozí odstavec). Indikuje se vždy, když je možné provést kurativní radikální (R0) resekci, tedy odstranit celou nádorovou masu. Popřípadě i z paliativních důvodů, obdobně jako u endoskopické léčby, ke zprůchodnění střevního lumen a tím k prodloužení a zlepšení kvality života pacienta.
- Resekce tračníku
U karcinomu kolon využíváme radikální resekci postiženého úseku střeva společně s odstraněním závěsu (mesocolon). Výhodou tohoto postupu je odstranění většího množství lymfatických uzlin (alespoň 12), odstranění i potenciálně nádorem poškozené tkáně a s omezením pooperačního nádorového rozsevu. Radikalitu dodržujeme i u časnějších stádií (T1, T2). Pokud se nádor nepříznivě nachází v povodí dvou zásobujících tepen, přistupujeme ještě k radikálnějším výkonů – rozšířená resekce, případně subtotální kolektomie (odstranění celého tlustého střeva, s ponecháním rekta a založením ileorektální anastomózy). Vzdálenost na aborálním konci by měla být minimálně 5 cm od tumoru. Pro rozsah resekce je určující rozsah disekce lymfatických uzlin (a cév) podél arteriálního zásobení, kdy dochází k podvazu v blízkosti odstupu kmenů tepen (vysoká ligatura):
- pravá hemikolektomie – ligatura a. ileocolica, a. colica dextra a ramus dexter arteriae colicae mediae (nádor vzestupného tračníku);
- rozšířená pravá hemikolektomie – ligatura a. ileocolica, a. colica dextra a navíc ještě a. colica media (pro tumory ve flexura coli dextra);
- levá hemikolektomie – ligatura a. colica sinistra (nádor sestupného tračníku);
- rozšířená levá hemikolektomie – ligatura a. colica sinistra a a. colica media (nádor při flexura coli sinistra);
- resekce sigmatu – ligatury a. mesenterica inferior.[14]
Laparoskopický přístup je využívanou alternativou ke klasickému postupu, zejména pak u nádorů levostranného kolon. [13]
- Resekce rekta
Nejpoužívanější postup je totální mezorektální excize (TME), která významně omezuje výskyt lokálních recidiv. Prognostickým faktorem pro úspěšnost TME je hlavně pozitivita resekčních okrajů. V dnešní době užíváme moderní miniinvazivní, robotické a laparoskopické metody, které jsou však stále dostatečně radikální, zároveň ale pro pacienta méně mutilující. Chirurgické výkony lze rozdělit na:
- Kurativní výkony (potenciálně):
- standardní operace – resekce rekta (+ mesorekta), může být s amputací sfinkteru, ale i sfinkter zachovávající (i ta je dostatečně onkoradikální);
- extenzivní operace – resekce rekta, mesorekta a abdominopelvických lymfatických uzlin a cév;
- ultraextenzivní operace – navíc s resekcí vnitřních iliackých cév.[14]
- Paliativní výkony spočívají v:
- odstranění nádoru – ve většině případů je lepší nádor odstranit, i když je pro staging onemocnění nebo celkový stav pacienta vyloučena kurativní resekce, každý rostoucí nádor pacienta ohrožuje vznikem ilea, perforací stěny střevní, rozpadem nádoru (nekróza);
- řešení překážky v pasáži střeva (tou je nádor) – stomií nebo bypassem;
- léčbě bolesti.
- Resekce jaterních metastáz
Játra jsou orgánem, kde nejčastěji nalézáme metastázy KR-CA a jejich léčba úzce souvisí s prognózou pacienta.
- Standardní předoperační vyšetření [2]
- Kolonoskopie s biopsií – pokud není možné tak dvojkontrastní irigografie,
- sonografie jater
- CT jater – při nejasném nálezu nebo nálezu jaterních metastáz na sono,
- CT malé pánve,
- RTG plic
- CT plic – při nálezu metastáz na RTG
- bronchoskopie – při podezření na metastázy, k vyloučení duplicity,
- urologické vyšetření – při hematurii nebo urologických potížích s podezřením na progresi onemocnění,
- gynekologické vyšetření,
- stanovení onkomarkerů – CEA, CA 19–9,
- u karcinomu rekta: transrektální sonografie, anorektální manometrie.
Onkologická léčba
Téměř každý pacient s KR-CA podstupuje onkologickou léčbu v nějaké z jejích podob – radioterapie, chemoterapie, biologická léčba. Dle léčebné sekvence rozlišujeme neoadjuvantní, adjuvantní a samostatnou onkologickou léčbu. Radioterapie má využití zejména u karcinomu rekta, neboť je k ní vysoce senzitivní a navíc má velkou náchylnost k lokoregionálnímu šíření (karcinom kolon zakládá spíše vzdálené metastázy), aplikujeme dávku 30 Gy. [15]
- Neoadjuvantní léčba
Neoadjuvantní léčbu využíváme zejména u karcinomu rekta – buď radioterapii samostatně nebo v kombinaci s chemoterapií (tj. chemoradioterapii). U rozsáhlých tumorů (T3–T4, N+) při neoadjuvantní (předoperační) léčbě dochází ke zmenšení nádorové masy (tzv. downstaging), a tím k lepší operabilitě nálezu (vyšší procento sfinkter zachovávající operací), zvýšení procenta kurativních resekcí a nižšímu výskytu lokálních recidiv. Nicméně nebylo potvrzeno celkově delší přežití pacientů podstupujících neoadjuvantní terapii. [13] Kombinace chemo- a radioterapie je provázená poněkud vyšší toxicitou. Obecně musíme indikaci neoadjuvantní terapie zvažovat vzhledem ke stavu pacienta, aby významně nezhoršovala kvalitu jeho života. Chemoterapeutikem volby je 5-fluoruracil (5-FU), alternativou pak kapecitabin (p.o.), případně v kombinaci s oxaliplatinou či irinotekanem. [16]Především v kombinacích jako FOLFOX (leukovorin, 5-FU, oxaliplatina).
Leukovorin je biomodulátor a přidává se z důvodu zvýšení účinku 5-FU a snížení toxicity.
- Adjuvantní léčba
Pokud je to po chirurgické léčbě nutné, přichází na řadu systémová léčba, jejímž cílem je odstranit případné mikrometastázy, zabránit dalšímu šíření onemocnění nebo případnému relapsu. O zahájení adjuvantní léčby se rozhodujeme znovu podle stavu pacienta a vlastností nádoru. Obecně se doporučuje zejména u stádia III, kde zvyšuje dlouhodobé přežití bez známek onemocnění až o 30 % a u nádorů stadia II s vysokým rizikem recidivy. [13] Adjuvantní chemoterapie zlepšuje výsledky 5letého přežití o 10 %. [2]
- Samostatná onkologická léčba
Paliativní samostatnou onkologickou léčbu užíváme u pacientů s inoperabilním pokročilým nálezem, prodlužujeme jednak medián progrese onemocnění a také medián přežití. [13]
- Cílená léčba
Novinkou v léčbě KR-CA v posledních 10 letech je zavedení cílené léčby, někdy také označované jako biologická léčba. V aplikaci spolu s chemoterapií zvyšuje její účinnost (zvýšení léčebné odpovědi a prodloužení mediánu přežití pacientů). Principem cílené léčby je ovlivňování konkrétních signálních drah nutných k růstu nádoru. V ČR se nyní k cílené léčbě využívají tři léčiva: bevacizumab (protilátka proti vaskulárnímu endoteliálnímu růstovému faktoru A – VEGF-A), cetuximab a panitumumab (inhibitory receptoru pro epidermální růstový faktor – EGFR). [17]
Shrnutí
Obecné rizikové faktory:
- méně než 12 resekovaných lymfatických uzlin;
- nízký stupeň diferenciace nádoru (grade 3 a 4);
- prorůstání nádoru celou stěnou střeva (T4);
- perforace nebo obstrukce střeva jako primární projev nádoru;
- angioinvazie, lymfangioinvaze nebo perineurální invaze;
- neznámé resekční okraje;
- zvýšená hladina karcinoembryonálního antigenu (CEA);
- mucinózní složka nádoru.
Strategie léčby dle stagingu onemocnění v době diagnózy: [18]
| St. I | chirurgická léčba |
| St. II | chirurgická léčba (v případě N1 NX následuje chemoterapie) |
| St. III | operace a vždy chemoterapie |
| St. IV | resekce, nebo indukční terapie a pak resekce, nebo paliativní léčba |
Prognóza
Pětileté přežití jedinců s KR-CA se liší dle stádia, ve kterém je onemocnění zachyceno. [2]
| Stádium | Pětileté přežití |
|---|---|
| St. 0 a 1 | 80–90 % |
| St. 2 | 60–80 % |
| St. 3 | 50–60 % |
| St. 4 | 4–10 % |
Obecně lze říci, že je mnohem větší šance na pětileté přežití u jedinců, kteří jsou v době diagnostikování onemocnění bezpříznakoví (90 %), oproti jedincům, kteří mají v době stanovení diagnózy potíže trvající tři (40 %) nebo sedm (25 %) měsíců.[2] Prevence a screeningový program jsou proto u tohoto onemocnění významné.
Odkazy
Související články
- Léčba jaterních metastáz u kolorektálního karcinomu
- Vídeňská klasifikace gastrointestinálních neoplazií (2002)
Externí odkazy
- Kolorektální karcinom - článek v časopisu Onkologická péče
- Zdravi.e15 - Terapie kolorektálního karcinomu (4/2012)
- Atlas patologie pro studenty medicíny – tlusté střevo
- Cancer research UK - Duke`s stages of bowel cancer
- Česká společnost HPB chirurgie: Návrh standardu chirurgické léčby kolorektálního karcinomu
Reference
- ↑ Skočit nahoru k: a b c d e WORLD CANCER RESEARCH FUND INTERNATIONAL,. Colorectal cancer statistics [online]. World Cancer Research Fund International, ©2015. Poslední revize 16/01/2015, [cit. 2015-11-13]. <https://www.wcrf.org/dietandcancer/cancer-trends/colorectal-cancer-statistics>.
Chybná citace: Neplatná značka
<ref>; název „statistics“ použit vícekrát s různým obsahem Chybná citace: Neplatná značka<ref>; název „statistics“ použit vícekrát s různým obsahem - ↑ Skočit nahoru k: a b c d e f g Česká gastroenterologická společnost ČLS JEP. Kolorektální karcinom - diagnostika a léčba [online]. [cit. 2015-11-13]. <http://www.cls.cz/seznam-doporucenych-postupu>.
Chybná citace: Neplatná značka
<ref>; název „zavoral“ použit vícekrát s různým obsahem Chybná citace: Neplatná značka<ref>; název „zavoral“ použit vícekrát s různým obsahem Chybná citace: Neplatná značka<ref>; název „zavoral“ použit vícekrát s různým obsahem Chybná citace: Neplatná značka<ref>; název „zavoral“ použit vícekrát s různým obsahem - ↑ svod.cz. Epidemiologie zhoubných nádorů v České republice : Incidence a mortalita [online]. Masarykova univerzita, ©2011. Poslední revize 2011, [cit. 2011-11-30]. <http://www.svod.cz/>.
- ↑ Skočit nahoru k: a b svod.cz. Epidemiologie zhoubných nádorů v České republice : Incidence a mortalita [online]. Masarykova univerzita, ©2012. Poslední revize 2012, [cit. 2015-11-13]. <http://www.svod.cz/>.
- ↑ Skočit nahoru k: a b ČEŠKA, Richard, et al. Interna. 1. vydání. Praha : Triton, 2010. 855 s. ISBN 978-80-7387-423-0.
- ↑ Skočit nahoru k: a b c ČEŠKA, Richard, et al. Interna. 1. vydání. Praha : Triton, 2010. 855 s. s. 412. ISBN 978-80-7387-423-0.
- ↑ Skočit nahoru k: a b c d DUŠEK, L, et al. Kolorektum.cz – Program kolorektálního screeningu v České republice. ISSN 1804-0888 [online]. Kolorektum.cz, ©2015. Poslední revize 23. 2. 2015, [cit. 2015-11-11]. <http://www.kolorektum.cz/index.php?pg=pro-odborniky--organizace--screeningovy-proces>.
- ↑ IMPERIALE, Thomas F, David F RANSOHOFF a Steven H ITZKOWITZ. Multitarget stool DNA testing for colorectal-cancer screening. N Engl J Med [online]. 2014, vol. 371, no. 2, s. 187-8, dostupné také z <https://www.ncbi.nlm.nih.gov/pubmed/25006736>. ISSN 0028-4793 (print), 1533-4406.
- ↑ BURKITT, H. George a Clive R. G QUICK. Essential surgery : problems, diagnosis and management. 4. vydání. Edinburgh; New York : Churchill Livingstone, 2007. 793 s. s. 402-412. ISBN 9780443103469.
- ↑ Skočit nahoru k: a b c d e f ČEŠKA, Richard, et al. Interna. 1. vydání. Praha : Triton, 2010. 855 s. s. 409-412. ISBN 978-80-7387-423-0.
- ↑ ZEMAN, Miroslav, et al. Speciální chirurgie. 2. vydání. Praha : Galén, 2006. 575 s. s. 299-304. ISBN 80-7262-260-9.
- ↑ ZEMAN, Miroslav, et al. Speciální chirurgie. 2. vydání. Praha : Galén, 2006. 575 s. s. 300. ISBN 80-7262-260-9.
- ↑ Skočit nahoru k: a b c d e ZAVORAL, Miroslav, et al. Terapie kolorektálního karcinomu [online]. Zdraví E15, ©2012. Poslední revize 6.4.2012, [cit. 2015-12-02]. <https://web.archive.org/web/20160331222721/http://zdravi.e15.cz/clanek/postgradualni-medicina/terapie-kolorektalniho-karcinomu-464247>.
- ↑ Skočit nahoru k: a b ŠIMŠA, Jaromír. Onkochirurgie [přednáška k předmětu Chirurgie-předstátnicová stáž, obor Chirurgie, 1. LF UK Univerzita Karlova v Praze]. Praha. 2011-10-08.
- ↑ LIPSKÁ, Ludmila a Vladimír VISOKAI. Recidiva kolorektálního karcinomu: komplexní přístup z pohledu chirurga. 1. vyd. Praha: Grada, 2009, 431 s.
- ↑ LIPSKÁ, Ludmila a Vladimír VISOKAI. Recidiva kolorektálního karcinomu: komplexní přístup z pohledu chirurga. 1. vyd. Praha: Grada, 2009, 431 s.
- ↑ [online]. [cit. 2016-1-17]. Dostupné z: https://web.archive.org/web/20160331222721/http://zdravi.e15.cz/clanek/postgradualni-medicina/biologicka-lecba-kolorektalniho-karcinomu-466755.
- ↑ ŠMAKAL, Martin. Komplexní léčení nádorů - role onkologa [přednáška k předmětu Chirurgie - předstátnicová stáž, obor Chirurgie, 1. LF UK Univerzita Karlova v Praze]. Praha. 2011-10-21.
Použitá literatura
- ČEŠKA, Richard, et al. Interna. 1. vydání. Praha : Triton, 2010. 855 s. s. 409-412. ISBN 978-80-7387-423-0.
- POVÝŠIL, Ctibor. Speciální patologie. 2. vydání. Praha : Galén, 2007. 430 s. s. 167-169. ISBN 978-807262-494-2.
- Česká gastroenterologická společnost ČLS JEP. Kolorektální karcinom - diagnostika a léčba [online]. [cit. 2015-11-13]. <http://www.cls.cz/seznam-doporucenych-postupu>.
Doporučená literatura
- PETRUŽELKA, Luboš a Bohuslav KONOPÁSEK. Klinická onkologie. 1. vydání. Praha : Karolinum, 2003. 274 s. ISBN 80-246-0395-0.
- KRŠKA, Zdeněk a David HOSKOVEC, et al. Chirurgická onkologie. 1. vydání. Praha : Grada, 2014. 904 s. ISBN 978-80-247-4284-7.
- KLENER, Pavel. Základy klinické onkologie. 1. vydání. Praha : Galén, c2011. ISBN 9788072627165.