Řízení genové exprese a proteosyntézy u eukaryot
Regulace exprese genů eukaryotických buněk je mnohem obtížněji experimentálně přístupná a tudíž hůře prostudována než regulace u baktérií. Eukaryotické mechanizmy jsou složitější. Přes tyto nesnáze výzkum posledních let objasnil několik regulačních principů na různých úrovních genové exprese. Ukázalo se, že jsou analogické jako u prokaryot, jen poněkud více kombinované. U eukaryot jsou k dispozici další úrovně regulace.
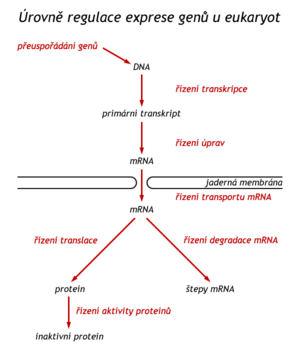
Regulace na úrovni uspořádání genů[upravit | editovat zdroj]
Geny pro rRNA jsou v genomu zastoupeny mnohonásobně, u některých druhů i v mnoha stech kopiích. Během časné embryogeneze je v oocytu třeba v krátké době vytvořit velké množství ribosomů, a tak se geny pro rRNA v genomu dokonce zmnožují – amplifikují (u žáby za těchto okolností zaujmou tři čtvrtiny buněčné DNA). Tato amplifikace na úrovni genu je při syntéze rRNA žádoucí, neboť v tomto případě již nenásleduje další úroveň amplifikace, jakou při expresi genů pro proteiny představuje translace. Většina genů kódujících syntézu bílkovin se v genomu vyskytuje v jediné kopii. Existují však výjimky časté např. v nádorových buňkách. Je to známo o onkogenech myc a c-ras. In vitro se v nádorových buňkách podařilo amplifikovat gen pro reduktázu kyseliny tetrahydrolistové po podání jejího inhibitoru metotrexátu. Buňky se tak staly rezistentnějšími k účinku uvedeného kancerostatika. Dalším mechanizmem regulace proteosyntézy na úrovni DNA je přeuspořádání genů (rearragement) během diferenciace buněk. Je tomu tak v buňkách syntezujících imunoglobuliny. Buňka tak může v průběhu odpovědi na antigen „přepnout“ syntézu jednoho typu Ig na jiný typ.
Regulace na úrovni transkripce[upravit | editovat zdroj]
Indukce syntézy proteinů je možná stejně jako u baktérií též v eukaryotických buňkách. Exogenní induktory působí v tomto smyslu zejména na buňky vystavené výkyvům ve skladbě prostředí (hepatocyty, enterocyty). Při dietě bohaté na proteiny jaterní buňka reaguje indukcí syntézy arginasy, po podání některých léků se v hepatocytech indukuje syntéza enzymů mikrosomálního oxygenasového systému. V živočišných buňkách nejde o regulaci operonových systémů, uspořádání genů a vznikající mRNA jsou v tomto případě odlišné; v eukaryotických buňkách jsou geny přerušovány introny, netvoří se polygenní, nýbrž monogenní mRNA. U eukaryot převažuje pozitivní regulace. V současné době jsou intenzivně studovány zesilovače transkripce (enhancery), které jsou v jaderných buňkách asi častější, než u baktérií. Jsou to sekvence DNA vzdálené i tisíce pb od promotoru.
Byly zjištěny též u DNA virů a retrovirů (součást U3 oblasti v úseku LTR). Na tyto sekvence se navazují regulační proteiny a tím se zvýší aktivita „slabého“ promotoru. Na rozdíl od promotoru zesilovač působí po směru, ale i proti směru transkripce (jestliže je umístěn až za promotorem). Vazba regulačního proteinu na promotor pomáhá vytvořit kličku DNA, přičemž se enhancerový protein naváže ještě na oblast promotoru. Jsou popsány i sekvence DNA, jejichž funkcí je naopak potlačení transkripce (silencers).
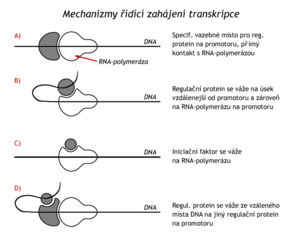
Mezi regulační proteiny vázající se na enhancery patří receptory steroidních hormonů a receptory hormonů štítné žlázy. Tyto lipofilní látky snadno pronikají plazmatickou membránou do cytosolu, kde se vážou na bílkovinné receptory, komplex je pak přenesen do jádra a zde je navázán na příslušný enhancer. Tyto hormony jsou tedy endogenními induktory syntézy určitých mRNA a proteinů. I když je mezi regulací transkripce prokaryot a eukaryot řada rozdílů, principy, kterými regulační proteiny řídí zahájení transkripce jsou analogické. Lze je shrnout takto:
- Regulační protein se váže na své vazebné místo na promotoru (DNA) a je v přímém kontaktu s RNA-polymerasou (např. induktor lac-operonu).
- Protein se naváže na úsek DNA vzdálenější od promotoru a odtud interaguje s RNA-polymerasou (např. regul. protein bakteriální glutaminsyntetasy).
- Regulační protein se váže přímo na RNA-polymerasu(např. σ-faktor u baktérií).
- Regulační protein se váže na DNA dále od promotoru a současně na jiný regulační protein navázaný na promotor (receptor steroidních hormonů u eukaryot nebo regulace prokaryotického arabinosového operonu).
Je třeba si uvědomit, že regulační proteiny mohou na zahajování transkripce působit pozitivně i negativně (zpomalovat ji) a že se několik faktorů (dokonce kladných a záporných) může ve stejné chvíli na stejném promotoru (a enhanceru) kombinovat a že jak kladné tak záporné působení regulačního proteinu může být modifikováno (přidáním další proteinové podjednotky, kovalentní modifikací, třeba fosforylací, vazbou určité ligandy apod.). Kombinace všech těchto faktorů na jednom promotoru v daném čase pak dává výslednou intenzitu v zahajování syntézy RNA. Stejně jako u baktérií je též u eukaryot známo řízené přerušení a ukončení transkripce.
Regulace postranskripčních úprav pre-mRNA[upravit | editovat zdroj]
V některých systémech se uplatňuje alternativní sestřih. Primární transkript (pre-mRNA) je sestřihován několikerým způsobem. Gen pro kalcitonin se překrývá s genem pro neuropeptid příbuzný s kalcitoninem (CGRP). Má exony 1, 2, 3, 4, 5. Po sestřihu v buňkách štítné žlázy v mRNA zůstanou exony 1, 2, 3, kdežto v gangliových buňkách se zachovají exony 1, 2, 4, 5. Stejný mechanismus rozhoduje, zda-li buňka produkující IgM bude tvořit membránový (receptorový) typ a nebo sekreční typ tohoto imunoglobulinu.
Regulace na úrovni translace[upravit | editovat zdroj]
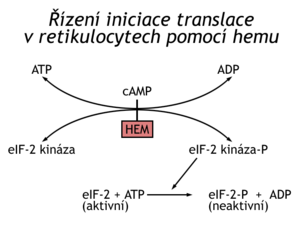
Příkladem těchto mechanismů je řízení syntézy hemoglobinových jednotek. Syntéza je regulována dostupností hemu. Jedna z proteinkinas inaktivuje eukaryotický iniciační faktor elF-2 tím, že fosforyluje jeho α-podjednotku. Fosforylovaný elF-2 nemůže vyměnit GDP za GTP a přijmout novou Met-tRNAi na iniciační komplex. Navíc se na faktor ireversibilně naváže protein GEF (guanyl nucleotide exchange factor, neboli elF-2B), který katalyzuje výměnu GTP – GDP na nefosforylovaném elF-2. Faktoru GEF je v buňce mnohem méně než elF-2, takže k úplnému zastavení translace stačí, když je fosforylováno 30 % elF-2. Popsaná blokáda translace je odstraňována hemem, který inhibuje kinázu fosforylující elf-2. Globinové řetězce se syntetizují jen v přítomnosti hemu, což je z energetického hlediska žádoucí a výhodné. Uvedený mechanismus regulace translace je využíván i v jiných buňkách a řízen jinými efektory než hemem. Interferon např. inhibuje translaci v buňkách infikovaných virem.
Řízení rychlosti degradace mRNA[upravit | editovat zdroj]
Některé regulační proteiny se vážou na mRNA a zpomalují její degradaci nukleasami. Příkladem budiž protein, který zpomaluje syntézu transferinového receptoru tím, že se váže na 3’-konec příslušné mRNA. Železo uvolňuje tento regulační protein z vazby na nukleovou kyselinu, mRNA se rychleji degraduje a tím ubývá receptorů, které by umožňovaly přijmout nežádoucí nadbytek železa do buňky.
Regulace funkce proteinu kotranslačními a postranslačními úpravami[upravit | editovat zdroj]
Již v průběhu translace je nehotový peptidový řetězec modifikován. K těmto kotranslačním úpravám patří odštěpení signálního peptidu (u baktérií deformylace methioninu), vznik disulfidových můstků, konformace řetězce, vznik terciární struktury a připojení oligosacharidových zbytků. Po dokončení syntézy proteinového řetězce pokračují jeho chemické úpravy (kovalentní modifikace), které umožňují jeho funkci, neboť zajistí správné umístění proteinu v membráně, vznik jeho kvarterní struktury, vznik a modifikaci aktivního centra enzymu apod. K těmto postranslačním úpravám řadíme glykosylaci bílkoviny, která mj. zajistí orientaci molekuly, rozpustnost, umístění molekuly v buňce (targeting) a potřebnou kinetiku jejího odbourávání. Z některých peptidových řetězců se vyštěpí peptid a teprve takto vzniklé řetězce mohou zaujmout funkční konformaci (proinsulin – insulin). Tímto způsobem se aktivují též některé proteasy (pepsinogen – pepsin, trypsinogen – trypsin). Charakteristickým jevem eukaryotické proteosyntézy je možnost vzniku polyproteinového prekursoru, dlouhého řetězce, který je posttranslačně štěpen proteasami ve funkční proteiny a peptidy (např. pro-opiomelanokortin (POMC)) se štěpí na několik funkčních hormonů (ACTH, lipotropiny, endorfiny, hormony stimulující melanocyty aj.). Také některé virové proteiny vznikají z polyproteinů. Aktivita jiných proteinu včetně enzymů se mění po fosforylaci jejich serinových, threoninových nebo tyrosinových zbytků (katalyzováno proteinkinázami). Proteiny se též acetylují, (histony), ADP-ribosylují (regulační proteiny).
K postranslačním dějům, dokončujícím vznik proteinů a vyšších systémů, patří sestavování (assembly) podjednotek v bílkoviny s definovanou kvarterní strukturou (hemoglobin, aspartát-karbamylasa). Často probíhají podle určitého programu, podle kterého se jednotkové složky postupně syntezují a postupným připojováním k takovému nadmolekulárnímu útvaru vytvářejí vazebná místa pro další komponenty. Tak vznikají virové částice (viriony), a buněčné organely (např. ribosomy). Jednotlivé složky jsou při tomto sestavování obvykle spojovány nekovalentními vazbami.
Odkazy[upravit | editovat zdroj]
Související články[upravit | editovat zdroj]
- Řízení genové exprese a proteosyntézy
- Řízení genové exprese a proteosyntézy u prokaryot
- Gen
- Transkripce
- Translace
Zdroje[upravit | editovat zdroj]
- ŠTÍPEK, Stanislav. Stručná biochemie : Uchování a exprese genetické informace. 1. vydání. Medprint, 1998. 92 s. s. 62–67. ISBN 80-902036-2-0.