Biochemická vyšetření pankreatu
Z hlediska laboratorní diagnostiky lze vyšetření pankreatu rozdělit na:
- vyšetření endokrinních funkcí pankreatu;
- vyšetření exokrinní části pankreatu:
- průkaz poškození acinózních buněk;
- vyšetření sekrece pankreatické šťávy.
Endokrinní funkce pankreatu
Vnitřně sekretorická část pankreatu produkuje především inzulin, glukagon a somatostatin. Poruchy tvorby těchto hormonů jsou pojednány v příslušných kapitolách, především v souvislosti s diabetem mellitem.
Exokrinní funkce pankreatu
Vyšetření exokrinní funkce pankreatu není příliš rozšířené. Využívá se především v diagnostice chronické pankreatitidy. Opírá se jednak o přímé testy, kdy se měří koncentrace či aktivita pankreatických enzymů (chymotrypsinu, elastázy) ve stolici, jednak o testy nepřímé, založené na podání vhodných substrátů pankreatických enzymů a detekci štěpných produktů vzniklých jejich trávením.
Biochemické vyšetření pankreatu
K rozsáhlému poškození pankreatické tkáně dochází především při akutní pankreatitidě. Jde o život ohrožující náhlou příhodu břišní, při které se aktivují trávicí enzymy pankreatické šťávy, což vede k natrávení tkáně slinivky břišní. Spouštěčem akutní pankreatitidy bývá nejčastěji přetlak ve společných pankreatických a žlučových vývodných cestách (při cholelitiáze) a alkoholismus.
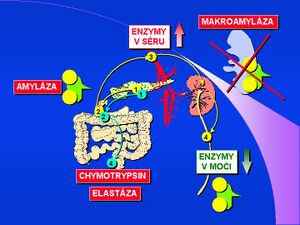
Rozpad pankreatických acinárních buněk vede k vylití jejich součástí do krve. V séru pak můžeme prokázat vysokou katalytickou koncentraci pankreatických enzymů, zejména α-amylázy a pankreatické lipázy.
α-amyláza
α-amyláza[1] [2] [3] [4] [5] [6] [7] [8] [9] [10] (AMS, α-1,4-glukan-4-glukan-hydroláza, EC 3.2.1.1) hydrolyzuje α-1-4-glykosidovou vazbu; pH optimum α-amylázy je mezi 7,0–7,2. V organismu se vyskytuje ve dvou formách – jako slinný a pankreatický izoenzym podle orgánového původu. Obě izoformy AMS se od sebe liší cukernou složkou a lze je odlišit elektroforeticky, či podle precipitace pomocí speciálního lektinu nebo protilátky[11]. α-amyláza je tvořena v acinárních buňkách pankreatu a hromadí se v zymogenních granulech. Do střevního lumen se dostává ve formě pankreatického sekretu (pankreatické šťávy) spolu s dalšími trávicími enzymy. Za fyziologických podmínek není molekula enzymu absorbována střevním povrchem a sérová hladina je nízká, odpovídající aktivitě enzymu uvolněného do cirkulace přímo ze žlázových buněk, resp. lymfatickou drenáží. Molekulová hmotnost α-amylázy je 55 000. Z cirkulace je α-amyláza eliminována v ledvinách glomerulární filtrací.
Makroforma enzymu (makroamyláza)[12] [13] [14] [15] [16] vzniká vazbou enzymu na některé bílkoviny krevního séra, především imunoglobuliny, cirkulující imunokomplexy nebo jiné glykoproteiny. Makroforma enzymu má podstatně vyšší molekulovou hmotnost (od 150 000 do 2 000 000) a není proto eliminována glomerulární filtrací. Pro klinickou diagnostiku se stanovuje hladina α-amylázy v séru, v moči a vypočítává se index clearance amylázy/kreatininu.
Laboratorně lze stanovovat koncentraci proteinu imunologickými technikami nebo enzymovou katalytickou koncentraci pomocí specifických substrátů. Při stanovení jak hmotnostní, tak katalytické koncentrace enzymu je nutno zvažovat přítomnost inhibitorů v séru a vznik makroforem enzymů. Běžně používané stanovení aktivity α-amylázy je založeno na štěpení chromogenního substrátu. Starší postupy, které používaly deriváty přirozeného substrátu, škrobu, byly obtížně standardizovatelné a již se nepoužívají. Současné syntetické substráty jsou odvozeny od maltózy, jako chromogen je nejčastěji používán 4-nitrofenylfosfát. Stanovení izoenzymů α-amylázy je umožněno inhibicí jednoho z obou izoenzymů specifickou monoklonální protilátkou.
V nejčastějším uspořádání je ve vzorku nejprve protilátkou inhibován slinný izoenzym amylázy. Reakce se startuje přidáním substrátu chráněného etylidenem – heptamerem glukózy, na jehož jednom konci je navázán chromogen a na druhém konci etyliden. Amyláza ze vzorku hydrolyzuje oligoglukosidový řetězec. K uvolnění barevného nitrofenolu pak dojde účinkem další složky reakční směsi, glukosidázy. Protože α-glukosidáza dokáže odštěpit jen glukózu na konci řetězce a nerozpozná glukózu chráněnou etylidenem, je substrát, který nebyl hydrolyzován amylázou, před účinkem glukosidázy chráněn[17].
- Referenční hodnoty[18]
-
- S-AMS celková amyláza v séru 0,30–1,67 μkat/l
- U-AMS celková amyláza v moči < 7,67 μkat/l
- S-pAMS pankreatická amyláza v séru 0,22–0,88 μkat/l
- U-pAMS pankreatická amyláza v moči < 5,83 μkat/l
- makroamyláza nedetekovatelná
Interpretace nálezů
Z praktického hlediska je významným nálezem zvýšení aktivity α-amylázy v séru. Může být způsobeno:
- zvýšeným uvolňováním amylázy z poškozených buněk pankreatu nebo slinných žláz, nebo
- snížením glomerulární filtrace, kdy se tato malá bílkovina ztrácí do primitivní moče v menším rozsahu než obvykle.
Hyperamylázemie při poškození pankreatu nebo slinných žláz je při normálních renálních funkcích provázena i vzestupem aktivity amylázy v moči; je ovšem nutné přihlédnout k tomu, že se v moči objeví až s několikahodinovým zpožděním. V tomto případě zbývá rozlišit, zda amyláza pochází z pankreatu či slinných žláz. Nelze-li rozhodnout na základě klinického obrazu, dá odpověď stanovení izoenzymů.
Snížení glomerulární filtrace amylázy je nejčastěji důsledkem renální insuficience. V tomto případě bude hyperamylázemie provázena nízkou koncentrací a aktivitou amylázy v moči. Jinou, podstatně vzácnější příčinou snížení renální clearance amylázy je makroamylázemie.
Lipáza
Novějším a specifičtějším markerem poškození pankreatu je lipáza[20][21][22][23][24][25][26][27][28][29][30][31][32][33][34][35].
Lipáza (triacylglycerolacylhydroláza, EC 3.1.1.3) je glykoprotein se 420 449 aminokyselinovými zbytky a molekulovou hmotností 46 000–56 000 u pankreatické lipázy a 32 000–39 000 u sérové lipázy.
Jde o hydrolytický enzym štěpící triacylglyceroly s mastnými kyselinami o delším řetězci než 12 uhlíků, v přítomnosti žlučových kyselin štěpí tuk na monoacylglyceroly a diacylglyceroly. Predilekčně jsou odštěpovány mastné kyseliny v polohách sn-1 a sn-3. Tak jako α-amyláza je i lipáza produkována žlázovými buňkami pankreatu a secernována do střevního lumen v pankreatické šťávě. Koncentrační gradient mezi pankreatickou tkání a sérovou lipázou je cca 20 000:1.
Stanovení aktivity lipázy zahrnuje různé postupy:
- enzymové štěpení přirozeného substrátu;
- enzymové členění chromogenních a fluorogenních substrátů;
- metody imunologické (ELISA, latexová aglutinace).
Nejčastěji se používá nefelometrických a turbidimetrických postupů založených na štěpení přirozeného substrátu triacylglycerolu. Většina souprav pro enzymové stanovení lipázy obsahuje i ko-lipázu. Turbidimetrické stanovení aktivity lipázy je založeno na vyčeření olejové emulze působením lipolytické aktivity. Tento proces však může být ovlivněn i dalšími složkami séra, např. tzv. vyčeřovacím faktorem pseudolipázou. Nejčastěji se jedná o cirkulující imunokomplexy typu IgM. Pro diferenciální stanovení sérové pankreatické lipázy vedle pseudolipázy s použitím standardního turbidimetrického postupu je vypracován postup založený na inaktivaci pseudoplipázy β-merkaptoetanolem, který vede k disociaci IgM komplexů. Novější chromogenní testy jsou založeny na enzymové kaskádě lipázy štěpící 1,2-diacylglycerol, glycerolkináze, glycerol-3-fosfátoxidáze a peroxidáze s chromogenním produktem. Zcela nový typ techniky stanovení pankreatické lipázy je založen na změně vodivosti roztoku uvolněním mastných kyselin ze substrátu – trioleinu; detekována je akustickým snímačem a měřenou veličinou je frekvenční odpověď.
- Normální hodnoty
-
- do 1 μkat/l [36]
Vzestup koncentrace pankreatické lipázy je specifičtější známkou akutní pankreatitidy než α-amyláza. Její hladina v séru zůstává zvýšena asi dva týdny po akutní příhodě. Podstatněji se nezvyšuje u renálních onemocnění.
Reference
- ↑ CARROLL, Jennifer K, Brian HERRICK a Teresa GIPSON. Acute Pancreatitis: Diagnosis, Prognosis, and Treatment. American Family Physician [online]. 2007, vol. 75, no. 10, s. 1513-1520, dostupné také z <https://www.aafp.org/afp/2007/0515/p1513.pdf>. ISSN 0002-838X.
- ↑ KOCNA, Petr a Tomáš ZIMA. Hyperamylazémie, laboratorní a klinické aspekty. Časopis lékařů českých [online]. 2006, vol. 145, s. 449-452, dostupné také z <https://www.prolekare.cz/casopis-lekaru-ceskych-clanek?id=3093>. ISSN 1803-6597.
- ↑ QUARINO, L, Q DANG a J HARTMANN. An ELISA method for the identification of salivary amylase. Journal of forensic sciences. 2005, vol. 50, no. 4, s. 873-876, ISSN 0022-1198.
- ↑ SMITH, Ross C, James SOUTHWELL-KEELY a Douglas CHESHER. Should serum pancreatic lipase replace serum amylase as a biomarker of acute pancreatitis?. ANZ journal of surgery [online]. 2005, vol. 75, no. 6, s. 399-404, dostupné také z <https://onlinelibrary.wiley.com/doi/pdf/10.1111/j.1445-2197.2005.03391.x?cookieSet=1>. ISSN 1445-1433.
- ↑ PANTEGHINI, Mauro, Ferruccio CERIOTTI a Franca PAGANI, et al. Recommendations for the routine use of pancreatic amylase measurement instead of total amylase for the diagnosis and monitoring of pancreatic pathology. Clinical Chemistry and Laboratory Medicine [online]. 2002, vol. 40, no. 2, s. 97-100, dostupné také z <https://www.degruyter.com/doi/abs/10.1515/CCLM.2002.017>. ISSN 1434-6621.
- ↑ TREACY, John, Anthony WILLIAMS a Renz BAIS, et al. Evaluation of amylase and lipase in the diagnosis of acute pancreatitis. ANZ Journal of Surgery [online]. 2001, vol. 71, no. 10, s. 577-82, dostupné také z <https://onlinelibrary.wiley.com/doi/pdf/10.1046/j.1445-2197.2001.02220.x?cookieSet=1>. ISSN 1445-1433.
- ↑ PEZZILLI, R, G TALAMINIL a L GULLO. Behaviour of serum pancreatic enzymes in chronic pancreatitis. Digestive and Liver Disease. 2000, vol. 32, no. 3, s. 233-237, ISSN 1590-8658.
- ↑ KEIM, V, N TEICH a F FIEDLER, et al. A comparison of lipase and amylase in the diagnosis of acute pancreatitis in patients with abdominal pain. Pancreas. 1998, vol. 16, no. 1, s. 45-49, ISSN 0885-3177.
- ↑ CHASE, CW, DE BARKER a WL RUSSELL. Serum amylase and lipase in the evaluation of acute abdominal pain. The American surgeon. 1996, vol. 62, no. 12, s. 1028-1033, ISSN 0003-1348.
- ↑ MALFERTHEINER, P a J ENRIQUE DOMÍNGUEZ-MUÑOZ. Clinical and laboratory diagnosis of acute pancreatitis. Annali italiani di chirurgia. 1995, vol. 66, no. 2, s. 165-170, ISSN 0003-469X.
- ↑ RACEK, Jaroslav, et al. Klinická biochemie. 2. vydání. Praha : Galén, 2006. 329 s. s. 87. ISBN 80-7262-324-9.
- ↑ BERMEJO, JF, J CARBONE a JJ RODRIGUEZ, et al. Macroamylasaemia, IgA hypergammaglobulinaemia and autoimmunity in a patient with Down syndrome and coeliac disease. Scandinavian journal of gastroenterology. 2003, vol. 38, no. 4, s. 445-447, ISSN 0036-5521.
- ↑ LAWSON, GJ. Prevalence of macroamylasaemia using polyethylene glycol precipitation as a screening method. Annals of clinical biochemistry. 2001, vol. 38(Pt 1), s. 37-45, ISSN 0004-5632.
- ↑ VENTRUCCI, M, A CIPOLLA a M MIDDONNO, et al. Macroamylase detection in serum using selective precipitation: a rapid and reliable assay. Italian journal of gastroenterology and hepatology. 1999, vol. 31, no. 9, s. 846-849, ISSN 1125-8055.
- ↑ CUTOLO, M, A SULLI a A BARONE, et al. Macroamylasemia: a possible cause of unexplained hyperamylasemia in rheumatoid arthritis. British journal of rheumatology. 1995, vol. 34, no. 3, s. 290-292, ISSN 0263-7103.
- ↑ HORTIN, GL, AL SUMMERFIELD a TR WILHITE, et al. Detection of autoantibodies to amylase by ELISA: comparison of detection of macroamylase and free autoantibody. Clinical chemistry [online]. 1994, vol. 40, no. 12, s. 2254-2259, dostupné také z <http://clinchem.aaccjnls.org/content/clinchem/40/12/2254.full.pdf,>. ISSN 0009-9147.
- ↑ Roche Diagnostics. Pankreatická α-amyláza EPS (AMY-P) [online]. Poslední revize 2009-01, [cit. 2010-04-09]. <http://www.roche-diagnostics.cz/objednavky/info/20766623pi.pdf>.
- ↑ Všeobecná fakultní nemocnice v Praze. . Přehled laboratorních vyšetření prováděných ve Všeobecné fakultní nemocnici v Praze. 3. vydání. Praha : Všeobecná fakultnín nemocnice v Praze, 2007. 328 s.
- ↑ RACEK, Jaroslav, et al. Klinická biochemie. 2. vydání. Praha : Galén, 2006. 329 s. s. 87. ISBN 80-7262-324-9.
- ↑ CARROLL, Jennifer K, Brian HERRICK a Teresa GIPSON. Acute Pancreatitis: Diagnosis, Prognosis, and Treatment. American Family Physician [online]. 2007, vol. 75, no. 10, s. 1513-1520, dostupné také z <https://www.aafp.org/afp/2007/0515/p1513.pdf>. ISSN 0002-838X.
- ↑ YAMADAA, Magohei a Toshio FUJITA. New procedure for the measurement of pancreatic lipase activity in human serum using a thioester substrate. Clinica chimica acta. 2007, vol. 383, no. 1-2, s. 85-90, ISSN 0009-8981.
- ↑ AL-BAHRANI, Ahmed Z a Basil J AMMORI. Clinical laboratory assessment of acute pancreatitis. Clinica chimica acta. 2005, vol. 362, no. 1-2, s. 26-48, ISSN 0009-8981.
- ↑ SMITH, Ross C, James SOUTHWELL-KEELY a Douglas CHESHER. Should serum pancreatic lipase replace serum amylase as a biomarker of acute pancreatitis?. ANZ journal of surgery [online]. 2005, vol. 75, no. 6, s. 399-404, dostupné také z <https://onlinelibrary.wiley.com/doi/pdf/10.1111/j.1445-2197.2005.03391.x>. ISSN 1445-1433.
- ↑ WALKOWIAK, J, A LISOWSKA a J PRZYSLAWSKI, et al. Faecal elastase-1 test is superior to faecal lipase test in the assessment of exocrine pancreatic function in cystic fibrosis. Acta paediatrica. 2004, vol. 93, no. 8, s. 1042-1045, ISSN 0001-656X.
- ↑ GRANDVAL, P, A DE CARO a J DE CARO, et al. Critical evaluation of a specific ELISA and two enzymatic assays of pancreatic lipases in human sera. Pancreatology. 2004, vol. 4, no. 6, s. 495-503, ISSN 1424-3903.
- ↑ WALKOWIAK, J, S NOUSIA-ARVANITAKIS a A LISOWSKA, et al. Serum lipase after secretin stimulation detects mild pancreatic involvement in cystic fibrosis. Journal of pediatric gastroenterology and nutrition. 2004, vol. 38, no. 4, s. 430-435, ISSN 0277-2116.
- ↑ WALKOWIAK, J, KH HERZIG a K STRZYKALA, et al. Porownanie przydatnosci oznaczania elastazy-1 i lipazy w stolcu w ocenie funkcji zewnatrzwydzielniczej trzustki u chorych na muskowiscydoze. Medycyna wieku rozwojowego. 2003, vol. 7, no. 2, s. 149-155, ISSN 1428-345X.
- ↑ STEINHAUER, JR, RW HARDY a CA ROBINSON, et al. Comparison of non-diglyceride- and diglyceride-based assays for pancreatic lipase activity. Journal of clinical laboratory analysis. 2002, vol. 16, no. 1, s. 52-55, ISSN 0887-8013.
- ↑ PANTEGHINI, Mauro, Ferruccio CERIOTTI a Franca PAGANI, et al. Recommendations for the routine use of pancreatic amylase measurement instead of total amylase for the diagnosis and monitoring of pancreatic pathology. Clinical Chemistry and Laboratory Medicine [online]. 2002, vol. 40, no. 2, s. 97-100, dostupné také z <https://www.degruyter.com/doi/abs/10.1515/CCLM.2002.017>. ISSN 1434-6621.
- ↑ TREACY, John, Anthony WILLIAMS a Renz BAIS, et al. Evaluation of amylase and lipase in the diagnosis of acute pancreatitis. ANZ Journal of Surgery [online]. 2001, vol. 71, no. 10, s. 577-82, dostupné také z <https://onlinelibrary.wiley.com/doi/pdf/10.1046/j.1445-2197.2001.02220.x>. ISSN 1445-1433.
- ↑ PEZZILLI, R, G TALAMINIL a L GULLO. Behaviour of serum pancreatic enzymes in chronic pancreatitis. Digestive and Liver Disease. 2000, vol. 32, no. 3, s. 233-237, ISSN 1590-8658.
- ↑ KEIM, V, N TEICH a F FIEDLER, et al. A comparison of lipase and amylase in the diagnosis of acute pancreatitis in patients with abdominal pain. Pancreas. 1998, vol. 16, no. 1, s. 45-49, ISSN 0885-3177.
- ↑ LESSINGER, JM, P ARZOGLOU a P RAMOS, et al. Preparation and characterization of reference materials for human pancreatic lipase: BCR 693 (from human pancreatic juice) and BCR 694 (recombinant). Clinical chemistry and laboratory medicine. 2003, vol. 41, no. 2, s. 169-176, ISSN 1434-6621.
- ↑ CHASE, CW, DE BARKER a WL RUSSELL. Serum amylase and lipase in the evaluation of acute abdominal pain. The American surgeon. 1996, vol. 62, no. 12, s. 1028-1033, ISSN 0003-1348.
- ↑ MALFERTHEINER, P a J ENRIQUE DOMÍNGUEZ-MUÑOZ. Clinical and laboratory diagnosis of acute pancreatitis. Annali italiani di chirurgia. 1995, vol. 66, no. 2, s. 165-170, ISSN 0003-469X.
- ↑ Ústav lékařské biochemie a laboratorní diagnostiky 1. lékařské fakulty Univerzity Karlovy v Praze a Všeobecné fakultní nemocnice v Praze. Lipáza [online]. [cit. 2016-04-07]. <https://ulbld.lf1.cuni.cz/seznam-lab-vysetreni?vysetreni=1086>.