Peroxidace lipidů
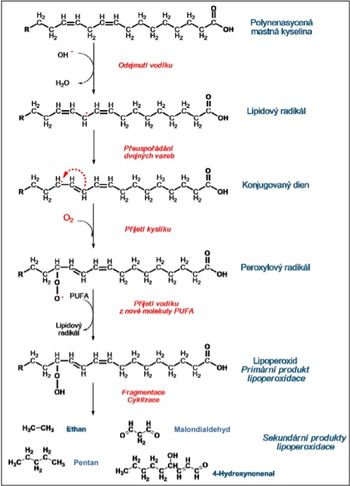
Peroxidace lipidů (lipoperoxidace) je oxidativní poškození vyšších mastných kyselin. K lipoperoxidaci může dojít působením volných radikálů (látky s dostatečnou afinitou k elektronům). Tyto látky jsou schopné vytrhnout vodíkový atom (proton a elektron) z methylenové skupiny MK. Vytržení protonu může zahájit řetězovou reakci, kdy poškozená molekula působí jako volný radikál na molekulu sousední.
Nejčastěji se lipoperoxidace účastní hydroxylový radikál •OH, alkoxylový radikál RO• a peroxylový radikál ROO•.
Peroxidaci podléhají především nenasycené vyšší mastné kyseliny, které jsou součástí fosfolipidů biologických membrán a plazmatických lipoproteinů. Nejlépe jí podléhají mastné kyseliny, které obsahují dvě a více dvojných vazeb oddělených methylenovou skupinou (kyselina linolová, linolenová, arachidonová). Nasycené MK podléhají peroxidaci jen výjimečně.
Průběh peroxidace lipidů[upravit | editovat zdroj]
Iniciace[upravit | editovat zdroj]
Dochází k odštěpení atomu vodíku z MK působením volného radikálu. Vzniká tak volný radikál mastné kyseliny (L•) a voda.
L–H + HO• → H2O + L•
Odejmutí vodíku způsobí přesmyk. V původní mastné kyselině byly dvě dvojné vazby odděleny dvěma jednoduchými. Po přesmyku jsou dvě dvojné vazby odděleny pouze jednou jednoduchou a vzniká konjugovaný dien (velmi reaktivní).
Konjugovaný dien reaguje s přítomným kyslíkem za vzniku peroxylového radikálu (L–O–O•).
L• + O2 → L–O–O•
Propagace[upravit | editovat zdroj]
Peroxylový radikál je velmi reaktivní sloučenina. Ze sousední mastné kyseliny odebírá atom vodíku a přeměňuje se na lipoperoxid (LOOH). Mastná kyselina se stává radikálem, který může napadat další molekuly – řetězová reakce.
L–O–O• + L–H → L• + L–O–O–H
Lipoperoxidy označujeme jako primární produkty peroxidace lipidů.
Další osud primárních produktů vede ke vzniku produktů sekundárních. Ty mohou vznikat cyklizací bez změny počtu atomů uhlíku, štěpením za vzniku aldehydů, uhlovodíku či oxokyselin s nižším počtem uhlíků nebo polymerací. Takto vzniklé sloučeniny (např. malondialdehyd – toxický, vazba na proteiny – změna jejich funkce) jsme schopni detekovat laboratorně.
Terminace[upravit | editovat zdroj]
K ukončení řetězové reakce může dojít:
- při vyčerpání substrátu,
- vzájemnou reakcí dvou radikálů,
- L• + L• → L–L
- L• + L–O–O• → L–O–O–L
- L–O–O• + L–O–O• → L–O–O–L + O2
- působením antioxidantů (tokoferol).
- L–O–O• + T–OH → L–O–O–H + T–O• (není dostatečně reaktivní)
Důsledky lipoperoxidace[upravit | editovat zdroj]
Působením volných radikálů dochází ke změně struktur i biologických funkcí napadených sloučenin. Při napadení lipoproteinových částic (především LDL) dochází k rozvoji předčasné aterosklerózy.
Reaktivní formy nenarušují pouze struktury lipidů, ale také proteinů a DNA, což vede k jejich modifikaci, mutacím, karcinogenezím, apoptózám, urychlení procesu stárnutí a autoimunitním reakcím.
Peroxidace lipidů za účasti přechodných kovů[upravit | editovat zdroj]
Průběh lipoperoxidace může být urychlen ionty přechodných kovů (železo, měď).
Působení železa[upravit | editovat zdroj]
Železo je prvek potřebný pro erytropoézu a funkci některých enzymů (dýchací řetězec, hemoproteinové enzymy, cytochromy). Získává se z potravy. Vstřebávaní závisí na jeho aktuální potřebě. Většina železa v těle cirkuluje – minimální ztráty (nejčastěji při krvácení).
Volné železo se v těle prakticky nevyskytuje. Obvykle bývá vázáno v enzymech nebo na proteinech (feritin, transferin, laktoferin). Pokud se objeví v těle volně, může katalyzovat Fentonovu reakci.
Riziko uvolnění železa z vazby na enzymy a proteiny je například při intravaskulární hemolýze (za předpokladu že haptoglobin a hemopexin nestačí vychytávat uvolněný Hb). Dále při poškození buněk obsahujících enzymy využívající železo (hepatocyty, syntéza hemu). Při traumatu svalů a uvolnění myoglobinu.
- Fentonova reakce
Fe2+ reaguje s peroxidem vodíku za vzniku Fe3+, hydroxidového aniontu a hydroxylového radikálu (vysoce reaktivní).
H2O2 + Fe2+ → OH− + •OH + Fe3+
- Další reakce volného železa v těle
Navázáním kyslíku na hemoglobin vzniká oxyhemoglobin. Při této interakci může dojít k oxidaci hemového železa Fe2+ na Fe3+, kdy se kyslík přeměňuje na superoxid. Ten dále působí na buněčné struktury – oxidační stres.
Hladina reaktivních forem musí být v erytrocytech (i v celém organismu) regulována antioxidačními enzymy.
Působení mědi[upravit | editovat zdroj]
V krvi je měď vázaná a přenášená ceruloplazminem. Ceruloplazmin s navázanou mědí zodpovídá za přeměnu Fe2+ na Fe3+, aby nedocházelo k přítomnosti volného hemového železa a následně k Fentonově reakci. Měď je nezbytná pro funkci antioxidačních enzymů (superoxiddismutázy), ale i jiných enzymů, jako jsou cytochromoxidázy a tyrozinázy.
Při defektu ceruloplazminu (Wilsonova choroba) dochází k poruchám transportu mědi a tím ke zvýšenému oxidačnímu stresu v těle.
Odkazy[upravit | editovat zdroj]
Související články[upravit | editovat zdroj]
- Oxidačný stres
- Vyšetření parametrů antioxidační kapacity
- Antioxidační ochrana lidského těla
- Základní reaktivní formy kyslíku a dusíku
Zdroj[upravit | editovat zdroj]
- FIALOVÁ, Lenka. Lipidy (mastné kyseliny, lipoperoxidace, trávení) [online]. ©2012/2013. [cit. 6.12.2018]. <https://el.lf1.cuni.cz/p5p8l4k0mdk/>.
Použitá literatura[upravit | editovat zdroj]
- ŠTÍPEK, S., et al. Antioxidanty a volné radikály ve zdraví a v nemoci. 1. vydání. Praha : Grada, 2000. s. 70-80. ISBN 80-7169-704-4.