Obecné mechanismy buněčného poškození
| Článek byl označen za rozpracovaný, od jeho poslední editace však již uplynulo více než 30 dní | ||||
| Chcete-li jej upravit, pokuste se nejprve vyhledat autora v historii a kontaktovat jej. Podívejte se také do diskuse. | ||||
Pokud vše nasvědčuje tomu, že původní autor nebude v editacích v nejbližší době pokračovat, odstraňte šablonu {{Pracuje se}} a stránku upravte. | ||||
| Stránka byla naposledy aktualizována v pondělí 26. května 2025 v 10:34. | ||||
Každá buňka má daný rozsah strukturální a funkční stability, který je podmíněn geneticky kódovaným programem diferenciace, specializace a metabolismu, přítomností sousedních buněk a dostupností metabolických substrátů. Za normálních podmínek existuje dynamická rovnováha v pořadí metabolických dějů, při nichž je buňka schopna zvládnout fyziologické požadavky, tento stav se označuje jako normální homeostáza. Změna některého z parametrů této rovnováhy vystupňovaným stresem nebo patologickými podněty vede ke znovudosažení rovnováhy tak, že vyvolá změnu jiného parametru. Tento proces označujeme jako adaptaci, jejíž výsledkem je nový rovnovážný stav.
Mechanismy adaptace buněk[upravit | editovat zdroj]
B v rovnovážném stavu → B poškozená → B adaptovaná na nový rovnovážný stav
pokud je poškození příliš velké:
B v rovnovážném stavu → B poškozená → B trvale poškozená → B zanikájící
Příčiny poškození buňky[upravit | editovat zdroj]
1. Snížený přísun kyslíku[upravit | editovat zdroj]
Následkem sníženého přísunu kyslíku je hypoxie nebo ischemie.
Příčiny:
- narušený arteriální přítok,
- váznoucí venózní odtok,
- snížená kapacita krve pro přenos kyslíku (anémie, otrava CO, zpomalení krevního proudu při kardiálním selhání). Hypoxií je zasažena hlavně oxidativní fosforylace v mitochondriích a posléze je zablokována i anaerobní glykolýza → radikální snížení tvorby a nedostatek ATP.
2. Fyzikální příčiny[upravit | editovat zdroj]
Mechanické poškození – trauma; změny teploty oběma směry (omrznutí, popálení); náhlé změny atmosférického tlaku; záření – UV, ionizační a poškození elektrickou energií
3. Chemické poškození[upravit | editovat zdroj]
Zde působí řada chemických agens. Toxické mohou být i léky (ATB, cytostatika, apod.), fyziologické látky v toxických koncentracích – O2, H2O, glukóza, soli, které narušují steady state.
4. Genetické vlivy[upravit | editovat zdroj]
Způsobují hlavně poruchy růstu i řadu vrozených malformací, řadíme sem i účinky virů na DNA – přímý cytopatogenický účinek nebo navození imunitní reakce proti dané buňce.
5. Imunologické reakce[upravit | editovat zdroj]
Např. anafylaktická reakce na cizí proteiny či antigeny, nebo reakce na endogenní antigeny, autoimunitní choroby.
6. Nutriční nerovnováha[upravit | editovat zdroj]
Nedostatek či nadměrný přísun vitamínů a stopových prvků.
Obecné biochemické mechanismy buněčného poškození[upravit | editovat zdroj]
Existuje několik škodlivých činitelů, jejichž působení má za následek dobře definované biochemické změny. Buňka je citlivá především na glykolýzu, citrátový cyklus a oxidativní fosforylaci.
Nedostatek kyslíku a toxické účinky[upravit | editovat zdroj]
Kritický nedostatek kyslíku se projevuje dvojím způsobem.
- Snížená hladina kyslíku znamená především ztrátu oxidativní fosforylace ADP, a tedy sníženou tvorbu a posléze depleci ATP.
- Reperfuzní poškození tvorbou ROS – reactive oxygen species, které v biologických systémech slouží jako signální molekuly pro expresi genů, ale díky jejich nestabilitě poškozují lipidy, proteiny, i nukleové kyseliny. Dochází k poškození makromolekul, protože mitochondrie nezvládnou opětovný přechod na oxidativní metabolismus a začnou tvořit radikály.
Deplece ATP[upravit | editovat zdroj]
Adenosintrifosfát jako substrát pro všechny typy ATPáz k reakci ATP = ADP + P + e.
Je generován:
- oxidativní fosforylací ADP – redukcí kyslíku systémy elektronového přenosu v mitochondriích;
- glykolýzou – molekuly ATP získávány za nepřítomnosti kyslíku utilizací glykogenu, glukózy a derivátů.
- Deplece pod 5–10 % vyvolá poškození kritických buněčných systémů.
- Sníží aktivitu Na+/K+-ATPázy → difuze kalia z buňky a vzestup IC hladiny natria → IC edém – oddálení ribozomů od ER – blokace proteosyntézy.
- Poškození Ca2+-ATPázy – udržuje rozdílnou koncentraci kalcia mezi buňkou a EC tekutinou.
Intracelulární hladina kalcia, kalciová homeostáza[upravit | editovat zdroj]
Ca2+ rovnováha mezi buňkou a extracelulární tekutinou i mezi intracelulárními oddíly je udržována kalciovou ATPázou (Ca2+-Mg2+-ATPázou). Tato pumpa musí být uzpůsobena tomu, aby zvládla udržet obrovské koncentrační rozdíly. Intracelulární koncentrace Ca2+ v cytosolu je 0,1 μmol, kdežto extracelulárně se přibližuje až k 1,3 milimolu. Zvýšená koncentrace IC kalcia je vysoce toxická! Zvýšení IC hladiny vede k ischémii nebo toxickému poškození přičemž kalcium se do IC prostředí dostává z EC prostředí nebo z kompartmentů (např. únik z mitochondrií a z ER do cytoplazmy).
- Patogeneze: zvyšuje membránovou permeabilitu a aktivaci některých enzymů – ATPázy – urychlení deplece, fosfolipázy – poškození buněčných membrán, endonukleázy, DNA-zy.
Mitochondriální dysfunkce[upravit | editovat zdroj]
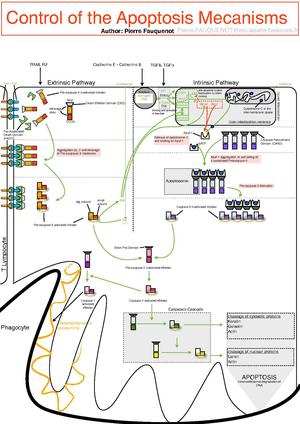
Mitochondrie jsou velice citlivé na řadu patologických atak jako je hypoxie, chemické poškození, radikály, toxiny, zvýšená c Ca2+ v cytosolu → únik cytochromu c a indukce apoptózy
Chemické poškození buňky[upravit | editovat zdroj]
Buněčné jedy: As, CN, Hg, insekticidy, herbicidy, azbest, CO, léky, alkohol
Mechanismy působení:
1. přímá vazba na molekulární složky buněčných organel
- Např. HgCl2 vazba na -SH skupiny proteinů, CN – inhibice cytochromoxidázy vazbou na hemové železo.
2. jiné chemikálie zejména liposolubilní, jsou biologicky neaktivní, ale převedeny na reaktivní toxické metabolity – nejčastěji ROS, RNS.
- Působí lipoperoxidaci, tvorba příčných vazeb mezi proteiny (přes -SH skupiny), pošození DNA – reakcí s thyminem DNA vytvářejí jednoprovazcové úseky DNA.
- Odstranění antioxidanty a enzymy: SOD (superoxiddismutáza), glutathionperoxidáza, kataláza.
- Tyto antioxidační prostředky se stárnutím klesají → horší obrana proti oxidačnímu stresu a nejspíše důvod ke smrti!
Poruchy membránové permeability[upravit | editovat zdroj]
Všechny výše uvedené příčiny buněčného poškození mají za následek poškození membránových systémů. Plazmatická membrána může být poškozená i bakteriálními toxiny, virovými proteiny, složkami komplementu i produkty lymfocytů (perforiny). Ztráta bariérové funkce (funkce plotu) i ztráta permeability membránových buněčných systémů (funkce vrátek) je rohodující pro nástup ireverzibilního poškození buňky.
Reverzibilní a ireverzibilní poškození buňky[upravit | editovat zdroj]
Metabolické dráhy, které vedou k poškození buňky se vzájemně kombinují. Východiskem následujícího modelu reverzibilního a ireverzibilního poškození buňky je nedostatek kyslíku.
Reverzibilní poškození buňky[upravit | editovat zdroj]
- Snížená tenze kyslíku → ztráta oxidativní fosforylace ADP → snížená generace ATP. Po zhroucení systému oxidativní fosforylace může buňka generovat ATP přesmykem na glykolýzu – ovšem se sníženým výtěžkem. Následující hromadění metabolitů glykolýzy vede ke zvýšení osmotického tlaku v buňce a zvýšené laktémii s poklesem pH. Poté co se vyčerpají zásoby glykogenu se úroveň glykolýzy rychle snižuje.
- Zhroucení sodíkové pumpy závislé na ATP i zvýšení osmotického tlaku → difuze kalia z buňky a hromadění natria a vody v buňce → zduření buněk, dilatace ER, oddálení ribosomů od membrán ER → snížení proteosyntézy, porušení kalciové pumpy → Ca2+ do cytosolu.
Ireverzibilní poškození buňky[upravit | editovat zdroj]
- Zde dochází k těžkému poškození membrán a změnám jejich permeability → zduření a postupná rozklad mitochondrií a lyzosomů. Zvýšený tok kalcia do buňky → aktivace proteáz a endogenních fosfolipáz a tím ztrátu membránových fosfolipidů. Produkty štěpení – volné mastné kyseliny a acyl-karnitin mění permeabilitu mitochondriální a lyzosomální membrány což má za následek:
- únik mitochondriálních dehydrogenáz a cytochromu c z mitochondrií,
- zduření lyzosomů a rupturu jejich membrán s únikem lyzosomálních enzymů do cytoplazmy a destrukci dalších buněčných struktur.
- Tyto změny vedou ke ztrátám proteinů, enzymů, koenzymů a RNA přes hyperpermeabilní membránu a dále ke zvýšené expresi adhezních molekul hypoxickými buňkami. Adhezní molekuly dochází k imigraci leukocytů a výsledný zánět přispěje k dalšímu poškození buňky. Výsledekem je konečný zánik.