Kontrastování v elektronové mikroskopii
Kontrastování vzorků pro TEM[upravit | editovat zdroj]
Rozlišení vzorků v transmisním elektronovém mikroskopu záleží na rozptylu svazků elektronů při dopadu na vzorek. Tento rozptyl závisí na atomové hmotnosti prvků, z něhož je preparát tvořen (čím vyšší je atomová hmotnost daných prvků, tím vyšší denzita se projeví na obrazu).
Biologické struktury mají samy o sobě nízký kontrast, protože biogenní prvky (C, O, H, N), z nichž se skládají, mají malé atomové hmotnosti, jejichž hodnoty se od sebe příliš neliší, tudíž nejsou v elektronovém mikroskopu rozeznatelné.
Možností zvýšení kontrastu vzorků je mnoho, můžeme použít například metodu zmenšení objektové clony, snížení urychlovacího napětí nebo zvětšení tloušťky vzorku. Tyto metody se ale příliš nepoužívají, protože vedou k neostrosti obrazu. Dnes se ke zvýšení kontrastu používá převážně adsorpce sloučenin těžkých kovů na biologické struktury.
Používají se převážně tyto kovy: U, W, Pt, Pb a Mn, nazývané též elektronová barviva. Tyto kovy dovedou zvýšit rozptyl primárních elektronů a tím i zvýšit kontrast struktur vzorků.
Metoda pozitivního kontrastu[upravit | editovat zdroj]
Sloučeniny těžkých kovů se navážou na takové povrchy, které obsahují redukční místa (např. dvojné vazby), a vytvoří tak vysoký kontrast struktur, které vyniknou na méně denzním pozadí.
- Inkubací s parami OsO4;
- dvojitým barvením s octanem uranylu (uranyl acetátem) a citrátem olova, kdy octan uranylu reaguje především s nukleovými kyselinami a proteiny a citrát olova pak reaguje s membránami, proteiny, nukleovými kyselinami a s glykogenem. Po dvojitém kontrastování tak vzorek získá rovnoměrný kontrast všech buněčných struktur.
Metoda negativního kontrastu[upravit | editovat zdroj]
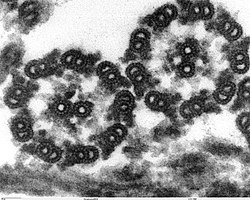
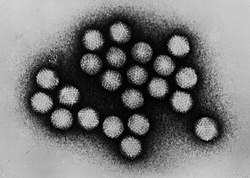
Metoda spočívá v obklopení vzorku elektronově denzním kontrastním činidlem obsahujícím těžký kov, který vytvoří temné pozadí, v němž se vzorek o nižší denzitě bude jevit jako světlejší. Tato metoda je vhodná pro pozorování malých struktur, jako jsou makromolekuly proteinů a polysacharidů, organely, membránové systémy, viry a bakterie.
Jako kontrastní činidla se nejčastěji používají:
- AM = molybdenan amonný;
- UA = uranyl acetát;
- PTA = roztok kyseliny fosfowolframové.
Metoda stínování[upravit | editovat zdroj]
Stínování spočívá v pokrývání preparátu tenkou vrstvou kovu, to zajistí zvýraznění jemných fibrilárních struktur a detailů malých makromolekul, např. kolagenu, DNA, RNA, ribozomů nebo buněčné stěny. Nejčatěji se používají kovy o vysoké hustotě (Au, C, U, Cr, W, Pt, Pd, Ni, Ge). Pokovení se provádí ve vysokém vakuu (10-4 Pa) za pomoci odpařovacího zdroje kovových částic, kdy partikule těžkého kovu putují vakuem přímým směrem různými rovinami a hromadí se na vzorku a kolem něj. Tam, kde vzorek stíní zdroji, se nahromadí méně částic kovu a toto místo se bude zdát světlejší – proto se už dnes používá rotační stínování, kdy se vzorek během nástřiku rovnoměrně otáčí na rotační plošině. (Obecně platí, že čím hrubší povrch má preparát, tím větší úhel dopadu naprašovaného kovu zvolíme a naopak.) Výsledkem stínování je velmi jemná granularitakovových částic, díky které jsou dobře viditelné jemné struktury.
Kontrastování vzorků pro SEM[upravit | editovat zdroj]
Rastrovací elektronový mikroskop slouží hlavně k prohlížení povrchového reliéfu vzorků o velikosi až 15×15 mm. Pracuje na principu detekce odražených nebo vyražených sekundárních elektronů z preparátu. Pro pozorování je nutné, aby preparáty splňovaly určité vlastnosti, jako je bezprašnost, stabilita ve vakuu, stabilita vůči elektronovému svazku, dostatečná tepelná a elektrická vodivost, zachovaná struktura a objem a minimální obsah vody. Vysušené biologické preparáty tyto vlastnosti nesplňují – mají malou vodivost a při jejich pozorování v SEM bez nakontrastování by docházelo k nabíjení primárním svazkem elektronů, čímž by došlo k deformaci povrchu a ztrátě ostrosti obrazu. Řešením je pokrývání preparátu tenkou vrstvičkou (10–20 nm) vodivého materiálu – nejčastěji kovu (Au, C, Pt, Pd, Ag), která zajistí ochranu preparátu před tepelným poškozením a zároveň zvýší tvorbu sekundárních elektronů, čímž dojde ke zvýšení signálu (denzity) preparátu.
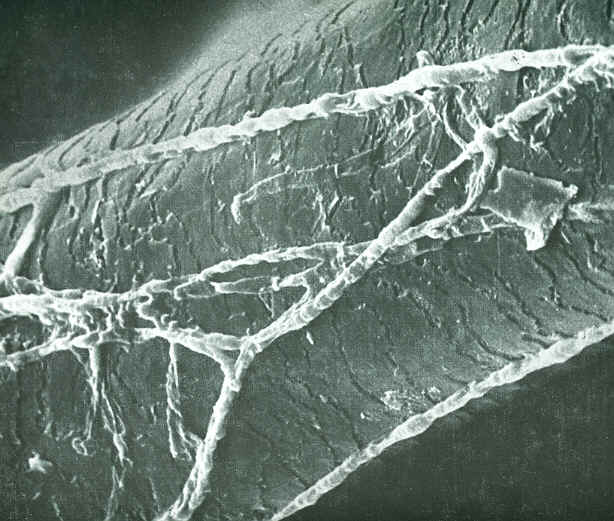
|
| Obrázek 4 - zobrazení v SEM - vlas napadený dermatofytem, pokovený zlatem. Převzato z [1] |
Toto pokovení je možné provádět třemi způsoby:
Vakuovým napařováním[upravit | editovat zdroj]
Kdy se v napařovací aparatuře vytvoří vysoké vakuum a kov se nahřeje (elektricky) na teplotu, při které se z jeho povrchu začnou uvolňovat (odpařovat) jednotlivé molekuly. Tyto uvolněné molekuly kovu se šíří rovnoměrně všemi směry vakuem a kondenzují na chladnějším preparátu.
Iontovým napařováním[upravit | editovat zdroj]
Které je založeno na vzniku usměrněného el. výboje (účinkem el. napětí) v prostředí nízkotlaké argonové atmosféry. Účinkem el. výboje dojde k ionizaci plynu. Ionty plynu pak putují ke katodě, kolem které je prstenec z kovu, kterým chceme preparát naprášit. Urychlené částice plynu z něj vyráží částice kovu, které se rovnoměrně rozletí prostorem napařovačky a srážejí se s dalšími ionty plynu. Tím vznikne v celém prostoru napařovačky hustý mrak malých kovových částic, které rovnoměrně tenkou vrstvou obalí preparát.
Impregnací[upravit | editovat zdroj]
Což je chemická cesta, která využívá osmium nebo kyselinu tanovou. Používá se v případech, kdy není napařovací aparatura k dispozici, nebo když je preparát částečně vodivý.
Odkazy[upravit | editovat zdroj]
Zdroj[upravit | editovat zdroj]
- NEŠČÁKOVÁ, M.: Principy kontrastování základních typů preparátů pro elektronovou mikroskopii, příklady, seminární práce pro předmět Histologické techniky bakalářského studia v oboru zdravotní laborant 2. lékařské fakulty Univerzity Karlovy. Praha: 2013
Použitá literatura[upravit | editovat zdroj]
- NEBESÁŘOVÁ, J. Elektronová mikroskopie pro biology. kapitola 4.7: Kontrastování ultratenkých řezů, 2001. Dostupné z webové stránky: http://triton.paru.cas.cz/lem/
- NEBESÁŘOVÁ, J., Elektronová mikroskopie pro biology. kapitola 8.3: Pokovení preparátů, 2001. Dostupné z webové stránky: http://triton.paru.cas.cz/lem/
- ČECH, S., HORKÝ, D.. Přehled obecné histologie." 1. vydání. Skriptum. Brno: Vydavatelství Masarykova Univerzita, 2005. 140 stran
- Transmission Electron Microscopy (TEM) : sample preparation guide. Dostupné z webových stránek: http://temsamprep.in2p3.fr/accueil.php?lang=eng
- ŠAFÁŘOVÁ, K., Transmisní elektronová mikroskopie. Olomouc, 4. 12. 2009. Dostupnost z webových stránek: http://nanosystemy.upol.cz/upload/18/safarova_tem.pdf. prezentace pro Workshop: Mikroskopické techniky SEM a TEM. Centrum pro výzkum nanomateriálů, UP Olomouc
- Laboratoř elektronové mikroskopie. Metody přípravy biologických vzorků pro elektronovou mikroskopii aplikované LEM. Dostupné z webových stránek: http://web.natur.cuni.cz/~lem/index.php?p=metody
- ŠOBEROVÁ, T., Metoda negativního kontrastu pro diagnostiku virů a bakterií v transmisním elektronovém mikroskopu. České Budějovice: 2009. Dostupné z: https://theses.cz/id/miar9r/downloadPraceContent_adipIdno_12895. Bakalářská práce. Jihočeská univerzita v Českých Budějovicích. Zdravotně sociální fakulta
- Elektronová mikroskopie. Dostupné z webových stránek: http://old.vscht.cz/nmr/mol_model_bioinfo/lekce/mikroskopie.pdf
- Příprava preparátu pro elektronový mikroskop. Dostupné z: http://xarquon.jcu.cz/edu/zbb/elm.pdf
- Kontrastování („barvení“) ultratenkých řezů. Dostupné z: http://www.med.muni.cz/histology/MedAtlas_2/HP_txt8-2-4.htm
- Cytodiagnostické a imunocytochemické metody. Dostupné z: http://new.biologie.upol.czimunocytochemicke%20metody.htm
- Prozařovací elektronová mikroskopie (TEM). Dostupné z: http://new.biologie.upol.cztem.htm
- Rastrovací elektronová mikroskopie. Dostupné z: http://new.biologie.upol.cz
- KUBÍNEK, R., Moderní mikroskopie. Elektronová mikroskopie (TEM, SEM) Mikroskopie skenující sondou. Katedra experimentální fyziky Přírodovědecké fakulty, Univerzita Palackého v Olomouci
- MAŇÁKOVÁ, E., SEICHERTOVÁ, A., Metody v histologii, 1.vydání. Praha: Karilinum, 2002. ISBN 80-0230-X
- BEDNÁŘ, J., STANĚK, D., MALÍNSKÝ, J., KOBERNA, K., RAŠKA, I., Dnešní mikroskopie v biomedicíně. Pohyb molekul v přímím přenosu z živé buňky a další kouzla. Časopis VESMÍR č. 83, říjen 2004, dostupné z webových stránek: http://www.vesmir.cz
- JIRKOVSKÁ, M., Histologická technika pro studenty lékařství a zdravotnické techniky, 1. vydání. Praha: Galén, 2006. ISBN 80-7262-263-3
- HRDÝ, R., Elektronová mikroskopie (SEM, TEM, příprava vzorků, EDX, WDX). Budování výzkumných týmů a rozvoj univerzitního vzdělávání výzkumných odborníků pro mikro- a nanotechnologie (NANOTEAM) CZ.1.07/2.3/.00/09.0224. Instrukční a studijní materiál. Brno: 2011
- BOZZOLA, JOHN J., RUSSELL, LONNIE D., Electon Microscopy, Principles and Techniques for Biologists, Chapter 5 – Specimen Staining and Contrast Methods for Transmission Electron Microscopy. 2nd edition. Dostupné z webových stránek www.books.google.cz, Canada: Jones and Bartlett Publishers, 1999. ISBN-10: 0-7637-0192-0
- AYACHE, J., BEAUNIER, L., BOUMENDIL, J., LAUB, D., Sample Preparation Handbook for Transmission Electron Microscopy Techniques. New York: Springer. 2010. ISBN 978-1-4419-5974-4
- VAJNER, L,. Speciální metody v elektronové mikroskopii. Praha: Ústav histologie a embryologie, 2. lf. Materiál pro výuku
Reference[upravit | editovat zdroj]
- ↑ HEJTMÁNEK,, M. a V. HORN. Vlas napadený kožní plísní - dermatofytem. [online]. [cit. 2024-09-27]. <https://biologie.upol.cz/mikroskopie/html_img/8.5.htm>.