Intracelulární akumulace proteinů
Z WikiSkript
Intracelulární akumulace proteinů se často projeví ve formě eosinofilních kapének (proteinové inkluze, hyalinní kapénky) nebo ve formě proteinových agregátů – ty mohou být deponovány jak v cytoplazmě, především v endoplazmatickém retikulu nebo cytosolu, tak i v jádře.
Příčiny střádání proteinů[upravit | editovat zdroj]
1. excesivní reabsorpce proteinu[upravit | editovat zdroj]
- v buňkách proximálních tubulů ledvin může dojít u nemocí způsobujících proteinurii (nefrotický syndrom) k zvýšení pinocytózy albuminu obsaženého v primární moči
- tubulární buňky jsou poté plné a cytoplazma obsahuje hyalinní kapénky
- jedná se o reverzibilní proces – pokud proteinurie ustane, proteinové kapénky se metabolizují
2. excesivní produkce proteinu[upravit | editovat zdroj]
- v nádorech plazmatických buněk (plazmocytární myelom) dochází k excesivní produkci imunoglobulinů, které se hromadí v endoplazmatickém retikulu
- endoplazmatické retikulum se dilatuje a vytváří se objemné eozinofilní inkluze v cytoplazmě (Russelova tělíska)
3. akumulace cytoskeletálních proteinů[upravit | editovat zdroj]
- cytoskelet buněk tvoří mikrotubuly, aktin a myozin a intermediální filamenta (cytokeratiny, desmin, vimentin, neurofilamenta, gliová filamenta)
- keratiny v hepatocytech agregují v důsledku poškození alkoholem (tzv. Malloryho hyalin)
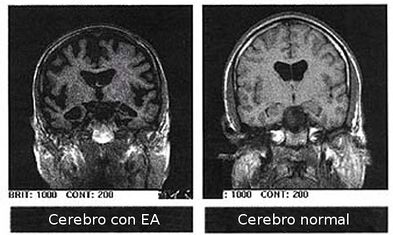
- v cytoplazmě neuronů u Alzheimerovy choroby vznikají agregáty obsahující neurofilamenta – vznikají neurofibrilární klubka
- vrozených chorob s mutacemi genu pro desmin (desminopatie) dochází ke vzniku proteinových inkluzí v kosterní i srdeční svalovině (rozvoj myopatie a kardiomyopatie)
4. akumulace proteinů s porušenou stereokonformací = proteinopatie[upravit | editovat zdroj]
- jsou to onemocnění z patologických konformerů či „protein misfolding disorders“
- jedná se o onemocnění způsobená patologickou konformací proteinů
- skládání proteinů
- je to proces, při kterém primární struktura proteinu zaujímá stabilní prostorové uspořádání (konformaci) – struktury α-helixu a β-skládaného listu
- procesu se účastní molekulární chaperony, které stabilizují intermediární produkty během proteosyntézy a účastní se transportu a kontroly finálního produktu
- některé chaperony jsou přítomny neustále, jiné jsou indukovány stresem (např. heat-shock proteiny, hsp70 nebo hsp90 – brání porušení konformace proteinu po stresové události)
- pokud se v buňce vyskytne chybně sbalený protein, chaperony umožní jeho degradaci (ubikvitin-proteazomový systém)
- společným znakem onemocnění způsobených patologickou konformací proteinů je tvorba struktur β-skládaného listu, které jsou navíc stabilizovány oligomerizaci a agregací
- příčiny vzniku patologicky konformovaných proteinů:
- mutace genu pro daný protein dá vzniknout proteinu, který má tendenci k chybnému sbalování
- např. u familiární formy Creutzfeldt-Jakobovy choroby či u vrozeného deficitu α1-antitrypsinu
- získané defekty při skládání proteinů (v důsledku toxického poškození či stárnutí) – podílí se na řadě sporadických neurodegenerativních chorob
- Alzheimerova choroba – vznikají klubka poškozeného tau-proteinu
- Parkinsonova choroba – v neuronech pozorujeme Lewyho tělíska (inkluze alfa-synukleinu)
- poškozené proteiny jsou pro neurony toxické!
- primární poruchy molekulárních chaperonů – chaperonopatie
- např. některé neuropatie, kardiomyopatie či adultní polycystická choroba ledvin vznikají mutací pro molekulární chaperony
- mutace genu pro daný protein dá vzniknout proteinu, který má tendenci k chybnému sbalování
Důsledky patologické konformace proteinů:
- změnou konformace proteinu může dojít k zakrytí míst pro katabolické enzymy – takový protein není enzymaticky degradovatelný
- vzhledem k tomu, že primární struktura proteinu je zachována, nejsou tyto defektní proteiny rozpoznány imunitním systémem a ten nezasáhne a nezabrání patologické akumulaci
- patologická konformace proteinu může vést k poruše intracelulárního transportu a k retenci secernovaného proteinu, čímž vznikají patologické inkluze v buňkách
- defektní protein může ztratit svou fyziologickou funkci
- např. postižení chloridového kanálu u cystické fibrózy (tento protein je buňkou degradován a nedostává se na své místo v membráně)
- abnormálně konformované proteiny se mohou hromadit i extracelulárně a interferovat s funkcemi tkání → princip amyloidózy
Odkazy[upravit | editovat zdroj]
Související články[upravit | editovat zdroj]
Použitá literatura[upravit | editovat zdroj]
- POVÝŠIL, Ctibor a Ivo ŠTEINER, et al. Speciální patologie. 2.. vydání. Praha : Galén-Karolinum, 2007. s. 297-299. ISBN 978-80-7262-494-2.
- ZÁMEČNÍK, Josef, et al. Patologie I. 1. vydání. Praha : Nakladatelství LD, s.r.o. - PRAGER PUBLISHING, 2019. ISBN 978-80-270-6457-1.