Biochemické vyšetření mozkomíšního moku
Vyšetření mozkomíšního moku patří k základním metodám, které přispívají k diagnostice neurologických onemocnění. Likvor se odebírá nejčastěji lumbální punkcí (3×5 ml, mezi L4–L5 či S1), méně častý je subokcipitální přístup. Likvor je zapotřebí do laboratoře dopravit co nejrychleji, neboť postupně dochází k rozpadu buněk, snižuje se koncentrace glukózy a zvyšuje se laktát.
Barva
Za fyziologických podmínek je likvor čirá bezbarvá tekutina. Pokud se v mozkomíšním moku nacházejí barevné substance, jedná se o patologický stav. Většinou je podmíněn přítomností hemoglobinu, methemoglobinu a bilirubinu.
- Příměs krve vyvolává narůžovělé až červené zbarvení, označované jako erytrochromní (sangvinolentní). Krev se do likvoru může dostat arteficiálně poraněním cév při provádění lumbální punkce. Pokud likvor při odběru zachycujeme postupně do tří zkumavek, pak v tomto případě zabarvení moku ve zkumavkách slábne a po centrifugaci je likvor bezbarvý. Při intrakraniálním krvácení je zbarvení ve všech zkumavkách stejné intenzity. Při čerstvém krvácení je supernatant rovněž bezbarvý.
- Žluté, xantochromní zbarvení mozkomíšního moku je podmíněné přítomností bilirubinu vzniklého přeměnou hemoglobinu. Xantochromie může přetrvávat 3–4 týdny po začátku krvácení (dále viz spektrofotometrie mozkomíšního moku).
- Přítomnost methemoglobinu se projeví okrově žlutým až hnědým zbarvením.
Zákal
Zákal likvoru bývá způsoben leukocyty, které jsou přítomny v likvoru u hnisavých neuroinfekcí. Intenzita zákalu odpovídá množství leukocytů. Příměs erytrocytů se může projevit rovněž zákalem.
Bílkoviny v mozkomíšním moku
- Patologické změny proteinorachie
Z klinického hlediska má význam zvýšená koncentrace celkové bílkoviny v mozkomíšním moku, tzv. hyperproteinorachie, která může být způsobena několika mechanismy:
- Při poruše hematolikvorové bariéry do likvoru patologicky proniká větší množství bílkovin. Při blokádě likvorových cest dochází pod překážkou k těžké poruše hematoencefalické bariéry a do moku pronikají bílkoviny z plazmy (albumin i vysokomolekulární fibrinogen).
- Intratékální syntéza imunoglobulinů při aktivaci imunitního systému.
- Abnormální složení plazmatických bílkovin se promítne do složení likvorových proteinů, např. monoklonální gamapatie se projeví přítomností stejných imunoglobulinů i v likvoru.
- Zvýšení strukturálních proteinů při poškození tkáně CNS.
- Nádorová infiltrace mozkových obalů.
Stanovení celkové bílkoviny v mozkomíšním moku se uplatňuje především jako rychle proveditelné vyšetření, které poskytuje základní informaci o stavu hematolikvorové bariéry.
- Metody stanovení bílkoviny v mozkomíšním moku
- Jednou z doporučených metod pro kvantitativní stanovení celkové bílkoviny v mozkomíšním moku je reakce s pyrogallolovou červení.
- Orientačně lze kvalitativně zvýšené množství bílkoviny v mozkomíšním moku prokázat Pandyho reakcí, při níž jsou denaturovány globuliny a částečně i albumin vodným roztokem fenolu.
- Referenční hodnoty
- Sp-Celková bílkovina (proteinorachie): 0,20–0,45 g/l
- Pandyho reakce: negativní < 0,2 g/l proteinu
Albumin v mozkomíšním moku
Albumin v likvoru pochází vždy z krve, neboť v CNS se netvoří. Jeho syntéza probíhá v játrech a do mozkomíšního moku se dostává přestupem přes hematolikvorovou bariéru. Zastoupení albuminu tvoří asi 57 % celkové bílkoviny v CSF. Zvýšená koncentrace albuminu v likvoru je vždy známkou poruchy hematolikvorové bariéry.
Pro přesnější zhodnocení jejího stavu se používá tzv. albuminový kvocient Qalb, který bere v úvahu koncentraci albuminu v mozkomíšním moku (AlbCSF) a séru (Albsérum):
- Albuminový kvocient se využívá
- K hodnocení míry postižení hematolikvorové bariéry;
- Pro výpočet intratékální syntézy imunoglobulinů.
- Patologické hodnoty albuminového kvocientu
- Zvýšení Qalb nacházíme u porušené hematolikvorové bariéry, s kterou se setkáváme u zánětlivých onemocnění CNS (meningitidy různého původu), roztroušené sklerózy nebo při obstrukci v likvorových cestách.
- Metody stanovení albuminu
- Albumin se v CSF stanovuje citlivými imunochemickými metodami (imunoturbidimetrie, imunonefelometrie, ELISA).
- Referenční hodnoty
- Sp-Albumin: 120–300 mg/l
- Albuminový kvocient – Qalb (je závislý na věku):
- do 15 let: ≤ 5×10−3
- do 40 let: ≤ 6,5×10−3
- do 60 let: ≤ 8×10−3
Imunoglobuliny v mozkomíšním moku
Imunoglobuliny v likvoru mohou pocházet buď z krve, nebo vznikají intratékálně. Intratékální syntéza protilátek probíhá v perivaskulárně uložených B-lymfocytech, které se diferencují v plazmocyty.
- Patologické změny koncentrace imunoglobulinů
Zvýšení koncentrace imunoglobulinů v likvoru může být způsobeno:
- Poruchou hematolikvorové bariéry;
- Zvýšenou intratékální syntézou;
- Zvýšenou koncentrací imunoglobulinů v séru;
- Poruchou cirkulace likvoru.
- Metody stanovení imunoglobulinů
Jednotlivé třídy imunoglobulinů se stanovují citlivějšími imunochemickými metodami jako je imunoturbidimetrie, imunonefelometrie a ELISA.
Referenční hodnoty:
- Koncentrace imunoglobulinů v mozkomíšním moku:
Průkaz intratékální tvorby imunoglobulinů
Pouhé stanovení koncentrace imunoglobulinů v likvoru je nedostačující, neboť pro diferenciálně diagnostické účely je zapotřebí odlišit intratékální nebo krevní původ imunoglobulinů. K tomu se používá výpočet různých indexů, rovnic či hodnocení pomocí grafů.
Imunoglobulinový index
- Orientační informaci nám poskytne imunoglobulinový index. Hodnotí imunoglobuliny a albumin v séru a v likvoru. Pro jeho výpočet je zapotřebí v likvoru a současně v séru stanovit koncentrace obou analytů. Vypočítá se na základě kvocientu příslušného imunoglobulinu (IgG, IgA, IgM) a albuminového kvocientu.
- Referenční hodnoty
- Imunoglobulinový index IgG:
- IgG index: < 0,5 nesvědčí pro intratékální syntézu IgG
- IgG index: 0,5–0,75 nevylučuje intratékální syntézu IgG
- IgG index: > 0,75 svědčí pro intratékální syntézu IgG
Reiberův diagram
Reiberův diagram umožňuje rychlý průkaz intratékální syntézy imunoglobulinů. Vynášejí se do něho vypočítané hodnoty QAlb a QIgG. Podle umístění vynesené hodnoty v grafu lze určit původ imunoglobulinů a poruchu hematolikvorové bariéry.
- Hodnocení
Reiberův diagram (obr. 3) je rozdělen do 5 oblastí, které vymezují nálezy:
- Oblast 1 – normální nález;
- Oblast 2 – izolovanou poruchu hematolikvorové bariéry bez lokální syntézy Ig oblast 2;
- Oblast 3 – poruchu hematolikvorové bariéry společně s intratékální syntézou Ig oblast 3;
- Oblast 4 – izolovaná intratékální syntéza Ig bez poruchy hematolikvorové bariéry;
- Oblast 5 – oblast analytických chyb.
Hranice mezi lokální syntézou imunoglobulinů a jejich pasivním přestupem je znázorněna modrou čárou. Hodnoty nad touto linií znamenají intratékální syntézu a rozsah je vyznačen přerušovanou čárou a vyjádřen v procentech. Vertikální přerušovaná čára odděluje normální a porušenou hematolikvorovou bariéru.
Oligoklonální imunoglobuliny v mozkomíšním moku
Nejcitlivější metodou pro průkaz intratékální syntézy protilátek je stanovení oligoklonálních imunoglobulinů metodou izoelektrické fokusace s následným barvením nebo imunofixací nebo imunoblottem. Fyziologicky mají imunoglobuliny v séru i mozkomíšním moku polyklonální charakter a vyjadřují heterogenitu individuálních protilátek produkovaných jako odpověď na nejrůznější antigeny, s nimiž se jedinec setkal.
Předpokládá se, že do CNS vstupuje pouze omezený počet B-lymfocytů, které se po aktivaci antigenem (např. určitým mikroorganismem nebo autoantigenem) diferencují v plazmatické buňky secernující protilátky. Intratékálně produkované protilátky se vyznačují pouze omezenou (oligoklonální) heterogenitou, což se při izoelektrické fokusaci projeví jako izolované proužky, které nejsou patrné při analýze séra. Z toho vyplývá nutnost provádět současně analýzu imunoglobulinů likvoru i séra. Srovnává se přítomnost či nepřítomnost identických pruhů IgG v séru a moku; počet a lokalizace proužků nemá diferenciálně diagnostický význam.
Hodnocení:
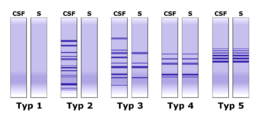
Popisuje se pět různých typů izoelektroforegramů (obr. 4):
- Typ 1 – v séru i v moku pouze polyklonální IgG – normální nález;
- Typ 2 – oligoklonální proužky pouze v likvoru – lokální syntéza IgG (např. u roztroušené sklerózy);
- Typ 3 – oligoklonální proužky v likvoru a další oligoklonální proužky v likvoru i v séru – lokální syntéza IgG a produkce protilátek v organismu (např. chronická infekce CNS, roztroušená skleróza);
- Typ 4 – identické oligoklonální proužky v séru i moku (tzv. „zrcadlový“ obraz proužků v éru a v likvoru – dochází k průniku protilátek z krve do likvoru) – systémová imunitní aktivace bez lokální syntézy IgG v CNS;
- Typ 5 – identické monoklonální proužky v séru i moku v krátkém úseku pH gradientu, jde o přítomnost monoklonálního paraproteinu v likvoru sérového původu (myelom, monoklonální gamapatie) – paraproteinový obraz.
Glukóza v mozkomíšním moku
Glukóza, která je hlavním energetickým substrátem pro nervovou tkáň, je transportována do mozku prostřednictvím transportních systémů v plexus chorioideus. Koncentrace glukózy v mozkomíšním moku je dána kapacitou přenašečových systému, využitím v nervové tkáni a mírou reabsorpce v mozkomíšním moku. Koncentrace glukózy v mozkomíšním moku – glykorachie sleduje koncentraci glukózy v krvi.
Proto pro hodnocení glykorachie je zapotřebí souběžně stanovovat koncentraci v likvoru i v krvi a z hodnot vypočítat jejich kvocient Qglu, (poměr glykorachie/glykemie) podobně jako u albuminu nebo imunoglobulinů:
Za fyziologických okolností je poměr glykorachie a glykemie přibližně 0,6;
- Hodnota pod 0,45 je považována za patologickou.
Patologické změny glykorachie a Qglu:
- Se zvýšenou glykorachií – hyperglykorachií se setkáváme u diabetiků.
- Pro onemocnění nervového systému mají význam snížené hodnoty glykorachie – hypoglykorachie (po vyloučení hypoglykemie), které se vyskytují v likvorech s vyšším počtem buněk. Hypoglykorachie je prokazována u bakteriálních meningitid, kde je vysvětlována spotřebou glukózy baktériemi i leukocyty (Qglu < 0,4). Může poklesnout až na nulové hodnoty. Úspěšná léčba vede k návratu glykorachie k normě.
- Další příčinou snížené koncentrace glukózy v mozkomíšním moku může být nádorové onemocnění CNS, kde glukózu využívají nádorové buňky, a mozková ischemie, u níž nedostatek kyslíku omezuje aerobní glykolýzu a k pokrytí energetických nároků anaerobní glykolýzou je zapotřebí více glukózy.
- U subarachnoidálního krvácení se na zvýšené potřebě glukózy podílejí erytrocyty.
Metoda stanovení glykorachie:
- Metody pro stanovení koncentrace glukózy v mozkomíšním moku jsou podobné jako pro stanovení v krvi (plazmě), tzn. peroxidasová či hexokinasová reakce. Pokud není možné glukózu vyšetřit do 30 minut po odběru, je nutno likvor uchovávat na ledu nebo přidat fluorid sodný, aby se zabránilo nežádoucímu poklesu glukózy následkem glykolýzy. Ta probíhá v mikroorganismech, leukocytech či nádorových buňkách, které mohou být součástí moku za patologických podmínek.
Referenční hodnoty:
- Sp-Glukóza: 2,2–4,2 mmol/l
- Qglu: 0,6
Laktát v mozkomíšním moku
Laktát vzniká odbouráváním glukózy glykolýzou za anaerobních podmínek. V mozkové tkáni se fyziologicky vytváří určité množství laktátu, které odráží metabolickou aktivitu mozku. Prakticky neprochází hematoencefalickou bariérou a jeho koncentrace na rozdíl od glukózy nezávisí na koncentraci v plazmě. Hladina laktátu v CSF má opačný trend než hladina glukózy.
Stanovení laktátu v CSF je citlivějším ukazatelem než stanovení glukózy. Laktát je důležitým parametrem, který pomáhá rozlišit mezi meningitidou bakteriálního a virového původu.
Patologické změny laktátu:
- Zvýšená hladina laktátu u bakteriální meningitidy je projevem anaerobní glykolýzy baktérií a v menší míře leukocytů. Při účinné terapii laktát klesá.
- Všechny poruchy zásobení mozku kyslíkem (např. anoxie, hypoxie např. u cévních mozkových příhod) v důsledku zvýšeného anaerobního metabolismu glukózy jsou doprovázeny zvýšenými hladinami laktátu.
- U subarachnoidálního krvácení je vzestup laktátu způsoben erytrocyty přítomnými v likvoru, které kryjí energetické nároky rovněž anaerobní glykolýzou (nemají mitochondrie).
- Dále se zvyšuje při maligní infiltraci mening a u některých metabolických onemocnění (mitochondriální encefalomyopatie).
Metody stanovení laktátu:
Využívá se enzymové spektrofotometrické metody na principu Warburgova optického testu.
Referenční hodnoty:
- Sp-Laktát: 1,2–2,1 mmol/l
Chloridy v mozkomíšním moku
Koncentrace chloridů v likvoru je běžně 124 mmol/l.
- Pokles pod 100 mmol/l spolu s poklesem glukózy ukazuje na tuberkulózu či plísně.
Odkazy
Související články
- Mozkomíšní mok
- Bílkoviny v mozkomíšním moku
- Spektrofotometrie mozkomíšního moku
- Cytologické vyšetření mozkomíšního moku
- Likvorové syndromy
Externí odkazy
- ADAM, P, C. ANDRÝS a B FRIEDECKÝ, et al. Doporučení České společnosti klinické biochemie a České společnosti alergologie a klinické imunologie – Vyšetřování mozkomíšního moku [online]. ©2005. Poslední revize 2005, [cit. 8. 9. 2009]. <http://www.cskb.cz/cskb.php?pg=doporuceni--vysetrovani-mozkomisniho-moku>.
- FIALOVÁ, L. a M VEJRAŽKA. Základní vyšetření mozkomíšního moku [online]. ©2005. Poslední revize 2008, [cit. 8. 9. 2009]. <https://el.lf1.cuni.cz>.
Použitá literatura
- ADAM, P, et al. Cytologie mozkomíšního moku (CD-ROM). 1. vydání. Praha : SEKK, 2000.
- AMBLER, Z, J BEDNAŘÍK a E RŮŽIČKA. Klinická neurologie – část obecná. 1. vydání. Praha : Triton, 2004. ISBN ISBN 80-7254-556-6.
- GLOSOVÁ, L. Cytologický atlas mozkomíšního moku. 1. vydání. Praha : Galén, 1998. ISBN 80-85824-70-1.
- KALA, M. a J MAREŠ. Lumbální punkce a mozkomíšní mok. 1. vydání. Praha : Galén, 2008. ISBN 978-80-7262-568-0.
- MASOPUST, J. Klinická biochemie. Požadování a hodnocení biochemických vyšetření I. a II. část. 1. vydání. Praha : Karolinum, 1998. ISBN 80-7184-650-3.
- NEVŠÍMALOVÁ, S, E RŮŽIČKA a J TICHÝ, et al. Neurologie. 1. vydání. Praha : Galén, 2005. ISBN 80-7262-160-2.
- SCHNEIDERKA, Petr, et al. Kapitoly z klinické biochemie. 2. vydání. Praha : Karolinum, 2004. ISBN 80-246-0678-X.
- RACEK, J, et al. Klinická biochemie. První vydání. Praha : Galén – Karolinum, 1999. ISBN 80-7262-023-1.
- ŠTERN, P, et al. Obecná a klinická biochemie pro bakalářské obory studia. 1. vydání. Praha : Karolinum, 2005. ISBN 978-80-246-1025-2.
- ZIMA, T, et al. Laboratorní diagnostika. 1. vydání. Praha : Galén – Karolinum, 2002. ISBN 80-7262-201-3.