Bílkoviny v mozkomíšním moku
- Patologické změny proteinorachie
Z klinického hlediska má význam zvýšená koncentrace celkové bílkoviny v mozkomíšním moku, tzv. hyperproteinorachie, která může být způsobena několika mechanismy:
- Při poruše hematolikvorové bariéry do likvoru patologicky proniká větší množství bílkovin. Při blokádě likvorových cest dochází pod překážkou k těžké poruše hematoencefalické bariéry a do moku pronikají bílkoviny z plazmy (albumin i vysokomolekulární fibrinogen).
- Intratékální syntéza imunoglobulinů při aktivaci imunitního systému.
- Abnormální složení plazmatických bílkovin se promítne do složení likvorových proteinů, např. monoklonální gamapatie se projeví přítomností stejných imunoglobulinů i v likvoru.
- Zvýšení strukturálních proteinů při poškození tkáně CNS.
- Nádorová infiltrace mozkových obalů.
Stanovení celkové bílkoviny v mozkomíšním moku se uplatňuje především jako rychle proveditelné vyšetření, které poskytuje základní informaci o stavu hematolikvorové bariéry.
- Metody stanovení bílkoviny v mozkomíšním moku
- Jednou z doporučených metod pro kvantitativní stanovení celkové bílkoviny v mozkomíšním moku je reakce s pyrogallolovou červení.
- Orientačně lze kvalitativně zvýšené množství bílkoviny v mozkomíšním moku prokázat Pandyho reakcí, při níž jsou denaturovány globuliny a částečně i albumin vodným roztokem fenolu.
- Referenční hodnoty
- Sp-Celková bílkovina (proteinorachie): 0,20–0,45 g/l
- Pandyho reakce: negativní < 0,2 g/l proteinu
Albumin v mozkomíšním moku[upravit | editovat zdroj]
Albumin v likvoru pochází vždy z krve, neboť v CNS se netvoří. Jeho syntéza probíhá v játrech a do mozkomíšního moku se dostává přestupem přes hematolikvorovou bariéru. Zastoupení albuminu tvoří asi 57 % celkové bílkoviny v CSF. Zvýšená koncentrace albuminu v likvoru je vždy známkou poruchy hematolikvorové bariéry.
Pro přesnější zhodnocení jejího stavu se používá tzv. albuminový kvocient Qalb, který bere v úvahu koncentraci albuminu v mozkomíšním moku (AlbCSF) a séru (Albsérum):
- Albuminový kvocient se využívá
- K hodnocení míry postižení hematolikvorové bariéry;
- Pro výpočet intratékální syntézy imunoglobulinů.
- Patologické hodnoty albuminového kvocientu
- Zvýšení Qalb nacházíme u porušené hematolikvorové bariéry, s kterou se setkáváme u zánětlivých onemocnění CNS (meningitidy různého původu), roztroušené sklerózy nebo při obstrukci v likvorových cestách.
- Metody stanovení albuminu
- Albumin se v CSF stanovuje citlivými imunochemickými metodami (imunoturbidimetrie, imunonefelometrie, ELISA).
- Referenční hodnoty
- Sp-Albumin: 120–300 mg/l
- Albuminový kvocient – Qalb (je závislý na věku):
- do 15 let: ≤ 5×10−3
- do 40 let: ≤ 6,5×10−3
- do 60 let: ≤ 8×10−3
Imunoglobuliny v mozkomíšním moku[upravit | editovat zdroj]
Imunoglobuliny v likvoru mohou pocházet buď z krve, nebo vznikají intratékálně. Intratékální syntéza protilátek probíhá v perivaskulárně uložených B-lymfocytech, které se diferencují v plazmocyty.
- Patologické změny koncentrace imunoglobulinů
Zvýšení koncentrace imunoglobulinů v likvoru může být způsobeno:
- Poruchou hematolikvorové bariéry;
- Zvýšenou intratékální syntézou;
- Zvýšenou koncentrací imunoglobulinů v séru;
- Poruchou cirkulace likvoru.
- Metody stanovení imunoglobulinů
Jednotlivé třídy imunoglobulinů se stanovují citlivějšími imunochemickými metodami jako je imunoturbidimetrie, imunonefelometrie a ELISA.
Referenční hodnoty:
- Koncentrace imunoglobulinů v mozkomíšním moku:
Průkaz intratékální tvorby imunoglobulinů[upravit | editovat zdroj]
Pouhé stanovení koncentrace imunoglobulinů v likvoru je nedostačující, neboť pro diferenciálně diagnostické účely je zapotřebí odlišit intratékální nebo krevní původ imunoglobulinů. K tomu se používá výpočet různých indexů, rovnic či hodnocení pomocí grafů.
Imunoglobulinový index[upravit | editovat zdroj]
- Orientační informaci nám poskytne imunoglobulinový index. Hodnotí imunoglobuliny a albumin v séru a v likvoru. Pro jeho výpočet je zapotřebí v likvoru a současně v séru stanovit koncentrace obou analytů. Vypočítá se na základě kvocientu příslušného imunoglobulinu (IgG, IgA, IgM) a albuminového kvocientu.
- Referenční hodnoty
- Imunoglobulinový index IgG:
- IgG index: < 0,5 nesvědčí pro intratékální syntézu IgG
- IgG index: 0,5–0,75 nevylučuje intratékální syntézu IgG
- IgG index: > 0,75 svědčí pro intratékální syntézu IgG
Reiberův diagram[upravit | editovat zdroj]
Reiberův diagram umožňuje rychlý průkaz intratékální syntézy imunoglobulinů. Vynášejí se do něho vypočítané hodnoty QAlb a QIgG. Podle umístění vynesené hodnoty v grafu lze určit původ imunoglobulinů a poruchu hematolikvorové bariéry.
- Hodnocení
Reiberův diagram (obr. 3) je rozdělen do 5 oblastí, které vymezují nálezy:
- Oblast 1 – normální nález;
- Oblast 2 – izolovanou poruchu hematolikvorové bariéry bez lokální syntézy Ig oblast 2;
- Oblast 3 – poruchu hematolikvorové bariéry společně s intratékální syntézou Ig oblast 3;
- Oblast 4 – izolovaná intratékální syntéza Ig bez poruchy hematolikvorové bariéry;
- Oblast 5 – oblast analytických chyb.
Hranice mezi lokální syntézou imunoglobulinů a jejich pasivním přestupem je znázorněna modrou čárou. Hodnoty nad touto linií znamenají intratékální syntézu a rozsah je vyznačen přerušovanou čárou a vyjádřen v procentech. Vertikální přerušovaná čára odděluje normální a porušenou hematolikvorovou bariéru.
Oligoklonální imunoglobuliny v mozkomíšním moku[upravit | editovat zdroj]
Nejcitlivější metodou pro průkaz intratékální syntézy protilátek je stanovení oligoklonálních imunoglobulinů metodou izoelektrické fokusace s následným barvením nebo imunofixací nebo imunoblottem. Fyziologicky mají imunoglobuliny v séru i mozkomíšním moku polyklonální charakter a vyjadřují heterogenitu individuálních protilátek produkovaných jako odpověď na nejrůznější antigeny, s nimiž se jedinec setkal.
Předpokládá se, že do CNS vstupuje pouze omezený počet B-lymfocytů, které se po aktivaci antigenem (např. určitým mikroorganismem nebo autoantigenem) diferencují v plazmatické buňky secernující protilátky. Intratékálně produkované protilátky se vyznačují pouze omezenou (oligoklonální) heterogenitou, což se při izoelektrické fokusaci projeví jako izolované proužky, které nejsou patrné při analýze séra. Z toho vyplývá nutnost provádět současně analýzu imunoglobulinů likvoru i séra. Srovnává se přítomnost či nepřítomnost identických pruhů IgG v séru a moku; počet a lokalizace proužků nemá diferenciálně diagnostický význam.
Hodnocení:
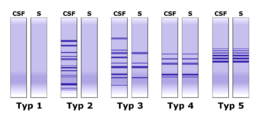
Popisuje se pět různých typů izoelektroforegramů (obr. 4):
- Typ 1 – v séru i v moku pouze polyklonální IgG – normální nález;
- Typ 2 – oligoklonální proužky pouze v likvoru – lokální syntéza IgG (např. u roztroušené sklerózy);
- Typ 3 – oligoklonální proužky v likvoru a další oligoklonální proužky v likvoru i v séru – lokální syntéza IgG a produkce protilátek v organismu (např. chronická infekce CNS, roztroušená skleróza);
- Typ 4 – identické oligoklonální proužky v séru i moku (tzv. „zrcadlový“ obraz proužků v éru a v likvoru – dochází k průniku protilátek z krve do likvoru) – systémová imunitní aktivace bez lokální syntézy IgG v CNS;
- Typ 5 – identické monoklonální proužky v séru i moku v krátkém úseku pH gradientu, jde o přítomnost monoklonálního paraproteinu v likvoru sérového původu (myelom, monoklonální gamapatie) – paraproteinový obraz.
Odkazy[upravit | editovat zdroj]
Související články[upravit | editovat zdroj]
- Mozkomíšní mok
- Biochemické vyšetření mozkomíšního moku
- Spektrofotometrie mozkomíšního moku
- Cytologické vyšetření mozkomíšního moku
- Likvorové syndromy
Externí odkazy[upravit | editovat zdroj]
- ADAM, P, C. ANDRÝS a B FRIEDECKÝ, et al. Doporučení České společnosti klinické biochemie a České společnosti alergologie a klinické imunologie – Vyšetřování mozkomíšního moku [online]. ©2005. Poslední revize 2005, [cit. 8. 9. 2009]. <http://www.cskb.cz/cskb.php?pg=doporuceni--vysetrovani-mozkomisniho-moku>.
- FIALOVÁ, L. a M VEJRAŽKA. Základní vyšetření mozkomíšního moku [online]. ©2005. Poslední revize 2008, [cit. 8. 9. 2009]. <https://el.lf1.cuni.cz>.
Použitá literatura[upravit | editovat zdroj]
- ADAM, P, et al. Cytologie mozkomíšního moku (CD-ROM). 1. vydání. Praha : SEKK, 2000.
- AMBLER, Z, J BEDNAŘÍK a E RŮŽIČKA. Klinická neurologie – část obecná. 1. vydání. Praha : Triton, 2004. ISBN 80-7254-556-6.
- GLOSOVÁ, L. Cytologický atlas mozkomíšního moku. 1. vydání. Praha : Galén, 1998. ISBN 80-85824-70-1.
- KALA, M. a J MAREŠ. Lumbální punkce a mozkomíšní mok. 1. vydání. Praha : Galén, 2008. ISBN 978-80-7262-568-0.
- MASOPUST, J. Klinická biochemie. Požadování a hodnocení biochemických vyšetření I. a II. část. 1. vydání. Praha : Karolinum, 1998. ISBN 80-7184-650-3.
- NEVŠÍMALOVÁ, S, E RŮŽIČKA a J TICHÝ, et al. Neurologie. 1. vydání. Praha : Galén, 2005. ISBN 80-7262-160-2.
- SCHNEIDERKA, Petr, et al. Kapitoly z klinické biochemie. 2. vydání. Praha : Karolinum, 2004. ISBN 80-246-0678-X.
- RACEK, J, et al. Klinická biochemie. První vydání. Praha : Galén – Karolinum, 1999. ISBN 80-7262-023-1.
- ŠTERN, P, et al. Obecná a klinická biochemie pro bakalářské obory studia. 1. vydání. Praha : Karolinum, 2005. ISBN 978-80-246-1025-2.
- ZIMA, T, et al. Laboratorní diagnostika. 1. vydání. Praha : Galén – Karolinum, 2002. ISBN 80-7262-201-3.