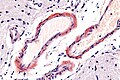
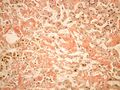
Amyloidóza
(přesměrováno z Amyloidoza)
Amyloidóza (amyloidní dystrofie) je označení pro hlavní příznak skupiny onemocnění podmíněných depozicí amyloidu v řadě orgánů. Amyloid je nerozpustný degradační produkt některých proteinů, jeho název je odvozen od toho, že se při barvení Lugolovým roztokem chová podobně jako škrob. Depozita amyloidu mohou poškodit funkci orgánů natolik, že se klinicky manifestuje např. renální selhávání, malabsorpční syndrom nebo demence. Bezprostřední příčinou depozice mohou být patologické podmínky, obvykle chronické zánětlivé onemocnění, ale existují i dědičné formy onemocnění, při kterých některé mutantní proteiny vykazují vyšší náchylnost k depozici amyloidu. Molekulárním podkladem vlastností amyloidu je precipitace fragmentů bohatých na sekundární strukturu β sheet (skládaný list) a jejich skládání do charakteristických nevětvených fibril.
Morfologie postižení[upravit | editovat zdroj]
Makroskopicky je amyloid obvykle žlutavě šedobílý, poloprůsvitný, konzistence je obvykle křehké až drolivé, může být ale i poměrně pružný. Amyloidem infiltrované orgány bývají tužší, někdy pružnější, na řezu jsou pak matně lesklé způsobem, který starým patologům připomínal slaninu. V běžném barvení hematoxylinem a eosinem je amyloid amorfní, barví se růžově červeně. Při zobrazení elektronovým mikroskopem má amyloid fibrilární strukturu, je tvořen nevětvenými fibrilami průměru obvykle 8–10 nm (dle některých pramenů 6–12 nm), které vytvářejí poměrně hustou strukturu podobnou plsti.
Průkaz amyloidu[upravit | editovat zdroj]
- Makroreakce
Průkaz amyloidu v makroskopickém vzorku tkáně.
- Virchow I – Lugolův roztok barví tkáň mahagonově hnědě.
- Virchow II – po přenesení z Lugolova roztoku do kyseliny sírové se zbarví modrozeleně.
- Mikroskopický průkaz
- Reakce s Kongo červení (Benholdova r.) – oranžově červené zbarvení. Zajímavé je, že barva sama o sobě nemá význam, protože je odvislá mj. od tloušťky preparátu, významná je přítomnost dvojlomu[pozn. 1] a dichroismu[pozn. 2].
- Reakce s krystalvioletí (Cornilova-Weigertova r.) – červenofialové metachromatické barvení[pozn. 3]
- Reakce s tioflavinem S nebo T – žlutozelená fluorescence, citlivá, ale méně specifická metoda.
- Imunochemický průkaz stavebního proteinu – Použití parafinových bloků je méně vhodné, protože fixace snižuje citlivost, proto je vhodnější použití zmražených preparátů (kryostatické řezy). Metoda je vhodná pro diagnostiku amyloidózy na podkladě SAA a β2 mikroglobulinu, v případě amyloidu na podkladě λ řetězců imunoglobulinů je méně citlivá.

Postižení jednotlivých orgánů[upravit | editovat zdroj]
V nadledvině se amyloid ukládá mezi sinusoidní kapiláry a trámce spongiocytů, nejvíce v zona fasciculata, vede k atrofii buněk. Ve slezině může být amyloid vázán především na folikuly, pak vytváří obraz ságové sleziny, může být vázán i na červenou pulpu, obraz šunkové sleziny. V ledvinách se amyloid ukládá nejprve do kliček glomerulů, při pokračování onemocnění se ukládá i do intersticia. Klinicky vede postižení ledvin k renálnímu selhávání. V játrech se amyloid ukládá do Disseho prostorů. Ve střevě se amyloid ukládá v bazální membráně střevního epitelu. Porucha funkce střeva může vést k malabsorbčnímu syndromu.
Patogeneze[upravit | editovat zdroj]
Amyloid je tvořen fibrilami tvořenými především výchozím proteinem. Bylo popsáno několik desítek proteinů, které mohou dát vznik amyloidu. Vznik fibril je spontánní proces řízený fyzikálně chemickými vlastnostmi prekurzorového proteinu. Vznik fibril je podobný krystalizaci, fibrily nejlépe vznikají na podkladě existujících jader, tedy shluků patologických prekurzorových proteinů. Na dynamiku procesu vzniku amyloidu má vliv koncentrace jader, na kterých může docházet k rychlejšímu vzniku amyloidových fibril. Z hlediska dynamiky procesu lze rozlišit tři fáze tvorby amyloidu:
- nukleace (lag fáze) – pomalá oligomerace proteinů, resp. fragmentů proteinů, s patologickou konformací;
- elongace – dostatečná koncentrace kondenzačních jader vede k tomu, že do vznikajících amyloidových fibril mohou být někdy vestavěny i proteiny s normální konformací, fibrily rychle narůstají;
- steady-state – v ustáleném stavu nedochází k dalšímu růstu fibril.
I když bylo popsáno nejméně 27 různých prekurzorových proteinů uplatňujících se v lidské patologii, vzhled i vznik fibril je poměrně uniformní. Fibrily tvoří protofilamenta o průměru 25 nm z proteinových zbytků bohatých na strukturu β-list. Protofibrily mají průměr 25 nm a mohou se kolem sebe stáčet nebo adherovat k sobě laterálně. V zásadě lze rozlišit pět možných mechanismů, které mohou vést ke vzniku amyloidu:
- Propagace konformačních změn – Patologicky konformovaný protein indukuje změnu konformace i u normálně konformovaného proteinu. Tento mechanismus se uplatňuje především u prionových onemocnění.
- Selhání proteolytického procesu – Proteolytický proces chybně konformovaného proteinu může proběhnout nestandardně a zbyde špatně degradovatelný proteinový zbytek. Tento mechanismus se uplatňuje např. v patogenezi Alzheimerovy choroby.
- Mutace genu pro prekurzorový protein – V některých případech je patologická konformace způsobena zárodečnou mutací v genu. Jde o případ dědičných amyloidóz.
- Nadprodukce – Přílišná produkce fyziologického proteinu může sama o sobě zvýšit riziko vzniku kondenzačních jader amyloidových fibril. Podílí se na patogenezi zejm. lokalizovaných amyloidóz.
- Porucha kontroly kvality sestaveného proteinu.
Amyloidové fibrily[upravit | editovat zdroj]
Proces vzniku amyloidových fibril je stále málo prostudovaný, protože detailní analýza struktury amyloidu je totiž velmi obtížná. Ukazuje se, že řada proteinů za specifických podmínek in vitro může zaujmout nefyziologickou konformaci (misfolding), která vede k agregaci; jen několik málo proteinů však zaujme takovou konformaci i za podmínek in vivo.
Proteiny, které mohou dát vzniknout amyloidu, jsou heterogenní skupinou proteinů různých funkcí i struktur. Obvyklým rysem těchto proteinů je vysoký podíl sekundárních struktur β-list, α-helix a β-helix, i když v amyloidu jsou prokazatelné jen β struktury. Během vzniku amyloidu dochází k fragmentaci původního proteinu, fyziologicky je v této fázi obvyklá úplná degradace.
Analýza rentgenového difrakčního vzoru amyloidu vedla již na konci 60. let ke zjištění, že amyloid je bohatý na β struktury, podobný vzor byl získán z amyloidu vzniklého z různých prekurzorových proteinů. Z biochemického pohledu je amyloid nekovalentně vázaný polymer, jehož monomerní jednotky jsou peptidy bohaté na β-list. Důsledkem misfoldingu proteinů je vysoký podíl β-listu v jejich sekundární struktuře. β-listy spolu za určitých okolností mohou interagovat poměrně silnou vazbou a to nejen v rámci jedné molekuly, ale i mezi molekulami. Vazba mezi jednotlivými molekulami dávají vzniknout tzv. cross-β struktuře. Pro další vlastnosti amyloidu je významné, že vzniklé struktury jsou poměrně hydrofobní. To je nejspíše zodpovědné za vysokou stabilitu amyloidu in vivo, nejspíše včetně toho, že amyloid prakticky nestimuluje zánětlivou reakci. Interakce mezi několika β-listy vede ke vzniku protofibril, podél jejichž dlouhé osy jsou β-listy jednotlivých peptidů orientovány podélně. Protofibrily se k sobě přikládají opět bočně jedna ke druhé, ovšem ve výsledku se skládají tak, že jsou částečně pootočené. V amyloidové fibrile jsou pak protofibrily uloženy kolmo k dlouhé ose fibrily, nejsou však v řadě za sebou. Je zajímavé, že amyloidové fibrily nejsou uniformní.
Koprecipitované komponenty[upravit | editovat zdroj]
Součástí amyloidových depozit nejsou jen amyloidové fibrily, obsahují i řadu dalších více či méně pevně vázaných látek, tzv. koprecipitované komponenty:
- Sérový amyloidový protein (SAP) – objemný komplex, který je běžnou součástí extracelulární matrix. Zdá se, že se SAP podílí na rezistenci amyloidu vůči proteolýze. SAP se váže na rostoucí i definitivní amyloidové fibrily, proto lze radioaktivně označený SAP využít k diagnostice.
- Glykosaminoglykany – ve všech typech byl prokázán zejm. heparan sulfát.
- Apoproteiny – zřejmě hrají významnou roli při patogenezi, protože např. Apo E4 je významným rizikovým faktorem pro rozvoj Alzheimerovy choroby.
Buněčná a tkáňová toxicita[upravit | editovat zdroj]
Amyloid není z hlediska tkáňové biologie jen pasivní hmotou. I když nevyvolává úklidovou reakci, působí toxicky na přiléhající buňky. Původně se předpokládalo, že za toxické působení je zodpovědné především to, že amyloid je fyzickou bariérou, která významným způsobem ovlivňuje výměnu látek nezbytných pro metabolismus buňky. Tento efekt mohl být potencován přítomnými makrofágy. Později však bylo prokázáno, že nejméně stejně toxicky působí i rozpustné prekurzorové složky amyloidu, tedy že toxické působení amyloidu je mnohem komplexnější. Tak například v experimentu přidané solubilní fragmenty amyloidu původu z lehkých řetězců indukují apoptózu kardiomyocytů ve tkáňové kultuře.
Klasifikace amyloidózy[upravit | editovat zdroj]
Klinická klasifikace[upravit | editovat zdroj]
Podle charakteru postižení lze amyloidózu rozdělit na lokalizovanou a systémovou. Lokalizovaná amyloidóza je charakterizována tím, že se amyloid vyskytuje pouze v jednom orgánu, nešíří se dále. Patří sem např. depozita Aβ amyloidu při Alzheimerově chorobě nebo např. postižení Langerhansových ostrůvků při dlouhodobém diabetu. Systémová amyloidóza se vyznačuje současným postižením několika systémů.
Z historických důvodů se rozlišovaly dvě formy amyloidózy: primární a sekundární. V případě primární nebyla příčina patrná, v případě sekundární se jedná o reakci na chronické zánětlivé onemocnění. Tyto dvě skupiny se liší i spektrem postižení a proto se tyto termíny používají nadále, i když v poněkud posunutém významu (viz níže).
Klasifikace molekulární[upravit | editovat zdroj]
Molekulární klasifikace je založena na určení proteinu tvořícího amyloid. Obvykle se jedná o nemoc získanou, existují ovšem i hereditární formy. Nejčastější typy shrnuje následující tabulka:
| choroba | prekurzorový protein | upřesnění |
|---|---|---|
| AL amyloidóza | lehký řetězec imunoglobulinu | získaná mutace a nadprodukce |
| AH amyloidóza | těžký řetězec imunoglobulinu | nadprodukce při myelomu |
| Senilní systémová amyloidóza | transtyretin | akumulace běžného typu transtyretinu |
| Familiární amyloidová polyneuropatie | transtyretin | vrozená porucha |
| AA amyloidóza (sekundární a.) | SAA protein | nadprodukce SAA při zánětlivém onemocnění |
| Aβ2M amyloidóza (a. dialyzovaných) | β2-mikroglobulin | chronická dialýza |
| Lyzozymová amyloidóza (ALyz) | lyzozym | vrozená porucha |
| Apo AI amyloidóza (AApoI) | apolipoprotein AI | vrozená porucha |
| Apo AII amyloidóza (AApoII) | apolipoprotein AII | vrozená porucha |
| Apo AIV amyloidóza (AApoIV) | apolipoprotein AIV | vrozená porucha |
| Fibrinogenová amyloidóza (AFib) | α řetězec fibrinogenu | vrozená porucha |
| Finská hereditární amyloidóza (AGel) | gelsolin | vrozená porucha |
| Amyloidová angiopatie islandského typu (ACys) | Cystatin C | vrozená porucha |
| Familiární Britská demence (BriPP a.) | produkt genu BRI2 | vrozená porucha, stop kodon |
| Získaná renální amyloidóza (ALECT2) | leukocytární chemotaktický faktor 2 | získaná porucha |
| Amyloidóza aortální medie (AMed) | lacadherin | |
| Atriální amyloidóza (AANF) | atriální natriuretický faktor | někdy u pacientů s fibrilací |
| Amyloidóza asociovaná s medulárním karcinomem š.ž. | kalcitonin | omezen na nádor |
| spongiformní encefalopatie (AScr) | prion | získaná změna, omezeno na mozek |
| Amyloidóza Langerhansových ostrůvků | amyloidový polypeptid Langerhansových ostrůvků | lokalizace na Langerhansovy ostrůvky, někdy při DM 2. typu nebo v nesidiomu |
| Amyloidóza na bázi laktoferinu (ALac) | laktoferin | Familiární postižení rohovky |
| Alzheimerova nemoc | amyloid β prekurzorový protein | získaná porucha |
| Hereditární cerebrální angiopatie (Aβ) | amyloid β prekurzorový protein | vrozená porucha |
Jednotlivé formy[upravit | editovat zdroj]
AL amyloidóza[upravit | editovat zdroj]
Amyloid je tvořen fragmenty lehkých řetězců (lambda řetězec, light chain) imunoglobulinů. AL amyloidóza (dříve primární amyloidóza) představuje nejčastější formu systémové amyloidózy, incidence v zemích Západu je zhruba 1/100.000 případů za rok. Obvykle se vyskytuje u pacientů starších 45 let s maximem výskytu kolem 67 roku věku. Medián přežití se dle publikovaných výsledků pohybuje mezi 10 a 42 měsíci.
Vlastní příčinou je monoklonální proliferace plasmatických buněk s nadprodukcí lehkých řetězců. Stávající terapie je zaměřena především na potlačení monoklonální proliferace, ovšem tato terapie není kurativní v tom smyslu, že potlačení nadprodukce lehkých řetězců obvykle nevede k regresi postižení. Depozita amyloidu se mohou vyskytnou prakticky kdekoliv v těle, nejčastěji jsou postiženy cévy, ledviny, periferní nervy a trávicí trakt, prognózu výrazně zhoršuje postižení srdce. První manifestací je obvykle poškození ledvin.
Výše popsaná klonální expanze plasmatických buněk obvykle není doprovázena klinicky manifestním mnohočetným myelomem, v kostní dřeni je obvykle méně než 10 % myelomových buněk. Důvod nadprodukce lehkých řetězců spočívá v tom, že lehké a těžké řetězce jsou i v nenádorových buňkách produkovány nezávisle na sobě, ovšem ve vyrovnaném poměru. U nádorových buněk může dojít k porušení tohoto poměru, obvykle ve prospěch lehkých řetězců, kterých může být syntetizován troj- až čtyřnásobek ve srovnání s těžkými řetězci. Tím se objevují volné lehké řetězce v množství, které je dostatečné ke vzniku a růstu depozit amyloidu.
V terapii se používá chemoterapie podle zkušeností s terapií mnohočetného myelomu. Zkušenosti s transplantací autologních kmenových buněk jsou rozporné, protože výkon sám je zatížen vysokou mortalitou.
AA amyloidóza[upravit | editovat zdroj]
AA (dříve sekundární) amyloidóza, je poměrně vzácnou komplikací prakticky každého chronicky probíhajícího zánětlivého onemocnění, chronické infekce nebo nádorového onemocnění. Vyvolávajícím faktorem je dlouhodobá elevace proteinů akutní fáze, konkrétně SAA proteinu.
V minulosti byla nejčastější příčinou chronického zánětu tuberkulóza, dnes se sekundární amyloidóza objevuje nejčastěji jako komplikace revmatických onemocnění, zejm. revmatoidní artritidy. Sekundární amyloidóza doprovázející revmatická onemocnění představuje zhruba 50–70 % všech případů. Na druhou stranu frekvence postižení u revmatologických pacientů je nižší, např. dle pitevního nálezu u pacientů léčených s revmatoidní artritidou se sekundární amyloidóza vyvinula u necelých 6 % nemocných. Ve srovnání se studiemi provedenými v minulosti je patrný klesající trend výskytu sekundární amyloidózy u revmatologických pacientů. V rozvojových zemích je spektrum příčin jiné, výrazněji se uplatňují chronické infekce.
V době diagnózy se sekundární amyloidóza obvykle (až 95 % případů) manifestuje jako proteinurie nebo renální selhávání s různě rychlou progresí.
Hladina SAA jako ukazatele probíhajícího zánětu je velmi dobrým prognostickým faktorem s přímou vazbou na biologii onemocnění. Je-li hladina SAA snížena léčbou základního onemocnění pod 5 mg/l, je poměrně často dosaženo regrese postižení všech orgánů s výjimkou ledvin. Postižení ledvin bývá obvykle ireverzibilní a proto lze očekávat nejvýše zachování funkce a nezhoršování.
Terminologická poznámka: termíny primární a sekundární amyloidóza jsou historické a pocházejí z doby, kdy se vědělo, že AA amyloidóza doprovází chronické záněty (proto byla sekundární). V té době nebyl znám protein deponovaný u AL amyloidózy, šlo tedy o "primární" amyloidózu. Dnes víme, že amyloidózy mají vždy nějakou příčinu a podle tohoto přístupu by byly všechny sekundární; proto se tato terminologie nepoužívá.
Amyloidóza chronicky dialyzovaných[upravit | editovat zdroj]
Amyloidóza chronicky dialyzovaných (β2M amyloidóza) je závažnou komplikací chronické hemodialýzy. Fibrily se formují z β2 mikroglobulinu, součásti HLA. β2 mikroglobulin se může akumulovat, protože jeho degradace probíhá poměrně neobvyklým způsobem. Protein normálně prochází přes glomerulární membránu do primární moči a je resorbován a degradován v proximálních renálních tubulech. Pokud dojde k rozvoji ESRD (End Stage Renal Disease), protein se hromadí a hladina z fyziologických hodnot 1–2 mg/l může vystoupat na 50–70 mg/l.
Rozvoj onemocnění je pozvolný, obvykle se objevuje až po 10 letech po zahájení dialýzy. β2M amyloid se deponuje především v pohybovém aparátu, manifestuje se obvykle jako syndrom karpálního tunelu, artralgie, spondylartropatie, subchondrální kostní cysty a patologické fraktury.
Diagnostika systémové amyloidózy[upravit | editovat zdroj]
Diagnóza systémových amyloidóz vyžaduje histologickou verifikaci s určením depozit amyloidu a typizací amyloidu. Nejčastěji se amyloid diagnostikuje v biopsiích ledvin, které byly indikované pro proteinurii nebo nefrotický syndrom.
Jiná situace je v kardiologii, kde v současnosti pacienti splňující kritéria jsou považováni za nemocné s transthyretinovou amyloidózou a biopsie není nutná. Předpoklad stojí na faktu, že hlavními typy amyloidu postihujícími myokard jsou AL a transthyretinové amyloidózy. AL amyloidóza se vyloučí laboratorně (nepřítomností lehkých řetězců včetně jejich poměru v moči a v séru).
V případě nejistoty se v detekci amyloidu v kardiopatologii používá hmotnostní spektrometrie, protože jde obvykle o masivní depozita. V případě biopsií ledvin jsou depozita mnohem menší a nečetná, proto jsou často pod rozlišovacími možnostmi hmotnostní spektrometrie.
Histopatologická diagnostika[upravit | editovat zdroj]
Vzorky k vyšetření získáváme z biopsie jazyka, kůže, rektální, bukální sliznice a ledvin. Pro histopatologickou diagnostiku tj. identifikaci amyloidu je zlatým standardem barvení kongo červení a průkaz dvojlomu. Dalším krokem je typizace amyloidu, které využívá především imunofluorescenční detekci (Imunofluorescenčně zjišťujeme protilátky anti-AA, anti-λ a anti-Κ, anti-transthyretin a další, podle diagnostického podezření).
Imunohistochemické vyšetření nedokáže zcela spolehlivě detekovat velmi variabilní volné řetězce, proto je málo spolehlivé a preferovaná je imunofluorescence z nativního materiálu nebo z parafinových bloků. U objemných depozit lze identifikovat uložený materiál hmotnostní spektrometrií.
Zobrazovací techniky[upravit | editovat zdroj]
Specifickou technikou pro průkaz amyloidových depozit v těle pacienta je scintigrafické vyšetření za použití radioaktivně značeného proteinu SAP, obvykle 123I-SAP. SAP se totiž reverzibilně váže na všechny známé typy amyloidu, rovnováhy je dosaženo velmi rychle. Metoda není vhodná pro vyšetření malých nebo pohyblivých struktur, nehodí se tedy k hodnocení postižení srdce a nervů.
Laboratorní vyšetření[upravit | editovat zdroj]
Biochemické ukazatele slouží především jako marker závažnosti postižení jednotlivých orgánů. V případě primárních amyloidóz lze prokázat monoklonální produkci patologického proteinu v séru a obvykle i v moči. Stanovení volných řetězců (FLC) je důležité pro stanovení prognózy onemocnění. Vyšetřujeme i kostní dřeň, kde nacházíme zvýšené procento plasmocytů a atypických lymfocytů. Proteinurie s vysokou koncentrací Bence-Jonesovy bílkoviny je pro amyloidózu typická.
Genetické vyšetření[upravit | editovat zdroj]
Odhaduje se, že 5–10 % všech systémových amyloidóz vzniká na dědičném podkladě, proto je vhodné doplnit i genetické vyšetření.
Histologické preparáty[upravit | editovat zdroj]
Odkazy[upravit | editovat zdroj]
Poznámky pod čarou[upravit | editovat zdroj]
- ↑ Dvojlom je vlastností některých opticky anizotropních látek. Světelný paprsek nerovnoběžný s optickou osou se po vstupu do takové látky rozdělí na dva různé paprsky, oba jsou lineárně polarizované.
- ↑ Dichroismus je vlastnost některých látek, které se jeví bezbarvé, ale v polarizovaném světle mohou část spektra absorbovat a tak se jevit barevnými.
- ↑ Metachromatické barvení je takové barvení, při kterém má obarvená struktura jiný barevný tón než použité barvivo.
Literatura[upravit | editovat zdroj]
- ELLEDER, M.. Vybrané kapitoly z patologie buňky II. 1. vydání. Praha : Karolinum, 2009. ISBN 80-7184-748-8.
- BLANCAS-MEJÍA, L. M. a M. RAMIREZ-ALVARADO. Systemic amyloidoses. Annu Rev Biochem.. 2013, vol. 82, s. 745-74, ISSN 1545-4509.
- PINNEY, J. H. a P. N. HAWKINS. Amyloidosis. Ann Clin Biochem.. 2012, vol. 49, no. Pt 3, s. 229-41, ISSN 1758-1001.
- PINNEY, J. H. a H. J. LACHMANN. Systemic AA amyloidosis. Subcell Biochem.. 2012, vol. 65, s. 541-64, ISSN 0306-0225.
- KLENER, Pavel. Vnitřní lékařství. 4. vydání. Praha : Galén : Karolinum, 2011. 0 s. ISBN 978-80-246-1986-6.
Související články[upravit | editovat zdroj]
- Amyloidóza/PGS
- Alzheimerova choroba
- Amyloidóza ledvin
- Bence-Jonesova bílkovina
- Parkinsonova choroba
- Srdeční amyloidóza
Externí odkazy[upravit | editovat zdroj]
- HOLMES, JR., R. O.. Medscape : Amyloidosis [online]. ©2014. [cit. 5/2014]. <https://emedicine.medscape.com/article/335414-overview>.
- NYIRADY, J.. Medscape : Primary Systemic Amyloidosis [online]. ©2014. [cit. 5/2014]. <https://emedicine.medscape.com/article/1093258-overview>.
- DHAWAN, R.. Medscape : AA (Inflammatory) Amyloidosis [online]. ©2013. [cit. 5/2014]. <https://emedicine.medscape.com/article/335559-overview>.