Amyláza
(přesměrováno z AMS)
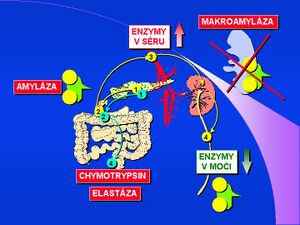
α-amyláza[1] [2] [3] [4] [5] [6] [7] [8] [9] [10] (AMS, α-1,4-glukan-4-glukan-hydroláza, EC 3.2.1.1) hydrolyzuje α-1-4-glykosidovou vazbu; pH optimum α-amylázy je mezi 7,0–7,2. V organismu se vyskytuje ve dvou formách – jako slinný a pankreatický izoenzym podle orgánového původu. Obě izoformy AMS se od sebe liší cukernou složkou a lze je odlišit elektroforeticky, či podle precipitace pomocí speciálního lektinu nebo protilátky[11]. α-amyláza je tvořena v acinárních buňkách pankreatu a hromadí se v zymogenních granulech. Do střevního lumen se dostává ve formě pankreatického sekretu (pankreatické šťávy) spolu s dalšími trávicími enzymy. Za fyziologických podmínek není molekula enzymu absorbována střevním povrchem a sérová hladina je nízká, odpovídající aktivitě enzymu uvolněného do cirkulace přímo ze žlázových buněk, resp. lymfatickou drenáží. Molekulová hmotnost α-amylázy je 55 000. Z cirkulace je α-amyláza eliminována v ledvinách glomerulární filtrací.
Makroforma enzymu (makroamyláza)[12] [13] [14] [15] [16] vzniká vazbou enzymu na některé bílkoviny krevního séra, především imunoglobuliny, cirkulující imunokomplexy nebo jiné glykoproteiny. Makroforma enzymu má podstatně vyšší molekulovou hmotnost (od 150 000 do 2 000 000) a není proto eliminována glomerulární filtrací. Pro klinickou diagnostiku se stanovuje hladina α-amylázy v séru, v moči a vypočítává se index clearance amylázy/kreatininu.
Laboratorní stanovení koncentrace α-amylázy
Laboratorně lze stanovovat koncentraci proteinu imunologickými technikami nebo enzymovou katalytickou koncentraci pomocí specifických substrátů. Při stanovení jak hmotnostní, tak katalytické koncentrace enzymu je nutno zvažovat přítomnost inhibitorů v séru a vznik makroforem enzymů. Běžně používané stanovení aktivity α-amylázy je založeno na štěpení chromogenního substrátu. Starší postupy, které používaly deriváty přirozeného substrátu, škrobu, byly obtížně standardizovatelné a již se nepoužívají. Současné syntetické substráty jsou odvozeny od maltózy, jako chromogen je nejčastěji používán 4-nitrofenylfosfát. Stanovení izoenzymů α-amylázy je umožněno inhibicí jednoho z obou izoenzymů specifickou monoklonální protilátkou.
Celková α-amyláza v diagnostice
Zvýšená hladina celkové aktivity α-amylázy je prokazatelná u celé řady onemocnění. Nejčastějším diagnostickým důvodem je podezření na akutní pankreatitidu. Hladina celkové α-amylázy je sice zvýšena ve 100 % onemocnění akutní pankreatitidou, zvýšena je však i v 80 % všech případů akutních bolestí břicha. Podstatně větší diagnostický přínos má stanovení pankreatického izoenzymu α-amylázy (P-amylázy), jehož hladina je rovněž zvýšena ve 100 % případů akutní pankreatitidy, u akutních bolestí břicha je zvýšena jen v 10 %. V běžné klinické praxi se používá kritéria pětinásobného zvýšení celkové amylázy, které je diagnostickým indikátorem akutní pankreatitidy. Zvýšená sérová hladina je samozřejmě prokazatelná u akutních i chronických onemocnění ledvin, u střevních zánětů ve 30 % případů akutní apendicitidy. Zvýšení hladiny α-amylázy v moči u akutní pankreatitidy přetrvává déle a nastupuje později než zvýšení hladiny v séru. Slinný typ α-amylázy (S-amyláza) je zvýšen u onemocnění slinných žláz, u některých plicních chorob, u řady maligních tumorů, ovariální cysty, mimoděložního těhotenství. Normální hodnoty poměru clearance amylázy a kreatininu jsou mezi 2–4 %, při pankreatitidě stoupá index na 10 %. Zvýšený index clearance amylázy/kreatininu byl prokázán např. u diabetické ketoacidózy, popáleninách, myelomu a u ledvinných poruch. Snížení indexu clearance je diagnosticky významné pro makroamylázémii.
Existují i specifické metody pro stanovení slinné α-amylázy, např. ELISA s monoklonální protilátkou.
Průkaz makroamylázového komplexu v séru
Makroamyláza a je příčinou 8–12 % případů hyperamylázemie (zvýšené hodnoty celkové sérové hladiny α-amylázy). Příčinou je makrokomplex enzymu s vysokomolekulárními proteiny séra, především s imunoglobuliny IgA a IgG. Obdobný makrokomplex tvoří i další enzymy a to např. pankreatická lipáza. Makroformu α-amylázy lze stanovit gelovou filtrací, elektroforeticky, precipitací s PEG nebo ELISA technikou. Kvantitativní stanovení poměru makroformy enzymu je nejpřesnější s použitím gelové chromatografie na Sephadexu® G-100. Separace probíhá v chlazeném boxu při 10 °C na koloně 9 × 150 mm při průtoku 3 ml/hod 5 hodin. Aktivita α-amylázy je v jednotlivých frakcích stanovena enzymaticky standardním postupem s pNP blokovaným maltoheptaosidem a výsledkem je poměr obou forem enzymu.
Důležitým aspektem pro průkaz makroamylázového komplexu je nestabilita komplexu s imunoglobuliny. Při zmražení a rozmražení séra dochází k disociaci komplexů, makroamylázu je proto nutné prokazovat v čerstvě odebraném vzorku séra.
Referenční hodnoty: Makroforma enzymu není za fyziologických podmínek přítomna. Výsledek testu je udáván v procentuálním poměru makroformy amylázy vypočtené z aktivit jednotlivých frakcí. Pozitivní výsledek, průkaz komplexu, je tedy hodnota > 0.
Stanovení pankreatické amylázy ve stolici
Stanovení pankreatické amylázy ve stolici[17] [18] [19] [20] je relativně málo používaný test, který je rovněž imunochemickým průkazem s protilátkou k lidské pankreatické amyláze – novinka, která se objevila v roce 2000. Normální hodnoty jsou nad 360 µg/g stolice, kalibrační standardy jsou v rozmezí 0–12 000 µg/g. Test je založen na ILMA (ImmunoLuminoMetric Assay) principu s luminiscenčním měřením markerem je akridinium ester. Původní práce o stanovení pankreatické amylázy ve stolici popisují především detekci izoenzymů a korelaci s dalšími pankreatickými enzymy ve stolici u nemocných s pankreatickou insuficiencí.
Odkazy
Zdroj
- se svolením autora převzato z KOCNA, Petr. GastroLab : MiniEncyklopedie laboratorních metod v gastroenterologii [online]. ©2002. Poslední revize 2011-01-08, [cit. 2011-03-04]. <http://www1.lf1.cuni.cz/~kocna/glab/glency1.htm>.
Reference
- ↑ CARROLL, Jennifer K, Brian HERRICK a Teresa GIPSON. Acute Pancreatitis: Diagnosis, Prognosis, and Treatment. American Family Physician [online]. 2007, vol. 75, no. 10, s. 1513-1520, dostupné také z <https://www.aafp.org/afp/2007/0515/p1513.pdf>. ISSN 0002-838X.
- ↑ KOCNA, Petr a Tomáš ZIMA. Hyperamylazémie, laboratorní a klinické aspekty. Časopis lékařů českých [online]. 2006, vol. 145, s. 449-452, dostupné také z <https://www.prolekare.cz/casopis-lekaru-ceskych-clanek?id=3093>. ISSN 1803-6597.
- ↑ QUARINO, L, Q DANG a J HARTMANN. An ELISA method for the identification of salivary amylase. Journal of forensic sciences. 2005, vol. 50, no. 4, s. 873-876, ISSN 0022-1198.
- ↑ SMITH, Ross C, James SOUTHWELL-KEELY a Douglas CHESHER. Should serum pancreatic lipase replace serum amylase as a biomarker of acute pancreatitis?. ANZ journal of surgery [online]. 2005, vol. 75, no. 6, s. 399-404, dostupné také z <https://onlinelibrary.wiley.com/doi/pdf/10.1111/j.1445-2197.2005.03391.x?cookieSet=1>. ISSN 1445-1433.
- ↑ PANTEGHINI, Mauro, Ferruccio CERIOTTI a Franca PAGANI, et al. Recommendations for the routine use of pancreatic amylase measurement instead of total amylase for the diagnosis and monitoring of pancreatic pathology. Clinical Chemistry and Laboratory Medicine [online]. 2002, vol. 40, no. 2, s. 97-100, dostupné také z <https://www.degruyter.com/doi/abs/10.1515/CCLM.2002.017>. ISSN 1434-6621.
- ↑ TREACY, John, Anthony WILLIAMS a Renz BAIS, et al. Evaluation of amylase and lipase in the diagnosis of acute pancreatitis. ANZ Journal of Surgery [online]. 2001, vol. 71, no. 10, s. 577-82, dostupné také z <https://onlinelibrary.wiley.com/doi/pdf/10.1046/j.1445-2197.2001.02220.x?cookieSet=1>. ISSN 1445-1433.
- ↑ PEZZILLI, R, G TALAMINIL a L GULLO. Behaviour of serum pancreatic enzymes in chronic pancreatitis. Digestive and Liver Disease. 2000, vol. 32, no. 3, s. 233-237, ISSN 1590-8658.
- ↑ KEIM, V, N TEICH a F FIEDLER, et al. A comparison of lipase and amylase in the diagnosis of acute pancreatitis in patients with abdominal pain. Pancreas. 1998, vol. 16, no. 1, s. 45-49, ISSN 0885-3177.
- ↑ CHASE, CW, DE BARKER a WL RUSSELL. Serum amylase and lipase in the evaluation of acute abdominal pain. The American surgeon. 1996, vol. 62, no. 12, s. 1028-1033, ISSN 0003-1348.
- ↑ MALFERTHEINER, P a J ENRIQUE DOMÍNGUEZ-MUÑOZ. Clinical and laboratory diagnosis of acute pancreatitis. Annali italiani di chirurgia. 1995, vol. 66, no. 2, s. 165-170, ISSN 0003-469X.
- ↑ RACEK, Jaroslav, et al. Klinická biochemie. 2. vydání. Praha : Galén, 2006. 329 s. s. 87. ISBN 80-7262-324-9.
- ↑ BERMEJO, JF, J CARBONE a JJ RODRIGUEZ, et al. Macroamylasaemia, IgA hypergammaglobulinaemia and autoimmunity in a patient with Down syndrome and coeliac disease. Scandinavian journal of gastroenterology. 2003, vol. 38, no. 4, s. 445-447, ISSN 0036-5521.
- ↑ LAWSON, GJ. Prevalence of macroamylasaemia using polyethylene glycol precipitation as a screening method. Annals of clinical biochemistry. 2001, vol. 38(Pt 1), s. 37-45, ISSN 0004-5632.
- ↑ VENTRUCCI, M, A CIPOLLA a M MIDDONNO, et al. Macroamylase detection in serum using selective precipitation: a rapid and reliable assay. Italian journal of gastroenterology and hepatology. 1999, vol. 31, no. 9, s. 846-849, ISSN 1125-8055.
- ↑ CUTOLO, M, A SULLI a A BARONE, et al. Macroamylasemia: a possible cause of unexplained hyperamylasemia in rheumatoid arthritis. British journal of rheumatology. 1995, vol. 34, no. 3, s. 290-292, ISSN 0263-7103.
- ↑ HORTIN, GL, AL SUMMERFIELD a TR WILHITE, et al. Detection of autoantibodies to amylase by ELISA: comparison of detection of macroamylase and free autoantibody. Clinical chemistry [online]. 1994, vol. 40, no. 12, s. 2254-2259, dostupné také z <http://clinchem.aaccjnls.org/content/clinchem/40/12/2254.full.pdf,>. ISSN 0009-9147.
- ↑ MORIYOSHI, Yuriko, Tadashi TAKEUCHI a Keiko SHIRATORI. Fecal isoamylase activity in patients with pancreatic diseases. Pancreas. 1991, vol. 6, no. 1, s. 70-76, ISSN 0885-3177.
- ↑ GROMASHEVSKAIA, LL, GF STREMETSKII a TV BOGATYR'. Opredelenie izofermentov amilazy v kale. Laboratornoe delo. 1981, roč. 1981, no. 10, s. 609-612, ISSN 0023-6748.
- ↑ MÜLLER, G. Fakale Enzymdiagnostik. Deutsche Zeitschrift für Verdauungs- und Stoffwechselkrankheiten. 1979, vol. 39, no. 6, s. 257-265, ISSN 0012-1053.
- ↑ HINTNER, I, G MÜLLER a A THEUNE. Bestimmungen von Isoenzymen der alkalischen Phosphatase und alpha-Amylase im Stuhl. Zeitschrift für die gesamte innere Medizin und ihre Grenzgebiete. 1977, roč. 15, vol. 32, no. 12, s. 292-295, ISSN 0044-2542.