Železo
(přesměrováno z Železo (patobiochemie))
Železo je jedním z nejdůležitějších prvků v lidském organismu. V těle dospělého člověka je obsaženo více než 70 mmol (4,0–4,5 g) železa. U žen je toto množství nižší než u mužů, což se přičítá ztrátám krve při menses.
| Forma | Funkce | Protein | Množství v g |
|---|---|---|---|
| Aktivní železo | transport kyslíku | hemoglobin | 2,5–3,0 |
| myoglobin | 0,3 | ||
| přenos elektronů | cytochromy, cytochromoxidáza | 0,2 | |
| rozklad peroxidu vodíku | kataláza, peroxidáza | ||
| Zásobní železo | feritin, hemosiderin | 0,8–1,0 | |
| Transportní železo | transferin | 0,003 | |
Metabolismus železa
Přítomnost železa je nezbytná pro funkci buněk. Jako součást hemu se účastní transportu kyslíku a jako součást cytochromů podmiňuje přenos elektronů v dýchacím řetězci. Nežádoucím účinkem železa jako přechodného a velmi reaktivního prvku je účast v radikálových reakcích, při nichž vznikají tzv. reaktivní formy kyslíku. Ty mohou poškozovat buněčné membrány, proteiny a DNA.
Železo se absorbuje jako Fe2+ aktivním transportem v duodenu a v horní části jejuna, a to dvěma způsoby:
- na porfyrin vázané Fe ve formě stabilního lipofilního komplexu;
- FeII+ – cheláty rozpustné ve vodě.
Jen nepatrná část se vstřebává v ionizované formě.
Ve stravě bývá průměrně 10–50 mg železa za den, ale vstřebá se pouze 10–15 %. Ve sloučeninách hemu (maso) se absorbuje lépe, nehemové Fe v rostlinné stravě mnohem hůře. Kromě toho rostliny obsahují oxaláty, fytáty, taniny a jiné fenolické sloučeniny, jež tvoří s Fe nerozpustné nebo chelátové komplexy, které se těžko vstřebávají. Askorbová kyselina na druhé straně absorpci železa zlepšuje.
Po vychytání střevní mukózou se část železa inkorporuje do zásobní formy – feritinu v intestinálních buňkách. Část absorbovaného železa přestupuje do plazmy, kde je transportováno ve vazbě na transferin. Důležitou roli při přenosu železa přes bazolaterální membránu enterocytů má protein ferroportin (nachází se i v membráně makrofágů a hepatocytů). Je to hlavní místo regulace homeostázy železa v organismu. Klíčovým faktorem regulace je protein hepcidin, který je syntetizován v játrech. Vazbou na ferroportin inhibuje transport železa z buněk a tím přispívá k jeho sekvestraci v nich. Hladina hepcidinu se zvyšuje při zánětu. Hepcidin je částečně zodpovědný i za anémii chronických chorob. Mutace genu pro hepcidin vedou k juvenilní hemochromatóze typu 2B.
Plazmatické železo je zachycováno buňkami cílových tkání prostřednictvím receptoru pro transferin a buď je zabudováno do hemu nebo uloženo do zásoby ve formě feritinu. Využití specifické transportní bílkoviny transferinu a zásobního proteinu feritinu pro uskladnění železa představuje ochranné mechanismy, které mají zamezit toxickému působení oxidoredukčně aktivního železa.
Při deskvamaci odumřelých slizničních buněk odchází nezužitkované železo stolicí spolu s nevstřebaným železem.
Metabolismus železa - YouTube video
Vyšetření metabolismu železa
V praxi se běžně setkáváme s onemocněními spojenými se změnami metabolismu a utilizace železa. Laboratorní vyšetření metabolismu železa zahrnuje následující vyšetření:
- železo v séru
- sérový transferin a vazebná kapacita pro železo
- sérový feritin
- transferinový receptor
Uvedené parametry jsou důležitými diagnostickými ukazateli pro průkaz poklesu či nárůstu zásob železa ještě ve stádiích, která nejsou doprovázena výraznými klinickými projevy.
Stanovení železa v séru
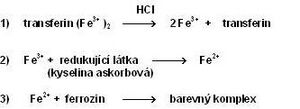
Pro stanovení železa v séru se používají kolorimetrické metody, atomová absorpční spektrofotometrie a další speciální techniky. Nejužívanější jsou fotometrické metody, založené na reakci železa s komplexotvornou látkou. Všechny postupy zahrnují následující kroky:
- Uvolnění Fe3+ z vazby na transferin pomocí kyselin nebo tenzidů (např. HCl).
- Redukce Fe3+ na Fe2+, která je nezbytná pro reakci s komplexotvorným činidlem. K redukci se používá např. kyselina askorbová.
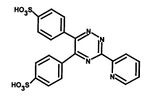
- Reakce Fe2+ s komplexotvorným činidlem obsahujícím reaktivní skupiny –N=C–C=N– za vzniku barevného komplexu. Ionty kovu vytvářejí cheláty s dvěma atomy dusíku. V současnosti se využívají především dvě komplexotvorné látky – bathofenentrolin a ferrozin (3-(2-pyridyl)-5,6-bis(4-sulfofenyl)-1,2,4-triazin – PST, chráněný název FerroZine®), který má vyšší absorpční koeficient a je lépe rozpustný ve vodě.
- Hodnocení
- Koncentrace sérového železa podléhají cirkadiánnímu rytmu a jsou ovlivněny i dalšími faktory. To omezuje diagnostický význam tohoto parametru. Je špatným ukazatelem tkáňových zásob železa a je nutné ho vždy posuzovat v kombinaci se sérovým transferinem a vazebnou kapacitou pro železo. Snížené koncentrace doprovázejí nedostatek železa, způsobený např. velkými nebo opakovanými krevními ztrátami, nedostatečným příjmem železa potravou nebo narušenou absorpcí. Nález není specifický, neboť se sníženými hladinami se setkáváme rovněž u akutní infekce nebo chronických zánětlivých onemocněních (přesun železa do tkání). Vysoké hladiny železa se vyskytují u hemochromatózy (viz níže), při předávkování nebo intoxikaci železem, při zvýšeném rozpadu erytrocytů a u některých jaterních onemocnění.
- Referenční hodnoty
- muži: 9–29 μmol/l
- ženy: 7–28 μmol/l
Sérový transferin a vazebná kapacita pro železo
Železo je transportováno krví ve vazbě na specifický protein s β1-elektroforetickou pohyblivostí – transferin, který je syntetizován v játrech. Rychlost jeho tvorby je nepřímo úměrná zásobám železa v organismu; zvyšuje se při nedostatku železa a při nadbytku klesá. Biologická funkce transferinu spočívá ve schopnosti snadno tvořit netoxické komplexy se železem a přenášet Fe absorbované sliznicí tenkého střeva do kostní dřeně nebo do zásobních forem (feritinu nebo hemosiderinu). Každá molekula transferinu váže dva atomy Fe3+ (1 g transferinu váže 25,2 μmol železa). Transferin může být stanoven přímo pomocí imunochemických metod nebo nepřímo jako schopnost transferinu vázat železo – tzv. vazebná kapacita pro železo. Celková vazebná kapacita pro železo (TIBC – total iron binding capacity) je množství železa, které je transferin schopen vázat v případě, že všechna vazebná místa jsou obsazena. Obvykle je železem nasycena pouze 1/3 transferinu – vázaná kapacita. Volný transferin bez navázaného železa představuje volnou vazebnou kapacitu (2/3 transferinu), která je k dispozici pro transport železa při zvýšených požadavcích.
Přepočet mezi koncentrací transferinu a celkovou vazebnou kapacitou:
- Celková vazebná kapacita [μmol/l] = transferin [g/l] · 25,2.
Referenční rozmezí pro koncentraci transferinu v séru (S-transferin) je 2,0–3,6 g/l a pro celkovou vazebnou kapacitu je 50–70 μmol/l.
Saturace transferinu
Z hodnot koncentrace železa a transferinu můžeme vypočítat saturaci transferinu (TfS), která je definována jako poměr sérové koncentrace železa k celkové vazebné kapacitě transferinu pro železo. Jedná se o citlivý parametr pro odhalení latentního nedostatku železa.
- Hodnocení saturace transferinu
- fyziologické hodnoty: 25–50 %
- snížení saturace při nedostatku železa: < 15 %
- zvýšení saturace při nadbytku železa: > 50 %
Feritin a hemosiderin
Feritin je nejdůležitější zásobní protein pro železo. Molekula feritinu je přizpůsobena vázat velké množství Fe3+ v rozpustné a netoxické formě pro organismus. Feritin je tvořen vnějším proteinovým obalem z 24 podjednotek – apoferitinem (Mr 440 000), ohraničujícím dutinu, ve které může být soustředěno až 4500 atomů železa ve formě oxyhydroxidu železitého (FeO·OH)n v mikrokrystalické podobě s fosfáty (FeO·OPO3H2). Vstup a výstup atomů železa umožňují póry mezi jednotlivými podjednotkami obalu molekuly feritinu. Normálně je jeho kapacita využita asi z 20 %. Ukládá se do buněk v játrech, slezině a střevní sliznici.
V krevním séru se feritin nachází ve velmi nízké koncentraci. Sérové koncentrace feritinu jsou měřítkem zásob železa v organismu. Nízké koncentrace indikují vyčerpání celkové tělesné rezervy železa a slouží k časnému odhalení anémie z nedostatku železa ještě v prelatentní fázi. Zvýšené koncentrace feritinu jsou doprovodným jevem vysokých tkáňových zásob železa. Dále se s nimi setkáváme u mnohých pacientů s onemocněním jater, některými maligními nádory (nádorový marker) nebo zánětlivými onemocněními (pozitivní reaktant akutní fáze).
Referenční rozmezí pro koncentraci feritinu v séru (S-feritin) je pro muže 30–300 μg/l a pro ženy 20–120 μg/l.
Hemosiderin je dalším zásobním proteinem pro železo. Vzniká agregací denaturovaného feritinu s dalšími komponentami. Vytváří partikule o velikosti 1 až 2 μm, které jsou při použití barvení na železo viditelné ve světelném mikroskopu. Hemosiderin obsahuje větší množství železa než feritin, ale vzhledem ke špatné rozpustnosti ve vodě je obtížně dostupné. Tvoří se za situace, kdy množství železa v organismu převýší skladovací kapacitu feritinu.
Transferinový receptor
Železo transportované krví transferinem je zachycováno buňkami prostřednictvím specifického transferinového receptoru (TfR). V určitém stádiu vývoje se nachází na povrchu všech buněk, nejvíce je však exprimován na povrchu prekursorů buněk červené řady v kostní dřeni. TfR je transmembránový protein, který je tvořen dvěma identickými podjednotkami, spojenými disulfidovou vazbou. Oddělením extracelulárních domén receptoru se do cirkulace uvolňuje tzv. solubilní (rozpustná) frakce transferinového receptoru (sTfR), který může být v podobě dimeru nebo monomeru. Buňky reagují na snížení zásob železa syntézou zvýšeného množství transferinových receptorů.
Zvýšení sTfR je spolehlivým ukazatelem nedostatku železa pro krvetvorbu. Se zvýšenými hladinami sTfR se setkáváme u anemií z nedostatku železa nebo u hemolytických anemií. Cenné je stanovení sTfR u anemických pacientů, u nichž je zvýšen feritin z důvodů reakce akutní fáze. Stanovení koncentrace sTfR je možno využít i u pacientů s transplantovanou kostní dření pro sledování průběhu erytropoézy.
Ke stanovení se používají imunochemické metody.
Poruchy metabolismu železa
Nedostatek železa (sideropenie)
Nedostatek železa v organismu bývá zpravidla způsoben jeho nedostatečným vstřebáváním ze střeva nebo chronickými ztrátami krve. Může vyústit v sideropenickou anémii (hypochromní mikrocytární anémie), která patří mezi nejčastější hematologická onemocnění. Anémie je však zpravidla pozdní příznak postupně se vyvíjející sideropenie. V krevním obraze se projeví až po téměř úplném vymizení železa. Proto je potřebné odhalit nedostatek železa v časném stádiu, které ještě není doprovázeno anémií.
Na základě stanovení základních parametrů metabolismu železa rozlišujeme tři stupně nedostatku:
- Prelatentní nedostatek železa je označení pro stav, kdy dochází k postupnému poklesu zásob, ale ještě není ovlivněna dodávka železa do erytroblastů kostní dřeně. Asi u poloviny nemocných jsou hladiny feritinu v séru snížené pod 12 μg/l.
- Při latentním nedostatku železa jsou jeho zásoby v podstatě vyčerpány. Feritin je snížen pod dolní hranici normy a je v tomto stádiu již doprovázen i snížením hladiny železa v séru a sníženou dodávkou do erytroblastů kostní dřeně. Zvyšuje se vazebná kapacita pro železo. Citlivým ukazatelem latentního nedostatku železa je pokles saturace transferinu pod 15 %. Nerozvíjí se však ještě anémie.
- Při manifestním nedostatku železa dochází k rozvoji anémie s poklesem hodnot hemoglobinu pod dolní hranici normy. U anémie z nedostatku železa je typický nález nízkého sérového železa a feritinu, je zvýšená koncentrace transferinu (vazebná kapacita pro železo). U hemolytických anémií nebo při nadbytku železa je naopak sérové železo zvýšené, současně je snížená celková vazebná kapacita pro železo.
| Prelatentní nedostatek železa | Latentní nedostatek železa | Manifestní nedostatek železa |
|---|---|---|
| snižování zásobního železa – pokles feritinu | nedostatek zásobního železa – pokles feritinu | nedostatek zásobního železa – pokles feritinu |
| snížení sérového železa | snížení sérového železa | |
| pokles saturace transferinu pod 15 % | pokles transferinu pod 10 % | |
| zvýšení celkové vazebné kapacity pro železo | zvýšení celkové vazebné kapacity pro železo | |
| zvýšení sTfR | zvýšení sTfR | |
| snížení koncentrace hemoglobinu – anémie |
- Výpočet deficitu železa
Výpočet deficitu železa pro intravenózní suplementaci[1]:
Tento prvek vyžaduje JavaScript.
Nadbytek železa
Organismus není vybaven exkreční cestou pro železo, a proto se za určitých okolností může přebytečné železo hromadit ve tkáních. Včasná diagnostika může zabránit poškození tkání nadbytkem železa. Přetížení železem se rozvíjí většinou velmi pomalu. Rozlišujeme 3 stádia:
- Ve stádiu prelatentního nadbytku železa se zvyšuje jeho obsah v orgánech, ale bez překročení jejich zásobní kapacity.
- V období latentního stádia přetížení železem je překročena zásobní kapacita buněk, ale ještě není poškozena funkce orgánů, zvyšuje se hladina feritinu i hladina železa v séru a stoupá saturace transferinu nad 55 %.
- Ve fázi manifestního nadbytku železa jsou již poškozeny některé orgány.
| Prelatentní nadbytek železa | Latentní nadbytek železa | Manifestní nadbytek železa |
|---|---|---|
| zvyšování zásob železa – zvýšení feritinu | zvyšování zásob železa – zvýšení feritinu nad 300 μg/l | zvyšování zásob železa – zvýšení feritinu (při těžkém postižení nad 2000 μg/l) |
| zvýšení železa v séru | výrazné zvýšení železa v séru | |
| zvýšení saturace transferinu nad 55 % | zvýšení saturace transferinu (při těžkém postižení může převýšit 90 %) |
Hemochromatóza
Hromadění železa v tkáních souvisí s onemocněním, které označujeme jako hemochromatóza.
- Primární hemochromatóza je dědičné onemocnění způsobené zvýšenou resorpcí železa ze střeva. Přebytečné železo se ukládá v parenchymatózních orgánech jako jsou játra, srdce, pankreas, nadledviny. V postižených orgánech působí toxicky a narušuje jejich funkci tím, že může katalyzovat chronické reakce vedoucí k tvorbě volných radikálů. Hlavními klinickými projevy jsou hyperpigmentace kůže, hepatosplenomegalie a diabetes mellitus.
- Sekundární hemochromatóza se může vyvinout jako následek např. opakovaných transfuzí, nadbytečného příjmu přípravků obsahujících železo nebo hemolytické anémie. V biochemickém obraze nalézáme zvyšující se hladiny feritinu a železa v séru, stoupá saturace transferinu při jeho současném poklesu.
Otrava železem
Náhodné požití většího množství přípravků hrozí dětem (tablety podobné lentilkám). Smrtelná dávka pro dítě je 600 mg. Pro dospělého je příjem železa 40 mg/ kg toxikologicky závažný, příjem 60 mg/kg je smrtelný[2].
Příznaky zahrnují nevolnost, zvracení (i zvracení krve), bolesti břicha, průjem (někdy krvavý). Velké ztráty tekutin jsou příčinou šoku, selhání ledvin a smrti. Pokud nemocný přežije tuto fázi otravy, může po 12 hodinách upadnout do bezvědomí, křečí a jaterního selhání. Přežije-li i tuto druhou fázi, otrava může zanechat trvalé následky (poškození střeva).
- Léčba akutní otravy
- Výplach žaludku.
- Nasogastrální sondou podat chelační činidlo deferoxamin
 (5–10 g do 50–100 ml vody).
(5–10 g do 50–100 ml vody). - Zvážit intravenózní podání desferoxaninu k vyvázání vstřebaného železa. V moči se objeví růžově červený komplex deferoxaminu se železem. Léčbu je třeba opakovat do té doby, než se barva moči vrátí k normě[2].
Odkazy
Související články
| Další kapitoly z knihy MASOPUST, J., PRŮŠA, R.: Patobiochemie metabolických drah: | |
|
Zdroj
- MASOPUST, Jaroslav a Richard PRŮŠA. Patobiochemie metabolických drah. 2. vydání. Univerzita Karlova, 2004. 208 s. s. 119–120.
Použitá literatura
- wikipedia: Human iron metabolism
- wikipedia: Hepcidin
- wikipedia: Ferroportin
- wikipedia: Iron overload
- ↑ KOCH, Todd A., Jennifer MYERS a Lawrence Tim GOODNOUGH. Intravenous Iron Therapy in Patients with Iron Deficiency Anemia: Dosing Considerations. Anemia. 2015, vol. 2015, s. 1-10, ISSN 2090-1267. DOI: 10.1155/2015/763576.
- ↑ a b ŠEBKOVÁ, Sylva. Otrava železem [online]. ©2003. Poslední revize 2003-10-06, [cit. 2021-08-16]. <http://medicina.cz/clanky/5819/34/Otrava-zelezem/>.



![{\displaystyle {\mbox{Saturace transferinu}}[\%]={\frac {{\mbox{S-}}{\check {\mbox{z}}}{\mbox{elezo}}[\mu {\mbox{mol/l}}]}{{\mbox{ S-transferin }}[{\mbox{g/l}}]\times 25,2}}\times 100}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d5561698408db44cd3fac37bce267b80cb6c8529)

