Polymerázová řetězová reakce
Pro molekulární vyšetření je často potřebné získat poměrně velké množství určitého úseku DNA. Až do roku 1983 existoval jediný způsob, jak úsek DNA namnožit, pokud nebylo možné jej v dostatečném množství přímo izolovat z odebraného materiálu: vnést jej do bakteriálního plasmidu a klonovat. Dnes se totéž dělá ve stále větším měřítku zcela in vitro pomocí polymerasové řetězové reakce (polymerase chain reaction, PCR). Reakce probíhá v termocykleru, tento přístroj mění teplotu v požadovaných intervalech.
PCR vymyslel Kary Mullis v roce 1983[1], když v kalifornských horách při řízení auta přemýšlel o modifikacích sekvenačních technik pomocí dideoxynukleotidů. O deset let později za svůj objev získal Nobelovu cenu. Vynález PCR byl pro molekulární biology vpravdě převratem a v současné době je PCR, díky své citlivosti, specifičnosti a rychlosti, asi nejpoužívanější technikou v tomto oboru.
Princip[upravit | editovat zdroj]
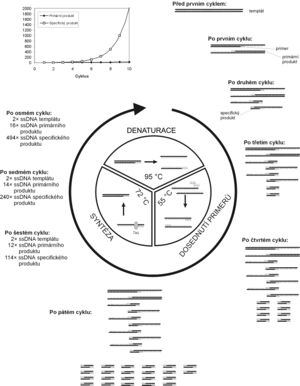
Základním principem PCR je opakovaná řízená denaturace dvouřetězcové DNA a následná renaturace osamocených řetězců se specifickými oligonukleotidy, které jsou v reakční směsi v nadbytku. Tyto oligonukleotidy slouží následně jako primery pro syntézu nového řetězce DNA. Amplifikace DNA probíhá v opakujících se cyklech, které mají tři kroky:
- 1. Denaturace.
- Zahřátím DNA na teplotu kolem 95 °C se rozpadnou vodíkové můstky mezi vlákny DNA, čímž se dsDNA rozdělí na ssDNA.
- 2. Hybridizace (dosednutí primerů).
- V literatuře se tato fáze často označuje anglickým termínem annealing (to anneal = žíhat, kalit kov nebo sklo, tj. po rozpálení je prudce ochladit). Probíhá nejčastěji při teplotách kolem 50–60 °C. Molekuly jednořetězcové DNA po ochlazení opět renaturují. Pokud jsou ve směsi v nadbytku specifické oligonukleotidy, budou hybridizovat se svou komplementární sekvencí rychleji než dlouhé jednořetězcové molekuly, jejichž koncentrace je mnohem nižší. Teplota, při níž hybridizace probíhá, je pro výsledek PCR kritická a musí být vhodně nastavena pro použitý pár primerů. Při příliš nízké teplotě mohou primery nasedat i na sekvence, které jsou komplementární jen z části, a vytvoří se tak nespecifický produkt. Při příliš vysoké teplotě zase budou primery málo hybridizovat a produktu se nevytvoří dostatečné množství.
- 3. Elongace, extenze, syntetická fáze.
- Syntéza nových řetězců probíhá při teplotě 65–75 °C. Oligonukleotidy, které dosedly na jednořetězcovou DNA (templát) v předchozím kroku, slouží v tomto kroku jako primery pro DNA polymerasu. Od jejich 3´-konce začíná syntéza nového řetězce komplementárního s templátem.
Po prvním cyklu PCR se počet řetězců DNA ve směsi zdvojnásobí. V dalším cyklu mohou jako templát pro polymerasu sloužit i nově vytvořené řetězce, takže se nasyntezuje dvojnásobné množství produktu. Při opakujících se cyklech bude množství vytvořených řetězců přibývat exponenciálně.
Nové molekuly DNA se začínají syntezovat od primeru. V prvním cyklu, kdy jako templát slouží dlouhá molekula původní DNA, vzniknou řetězce, které jsou sice kratší než templát, ale vždy z jedné strany přesahují úsek vymezený oběma primery (primární produkt). Pokud v dalších cyklech jako templát slouží takto vytvořený primární produkt, vytvoří se podle něj úsek DNA o délce přesně ohraničené polohou obou použitých primerů (od jednoho primeru bude syntéza začínat a v místě druhého skončí, neboť v tomto místě končí primární produkt). Právě těchto specifických produktů o přesně vymezené délce bude v průběhu PCR přibývat exponenciálně, zatímco delších řetězců jen lineárně. Po 30 cyklech PCR se teoreticky vytvoří asi 109× více specifického produktu než ostatních úseků DNA, jejichž podíl je tak ve výsledné směsi prakticky zanedbatelný.
Skutečný výtěžek PCR bývá podstatně nižší než zmíněných 109 kopií na jednu molekulu DNA po 30 cyklech. To je dáno postupným vyčerpáváním složek reakce v průběhu amplifikace. Po určitém počtu cyklů dosáhne koncentrace produktu plató a dále se již prakticky nezvyšuje.
Složky reakční směsi[upravit | editovat zdroj]
Templát[upravit | editovat zdroj]
Požadavky na templátovou DNA pro PCR nejsou vysoké, pro reakci často stačí i velmi malé množství nukleové kyseliny. Je však nutné, aby vzorek nebyl kontaminován žádnou jinou DNA, která by se do něj mohla dostat z nedostatečně čistých pomůcek, rukou pracovníka a podobně. I nepatrná příměs kontaminující DNA by se mohla v průběhu reakce namnožit natolik, že by vzniklo detekovatelné množství produktu a výsledek vyšetření by byl zkreslen. Kromě toho vzorek s templátovou DNA nesmí obsahovat látky, které by inhibovaly DNA polymerasu. Jde často o běžné reagencie používané při izolaci, čištění a zpracovávání DNA (fenol, proteinasa K, vyšší koncentrace solí, heparin, kyselina boritá, ethanol, EDTA apod.).
Primery[upravit | editovat zdroj]
Jako primery se zpravidla používají oligonukleotidy o délce 17 až 28 nukleotidů. Aby reakce dobře probíhala, měly by primery splňovat několik požadavků:
- primery musejí být specifické pro amplifikovanou sekvenci a měly by být pokud možno zcela komplementární k úseku, na který mají dosedat,
- primery by spolu neměly být vzájemně komplementární, jinak se samy začnou chovat jako templáty a během PCR se budou tvořit jejich dimery (to platí zvlášť o jejich 3-´koncích),
- primer by neměl obsahovat vnitřně komplementární sekvence, aby nedocházelo k vnitřní hybridizaci (tvorbě „smyček“),
- rozložení AT a CG párů by mělo být pokud možno rovnoměrné, zejména 3´-konec by neměl být příliš bohatý na CG,
- teploty, při kterých dosedají oba použité primery, by se neměly výrazně lišit,
- teplota tání primeru alespoň 50 °C,
- podobná teplota tání obou primerů.
Je zřejmé, že pro PCR reakci jsou nutné dva primery. Primer, kterým začíná 5‘-konec řetězce genu a v průběhu PCR se elonguje ve směru transkripce, se označuje jako kódující, forward primer nebo upstream primer. Druhý primer se pak označuje přívlastky antikódující, reverse nebo downstream.
Polymerasa[upravit | editovat zdroj]
Teoreticky by se pro PCR dala použít jakákoli DNA polymerasa. Vzhledem k vysoké teplotě v denaturační fázi, při níž by došlo k denaturaci enzymu, by však bylo nutné polymerasu přidávat v každém cyklu. Proto se dnes pro PCR používají termostabilní DNA polymerasy, původně izolované z bakterií žijících v horkých pramenech. Nejvýznamnějším zástupcem je tzv. Taq polymerasa z bakterie Thermus aquaticus. Její teplotní optimum se pohybuje kolem 75 °C, kdy dokáže k primeru přidat asi 150 bází za sekundu. Při teplotě nad 90 °C není aktivní, ale dostatečně odolává denaturaci.
Polymerasy pro PCR se dnes vyrábějí rekombinantními technologiemi. Kromě zmíněné Taq polymerasy se používá několik dalších enzymů, které např. mají vyšší aktivitu, jsou termostabilnější, dokáží syntezovat delší řetězce (Taq polymerasa po několika stovkách připojených bazí od řetězce „odpadne“) nebo mají 3‘-exonukleasovou aktivitu, která jim umožňuje opravit chybně zařazený nukleotid (Taq polymerasa udělá jednu chybu na 10 až 20 tisíc zařazených bazí).
Základní reakční roztok[upravit | editovat zdroj]
Reakční směs musí obsahovat i další součásti. Kromě všech čtyř deoxynukleotidtrifosfátů (dATP, dTTP, dCTP, dGTP) se do ní přidává pufrující složka a soli, jimiž se nastaví vhodná iontová síla prostředí. Zásadní součástí jsou hořečnaté ionty, které působí jako kofaktor polymerasy. Příliš nízká koncentrace Mg2+ může mít za následek nízký výtěžek reakce, naopak příliš vysoká koncentrace může vést k tvorbě nespecifických produktů. Další složky reakční směsi (albumin, síran amonný, betain aj.) mohou stabilizovat polymerasu či zlepšit specifičnost produktu.
Některé modifikace PCR[upravit | editovat zdroj]
Horký start[upravit | editovat zdroj]
DNA polymerasa je aktivní i při teplotách nižších, než je její teplotní optimum, ačkoli je rychlost katalyzované reakce podstatně nižší. Po namíchání reakční směsi mohou při nízké teplotě primery hybridizovat s nespecifickými místy templátu a polymerasa od nich může syntezovat nespecifické produkty až do chvíle, kdy se zahájí PCR a dojde k denaturaci. Vzniku nespecifických produktů lze předejít tím, že se do reakční směsi nepřidá některá ze složek reakce a doplní se až po zahřátí na denaturační teplotu. Aby se zkumavky nemusely otevírat, může se tato oddělená složka vložit např. ve voskové kuličce, která se po zahřátí rozpustí. Jinou, dnes nejpoužívanější možností, je použití DNA polymerasy inaktivované protilátkou. Po zvýšení teploty se protilátka denaturuje a uvolní se tak z enzymu.
„Přistávací“ (touchdown) PCR[upravit | editovat zdroj]
Pokud při PCR vzniká velké množství nespecifických produktů, lze jejich tvorbu omezit použitím touchdown PCR. V prvních cyklech se použije vyšší hybridizační teplota, než by odpovídalo zvoleným primerům. Primery budou hůře nasedat na templát, tj. výtěžek reakce bude nižší, budou však nasedat velmi přesně a vytvoří se pouze specifický produkt. V dalších cyklech se teplota hybridizace postupně snižuje. Nadbytek specifického produktu nad původním templátem již zajistí specifičnost reakce a díky lepšímu nasedání primerů při nižší teplotě se vytvoří dostatečné množství produktu.
Amplifikace dlouhých řetězců[upravit | editovat zdroj]
Nejběžnější polymerasa používaná pro PCR, Taq polymerasa, nedokáže syntezovat řetězce delší než přibližně 2000 párů bází; po určité době se z templátové DNA uvolní a syntéza se přeruší. Navíc nedokáže opravit nesprávně zařazený nukleotid, takže by při syntéze dlouhých řetězců docházelo k nezanedbatelnému množství chyb. Pokud je potřeba amplifikovat dlouhý úsek DNA (až 30–40 tisíc bází), používá se obvykle směsi několika termostabilních DNA polymeras, přičemž se zpravidla kombinují enzymy s opravnou aktivitou a bez ní. V anglofonní literatuře se PCR dlouhých řetězců označuje jako long distance PCR (LD-PCR).
Reamplifikace[upravit | editovat zdroj]
Pokud je k dispozici jen velmi malé množství templátové DNA, nemusí být výtěžek obvyklé PCR dostatečný. V tom případě lze část PCR produktu použít jako templát pro další PCR – mluvíme o reamplifikaci. Namnožení DNA v první PCR lze někdy dosáhnout pouze za cenu, že vzniknou i nespecifické produkty. Aby se ve druhé PCR amplifikovaly jen žádoucí, specifické fragmenty, používá se často jiný pár primerů, který leží mezi primery použitými pro první amplifikaci (tj. ve druhé PCR se množí kratší úsek než v první). Tento přístup se označuje jako zahnízděná (nested) PCR.
Alelově specifická PCR[upravit | editovat zdroj]
Samotnou PCR lze použít pro detekci určité alely nebo pro vyhledávání nějaké mutace. Podmínkou je, že musí být k dispozici primer pro úsek, ve kterém se daná alela liší od ostatních, nebo ve kterém leží hledaná mutace. Pokud vyšetřovaná DNA obsahuje odpovídající sekvenci, amplifikace proběhne normálně a na konci PCR vznikne detekovatelné množství produktu. V opačném případě primer nedosedne a úsek DNA se nenamnoží. Reakci je pochopitelně nutné doplnit vhodnými pozitivními a negativními kontrolami.
Příprava jednovláknové DNA[upravit | editovat zdroj]
Pro některé techniky je nutné získat jednovláknovou DNA. Dá se toho dosáhnout tzv. asymetrickou PCR, při níž se do reakce vkládají různá množství primerů (obvykle v poměru 50:1 až 100:1). V průběhu PCR bude nejprve vznikat obvyklým způsobem dvojvláknová DNA, které bude přibývat exponenciálně. Po přibližně 20 cyklech však dojde k vyčerpání „menšinového“, limitujícího primeru. V následujících cyklech se bude tvořit jen jedno vlákno (začínající „nadbytkovým“ primerem) a tohoto jednovláknového produktu bude přibývat lineárně.
Jinou možností je provedení PCR s jedním primerem označeným biotinem. PCR produkt se pak denaturuje a přečistí se na pevné fázi (např. agarosové kolonce), na kterou je navázán streptavidin. Biotin má ke streptavidinu vysokou afinitu, takže označené vlákno se na pevné fázi zachytí, zatímco druhé vlákno a zbytky reakční směsi se odplaví.
PCR spojená s reverzní transkripcí (RT-PCR)[upravit | editovat zdroj]
RT-PCR se používá, pokud je potřeba namísto DNA amplifikovat mRNA. Prvním krokem je izolace celkové RNA nebo mRNA ze vzorku tkáně. Následuje převedení mRNA na cDNA pomocí reverzní transkriptasy a posléze běžná PCR. I když vlastní přepis RNA do cDNA není zvlášť obtížný, je tato metoda technicky podstatně náročnější než samotná amplifikace DNA: RNA se rychle degraduje účinkem ribonukleas, které jsou obecnými kontaminanty vzorků, pomůcek i chemikálií. RNasy jsou navíc termostabilní, nepoškodí je ani sterilizace autoklávováním a aktivitu si zachovávají i po čištění materiálu některými denaturačními činidly. Aby se zabránilo degradaci RNA, ošetřují se pomůcky a roztoky inhibitory RNas (např. diethylpyrokarbonátem, DEPC).
Kvantitativní PCR[upravit | editovat zdroj]
Polymerasová řetězová reakce se ve svém základním uspořádání používá především ke kvalitativním stanovením. Použití pro kvantifikaci určité sekvence ve vzorku (např. pro měření exprese nějakého genu) ztěžuje skutečnost, že po určitém počtu cyklů se rychlost amplifikace zpomalí (viz výše). Přesto existují postupy, které kvantifikaci templátu umožňují. Bývají založené na měření množství PCR produktu v průběhu amplifikace (tzv. PCR v reálném čase – real-time PCR). Protože odebírání vzorků z reakční směsi by snadno vedlo ke kontaminacím a nepřesnostem, používají se postupy umožňující stanovit syntézu produktu bez otevření zkumavky.
TaqMan PCR[upravit | editovat zdroj]
Příkladem může být tzv. TaqMan PCR. Kromě primerů se do reakce vkládá další oligonukleotid, který dosedá na amplifikovaný úsek. Tento oligonukleotid je na jednom konci označený fluorescenční značkou (na obr. označena S) a na druhém konci nese tzv. zhášeč (Z). Pokud je fluorescenční látka v těsné blízkosti zhášeče, je její fluorescence potlačena. Vlastní PCR probíhá obvyklým způsobem až do okamžiku, kdy DNA polymerasa při syntéze nového řetězce narazí na značený nukleotid. V tom okamžiku jej začne vytěsňovat z templátového vlákna a štěpí jej (Taq polymerasa sice nemá opravnou 3‘-exonukleasovou aktivitu, ale má 5‘-exonukleasovou aktivitu, která degradaci „překážejícího“ řetězce umožňuje). Tím se uvolní fluorescenční sonda do roztoku a ve speciálním PCR cykleru je možné měřit fluorescenci přímo ve zkumavce v průběhu amplifikace. Intenzita fluorescence je úměrná množství nasyntezovaného PCR produktu.
Multiplexní polymerázová řetězová reakce[upravit | editovat zdroj]
Multiplexní polymerázová řetězová reakce (Multiplex PCR) se používá k současné amplifikaci několika různých sekvencí DNA (jako by se provádělo mnoho samostatných PCR reakcí, a to všechny společně v jedné reakci). Tento proces amplifikuje DNA ve vzorcích pomocí několika různých dvojic primerů. Jejich návrh musí být optimalizován tak, aby všechny páry primerů mohly během PCR pracovat při stejné teplotě nasedání.
Multiplex PCR byla poprvé popsána v roce 1988. V roce 2020 byly navrženy multiplexní testy RT-PCR, které kombinovaly více genových cílů z Centra pro nemoci a kontrolu v jediné reakci, aby se zvýšila dostupnost a propustnost molekulárního testování pro diagnostiku SARS-CoV-2 .
Multiplex-PCR se skládá z více sad primerů v rámci jediné PCR směsi pro produkci amplikonů různých velikostí, které jsou specifické pro různé sekvence DNA. Zacílením na více sekvencí najednou lze získat další informace z jednoho testu, který by jinak vyžadoval několikanásobek reagencií a více času na provedení. Teploty nasedání pro každou sadu primerů musí být optimalizovány, aby fungovaly správně v rámci jedné reakce, a velikosti amplikonů, tj. jejich délka páru bází, by měly být dostatečně odlišné, aby při vizualizaci gelovou elektroforézou vytvořily odlišné pásy. Pro použití v real-time PCR jsou různé amplikony odlišeny a vizualizovány pomocí primerů, které byly obarveny fluorescenčními barvivy různých barev. Komerční multiplexní soupravy pro PCR jsou dostupné a používané mnoha forenzními laboratořemi k amplifikaci degradovaných vzorků DNA.
obrázek: https://www.nature.com/articles/s41598-018-37732-y/figures/2
Odkazy[upravit | editovat zdroj]
Externí odkazy[upravit | editovat zdroj]
- Wikipedia:PCR (anglicky)
- Wikipedia:cs:Polymerázová řetězová reakce
- https://en.wikipedia.org/wiki/Multiplex_polymerase_chain_reaction
Reference[upravit | editovat zdroj]
- ↑ MULLIS, K B. The unusual origin of the polymerase chain reaction. Sci Am [online]. 1990, vol. 262, no. 4, s. 56-61, 64-5, dostupné také z <http://www.ciens.ucv.ve:8080/generador/sites/labgeneticageneral/archivos/seminario%208-%20The%20Unusual%20Origin%20of%20PCR.pdf>. ISSN 0036-8733.
Zdroje[upravit | editovat zdroj]
- ŠMARDA, Jan. Metody molekulární biologie. 1. vydání. Brno : Masarykova univerzita, 2005. ISBN 80-210-3841-1.
.