Metabolické změny v buňce při anoxii a ischemii
Anoxie je stav, kdy tkáně nemají dostatečný přísun kyslíku. Ischemie je stav, kdy do tkáně proudí malé množství krve, případně se nedokrvuje vůbec. Ischemie i anoxie souvisí s nedostatečnou dodávkou kyslíku tkáním. Ischemické poruchy patří mezi nejčastější příčiny smrti (ICHS, CMP). Snížený přísun kyslíku vede v mitochondriích k poruše oxidativní fosforylace a ke ztrátě tvorby ATP.
Metabolické změny[upravit | editovat zdroj]
Při hypoxii dochází k přechodu zisku energie degradací glykogenu a anaerobní glykolýzou. Dochází k přeměně pyruvátu na laktát. Hromadění laktátu podmíní pokles pH a dochází k rozvoji acidózy.
Anaerobní glykolýza má mnohem nižší energetický výtěžek než aerobní, čímž dojde k úbytku ATP (nedostatek energie pro buňky). Buňka je schopna adenylátkinázou vytvářet ATP ze dvou molekul ADP. Jako vedlejší produkt vzniká AMP, který je odbouráván na hypoxantin. Některé buňky (srdeční, nervové) nejsou schopny dále hypoxantin metabolizovat a hromadí se v nich.
ADP + ADP → ATP + AMP
Iontový rozvrat[upravit | editovat zdroj]
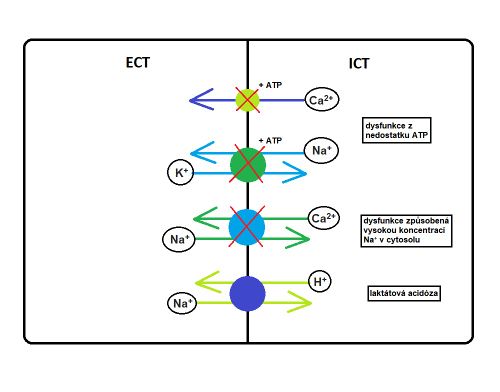
Nedostatek ATP znemožňuje správnou funkci Na+/K+-ATPázy. Dochází tak k iontovému rozvratu. Draslík vystupuje ven z buňky stále otevřenými kanály (leak channels). Sodík se na buněčné membráně směňuje za protony, čímž dojde ke zvýšení jeho koncentrace intracelulárně (s tím i vody). To je příčinou vzniku intracelulárního edému a snížení pH extracelulárně.
Zvýšení intracelulárního kalcia[upravit | editovat zdroj]
Za normálních okolností se na udržování koncentrace vápníku podílí kalciová ATPázová pumpa, která udržuje velmi nízkou koncentraci Ca2+ intracelulárně (0,1 μmol) a relativně vysokou koncentraci Ca2+ extracelulárně (2,5 mmol).
Intracelulární koncentrace vápníku nad 1 μmol způsobí vznik signálu. Kalcium může přecházet do cytosolu z vnějšího prostředí (ligandem aktivované Ca2+ kanály, napětím řízené Ca2+ kanály) nebo ze zásob v endoplazmatickém retikulu (PI3 receptor/kanál, ryanodinový receptor/kanál).
- Fyziologická funkce vápníku
Udržení nízké koncentrace Ca2+ v buňce je nesmírně důležité, jelikož vápník působí jako druhý posel v mnoha důležitých biochemických procesech.
Aktivace řady enzymů:
- fosfolipázy (poškození membránových fosfolipidů);
- Ca/kalmodulin-dependentní proteinkinázy;
- endonukleázy (fragmentace DNA);
- endoteliální a neuronální NO-syntázy (eNOS, nNOS);
- některé fosfatázy;
- kalpainy (Ca-aktivované non-lysozomální proteázy).
Podílí se také na svalové kontrakci, uvolnění hormonů a neurotransmiterů, regulaci genové exprese, skladbě cytoskeletu a na procesech v mitochondriích (regulace respirace, indukce MPT).
Poškození mitochondrií[upravit | editovat zdroj]
Transport vápníku do mitochondrií je zajišťováno Ca2+ uniporterem. Dochází k facilitované difuzi díky protonové pumpě a rozdílnému náboji na membráně. Uvnitř mitochondrií stimuluje mitochondriální enzymy (pyruvátdehydrogenáza, isocitrátdehydrogenáza a 2-oxoglutarátdehydrogenáza).
Mitochondrie napomáhá buňce sekvestrovat nadbytečné množství cytoplazmatického kalcia. Vlivem hypoxie dojde k překročení prahové intramitochondriální koncentrace Ca2+, což vede k otevření tzv. MPT.
- MPT (mitochondrial permeability transition pore)
Megakanál ve vnitřní mitochondriální membráně, který je propustný pro všechny molekuly menší než 1500 daltonů. Jeho otevření je podmíněno určitým množstvím vápníku v mitochondriální matrix. Dále ho mohou stimulovat oxidanty, depolarizace a anorganický fosfát. Inhibovat otevření MPT mohou protony, Mg2+, ATP, ADP a cyklosporin A.
Fyziologicky slouží MPT k výhodnému efluxu vápníku z mitochondrie (kalciová signalizace). Patologicky navozuje buněčnou smrt (apoptóza, nekróza), případně označuje staré mitochondrie pro autofagii. Otevřením MPT dojde ke kolapsu potenciálu vnitřní membrány a následnému vyrovnání protonového gradientu. Dojde k inhibici respirace. Následuje zbobtnání mitochondrií, uvolnění cytochromu c do cytosolu a následná apoptóza buňky.
Snížené pH při ischemii chrání před vznikem MPT. Problém nastává při reperfuzi.