Histochemie: Porovnání verzí
m (Robot: kosmetické úpravy) |
značka: editace z Vizuálního editoru |
||
| Řádek 20: | Řádek 20: | ||
Diagnosticky významné je prokazování určitých látek v těle ať už v případě soudního lékařství (zde např. kvůli otravám – As, Pb, Hg, Ag) nebo v patologii kvůli odchylkám od norem výskytu látek (Ca, Fe, Zn, Al). | Diagnosticky významné je prokazování určitých látek v těle ať už v případě soudního lékařství (zde např. kvůli otravám – As, Pb, Hg, Ag) nebo v patologii kvůli odchylkám od norem výskytu látek (Ca, Fe, Zn, Al). | ||
* '''[[Vápník|Ca]]''' | * '''[[Vápník|Ca]]''' se v těle vyskytuje v rozpustné, nerozpustné, ionizované i neionizované formě. Prokazuje se např. ionizovaný díky barvení [[Barvení hematoxylin-eosin|HE]] modře v alkalické reakci (pH > 9). | ||
* '''[[Železo|Fe]]<sup>3+</sup>''' se prokazuje pomocí Perlsovy reakce (viz níže) | * '''[[Železo|Fe]]<sup>3+</sup>''' se prokazuje pomocí Perlsovy reakce (viz níže). | ||
* '''Zn''' jako součást inzulinu, či jako kofaktor mnohých enzymů se prokazuje pomocí zinconu s modrým výsledkem, dithizonem s červeným výsledkem | * '''Zn''' jako součást inzulinu, či jako kofaktor mnohých enzymů se prokazuje pomocí zinconu s modrým výsledkem, dithizonem s červeným výsledkem | ||
=== Perlsova reakce === | === Perlsova reakce === | ||
[[Soubor:Ring Sideroblast smear 2010-01-13.JPG|náhled|sideroblasty obarvené Perlsovou reakcí]] | [[Soubor:Ring Sideroblast smear 2010-01-13.JPG|náhled|sideroblasty obarvené Perlsovou reakcí]] | ||
Perlsova reakce slouží k odlišení [[lipofuscin]]u, [[hematoidin]]u a [[hematin]]u, které jsou Perls negativní. Tato reakce se používá k průkazu [[hemosiderin]]u. Hemosiderin je zásobní forma železa, která je uložena ve formě depositů v buňkách zvaných siderofágy. Siderofágy (= makrofágy) jsou fagocytující buňky, které pohlcují počkozené nebo staré erytrocyty. A právě reakcí mezi železnatými | Perlsova reakce slouží k odlišení [[lipofuscin]]u, [[hematoidin]]u a [[hematin]]u, které jsou Perls negativní. Tato reakce se používá k průkazu [[hemosiderin]]u. Hemosiderin je zásobní forma železa, která je uložena ve formě depositů v buňkách zvaných siderofágy. Siderofágy (= makrofágy) jsou fagocytující buňky, které pohlcují počkozené nebo staré erytrocyty. A právě reakcí mezi železnatými ionty obsaženými v hemosiderinu a žlutou krevní solí v erytrocytech vzniká modrá sraženina tzv. Berlínská (pruská) modř. | ||
;Metodika barvení | ;Metodika barvení | ||
Složení barvícího roztoku | Složení barvícího roztoku | ||
# | # ferrokyanid draselný | ||
# destilovaná voda | # destilovaná voda | ||
# kyselina chlorovodíková (2%) | # kyselina chlorovodíková (2%) | ||
| Řádek 38: | Řádek 38: | ||
=== PAS reakce === | === PAS reakce === | ||
[[Soubor:Esophageal candidiasis (2) PAS stain.jpg|náhled|kandidóza zvýrazněná PAS reakcí]] | [[Soubor:Esophageal candidiasis (2) PAS stain.jpg|náhled|kandidóza zvýrazněná PAS reakcí]] | ||
PAS ('''P'''eriodic '''A'''cid '''S'''chiff) reakce je založena na | PAS ('''P'''eriodic '''A'''cid '''S'''chiff) reakce je založena na oxidaci volných hydroxylových vazeb, např. 1,2-glykolová vazba mezi dvěma sousedními uhlíky v hexosách, pomocí kyseliny jodisté (HIO<sub>4</sub>). Vznikají aldehydové skupiny, které reagují s Schiffovým reagens ( bazický fuchsin + pyrosiřičitan sodný Na<sub>2</sub>S<sub>2</sub>O<sub>5</sub>) za vzniku nové komplexní sloučeniny, která má purpurovou barvu. | ||
Struktury které lze touto metodou detekovat, označujeme jako PAS pozitivní (př. [[glykogen]] v [[játra|játrech]]). | Struktury které lze touto metodou detekovat, označujeme jako PAS pozitivní (př. [[glykogen]] v [[játra|játrech]]). | ||
;Metodika barvení | ;Metodika barvení | ||
Složení Schiffova reagens | Složení Schiffova reagens: | ||
# pararosanilin | # bazický fuchsin (=pararosanilin) | ||
# destilovaná voda | # destilovaná voda | ||
# pyrosiřičitan sodný | # pyrosiřičitan sodný | ||
# koncentrovaná kyselina chlorovodíková | # koncentrovaná kyselina chlorovodíková | ||
# | # pyrosiřičitan sodný | ||
Tkáňový řez se oxiduje v 1% kyselině jodisté po dobu 10 minut. Poté je vyjmut opláchnut ve vodě a následuje barvení Schiffovým reagens po dobu 10 minut. Nakonec se řez opláchne v destilované vodě a dobarví hematoxylinem (10 minut). | Tkáňový řez se oxiduje v 1% kyselině jodisté po dobu 10 minut. Poté je vyjmut, opláchnut ve vodě a následuje barvení Schiffovým reagens po dobu 10 minut. Nakonec se řez opláchne v destilované vodě a dobarví hematoxylinem (10 minut). | ||
'''Bestův karmín''' se používá jako metoda průkazu glykogenu v místě s příliš vysokou koncentrací, kde PAS metoda není přehledná. | '''Bestův karmín''' se používá jako metoda průkazu glykogenu v místě s příliš vysokou koncentrací, kde PAS metoda není přehledná. | ||
=== Feulgenova reakce === | === Feulgenova reakce === | ||
Jedná se o reakci, která prokazuje přítomnost [[DNA (nukleová kyselina)|DNA]]. Spočívá v hydrolýze DNA pomocí kyseliny chlorovodíkové, přičemž se odštěpí purinové báze od sacharidů a odhalí se tak aldehydové skupiny na deoxyribóze. Poté, podobně jako u průkazu polysacharidů, reagují aldehydové skupiny s Schiffovým činidlem za vzniku nerozpustné | Jedná se o reakci, která prokazuje přítomnost [[DNA (nukleová kyselina)|DNA]]. Spočívá v hydrolýze DNA pomocí kyseliny chlorovodíkové, přičemž se odštěpí purinové báze od sacharidů a odhalí se tak aldehydové skupiny na deoxyribóze. Poté, podobně jako u průkazu polysacharidů, reagují aldehydové skupiny s Schiffovým činidlem za vzniku nerozpustné purpurové sraženiny. | ||
Metoda se používá například v patologii v nádorové diagnostice | Metoda se používá například v patologii v nádorové diagnostice k určení polyploidie buněk. | ||
=== Průkaz lipidů === | === Průkaz lipidů === | ||
[[Lipidy]] se prokazují na zmražených řezech | [[Lipidy]] se prokazují na zmražených řezech díky tomu, že barvivo má větší afinitu k tukům ve tkáni, než k látce ve které je rozpuštěno. Barviva se tedy rozpouštějí v organických rozpouštědlech (isopropanolol, propylen glykol atd), která ale musí být dostatečně naředěna. K barvivům, která jsou užívána ke znázornění tuků, patří Sudan III a IV (červené) a Sudanová čerň (černé), dále olejová červeň nebo nilská modř (rozlišení kyselých a neutrálních lipidů). Tuky se z tkání nesmí během zpracování vyplavit. Jako fixační prostředek používáme Bakerovu tekutinu (voda, formol,chlorid vápenatý) – redukuje solubilitu nepolárních lipidů. | ||
'''Průkaz fosfolipidů''' – barvíme luxolovou modří. Metoda vhodná pro znázornění '''myelinové pochvy''' nervových vláken | '''Průkaz fosfolipidů''' – barvíme luxolovou modří. Metoda vhodná pro znázornění '''myelinové pochvy''' nervových vláken | ||
== Katalytická histochemie == | == Katalytická histochemie == | ||
Tato metoda je poměrně náročná, přičemž využívá základního principu, že [[enzym]] reaguje se substrátem, který | Tato metoda je poměrně náročná, přičemž využívá základního principu, že [[enzym]] reaguje se substrátem, který je přeměn na konečný produkt histochemická reakce. Teprve tento produkt je poté přeměněn na barevnou sloučeninu (vizualizační reakce). Tento princip se využívá v mnoha aplikacích, tj. od markerů protilátek nebo hybridizačních sond (viz níže), přes detekce metabolických procesů v buňce, po [[Portál:Patologie|patologie]] a [[Portál:Soudní lékařství|soudního lékařství]]. Při všech těchto postupech se musí zachovat 4 základní pravidla pro uskutečnění katalytické histochemie: | ||
* '''Přesnost''' – při zachování morfologie sledovaných buněk či tkání nesmí produkt difundovat a | * '''Přesnost''' – při zachování morfologie sledovaných buněk či tkání nesmí produkt difundovat a musí zůstat v místech s předpokládaným výskytem enzymu. | ||
* '''Specifita''' – konečný produkt je výsledkem reakce pouze jednoho očekávaného enzymu. Toto se ověřuje na kontrolních řezech | * '''Specifita''' – konečný produkt je výsledkem reakce pouze jednoho očekávaného enzymu. Toto se ověřuje na kontrolních řezech. | ||
* '''Reprodukovatelnost''' – pokus se může zopakovat bez významných odchylek. | * '''Reprodukovatelnost''' – pokus se může zopakovat bez významných odchylek. | ||
* '''Validita''' – při manipulaci s tkání nesmí být enzym ztracen, jeho distribuce a aktivita je zachovaná. | * '''Validita''' – při manipulaci s tkání nesmí být enzym ztracen, jeho distribuce a aktivita je zachovaná. | ||
Pro zachování | Pro zachování funkce enzymu nelze tkáň obvykle fixova | ||
== Afinitní histochemie == | == Afinitní histochemie == | ||
Jeden z mladších oborů, který je stále více využíván jak ve výzkumu, tak v diagnostice. Umožňuje prokázat v cílové tkáni velmi nepatrná množství látek. | Jeden z mladších oborů, který je stále více využíván jak ve výzkumu, tak v diagnostice. Umožňuje prokázat v cílové tkáni velmi nepatrná množství látek. | ||
=== Imunohistochemie === | === Imunohistochemie === | ||
Využívá se základního principu interakce [[antigen]]–[[protilátka]], kdy se protilátky specificky vážou na cílový antigen, proti kterému byly „vypěstovány“. Monoklonální protilátky jsou produkovány [[hybridom]]y. Polyklonální protilátky vznikají po imunizaci v organismu člověka nebo zvířete. V Imunohistochemii se využívají oba druhy protilátek. Přitom bývají nějakým způsoben značené, a tím dochází k vizualizaci místa interakce a průkazu antigenů. | |||
[[Soubor:Immunohistochemicalstaining1.PNG|náhled|přímá imunohistochemie]] | [[Soubor:Immunohistochemicalstaining1.PNG|náhled|přímá imunohistochemie]] | ||
Využívá se | Využívá se buď přímého značení protilátky nebo se neznačená protilátka vizualizuje pomocí jiné značené protilátky: | ||
* '''Přímá reakce''' – v tomto případě nasedají primární protilátky, které jsou značené, na antigen. Označí tak místo interakce, avšak nevýhodou je nízká citlivost a nutnost použít zvýšené množství protilátek. | * '''Přímá reakce''' – v tomto případě nasedají primární protilátky, které jsou značené, na antigen. Označí tak místo interakce, avšak nevýhodou je nízká citlivost a nutnost použít zvýšené množství protilátek. | ||
* '''Nepřímá reakce''' – zamezuje nevýhodám přímé reakce | * '''Nepřímá reakce, ABC reakce, PAP reakce atd.''' – zamezuje nevýhodám přímé reakce a zvyšuje senzitivitu reakce. Primární protilátka přisedá na svůj antigen a sekundární protilátky se vážou na primární protilátky. Antigen je tak označen mnohem vyšším počtem molekul markerů, čímž se zvyšuje citlivost reakce. | ||
Mezi markery (značky), které se používají k vizualizaci reakce, patří: | Mezi markery (značky), které se používají k vizualizaci reakce, patří: | ||
* fluorochromy – pro zviditelnění reakce ve fluorescenčním mikroskopu | * fluorochromy – pro zviditelnění reakce ve fluorescenčním mikroskopu | ||
* avidin–biotinový komplex – často užívaný | * avidin–biotinový komplex – komplex často užívaný k amplifikaci signálu (ABC metoda) | ||
* autoradiografie – protilátky nesou radioaktivní látky, které vysílají záření na fotografickou emulzi | * autoradiografie – protilátky nesou radioaktivní látky, které vysílají záření na fotografickou emulzi | ||
* enzymy – využívá se katalytické histochemie; protilátka nesoucí enzym přisedá na antigen a po dodání substrátu jej enzym přemění na barevný produkt | * enzymy – využívá se katalytické histochemie; protilátka nesoucí enzym přisedá na antigen a po dodání substrátu jej enzym přemění na barevný produkt např. PAP(peroxidása- antiperoxidása) reakce | ||
Použití imunohistochemie umožňuje například zviditelnění filament, [[Hormony|hormonů]], [[Receptory|receptorů]] apod. | Použití imunohistochemie umožňuje například zviditelnění filament cytoskeletu, [[Hormony|hormonů]], [[Receptory|receptorů]] apod. | ||
=== Lektinová histochemie === | === Lektinová histochemie === | ||
Lektiny jsou | Lektiny jsou proteiny (nebo glykoproteiny), kterých se využívá například k určování [[Krevní skupiny|krevních skupin]], mitogenních stimulací lymfocytů či normálních buněk. Váží se vysoce specificky na sacharidové části makromolekul. | ||
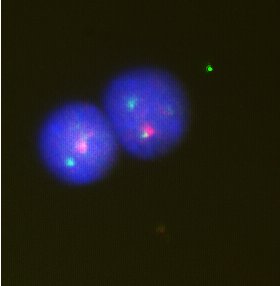
[[Soubor:Fish ph pos 061222.jpg|thumb|FISH metoda]] | [[Soubor:Fish ph pos 061222.jpg|thumb|FISH metoda]] | ||
=== In situ hybridizace === | === In situ hybridizace === | ||
Pokud je známa určitá sekvence nukleotidů v [[DNA]] či [[mRNA]], je možné připravit označený kus sekvence (tzv. sondu/probu) komplementární k originální sekvenci nukleotidů. Na základě párování bazí pak přisedá označená proba na komplementární | Pokud je známa určitá sekvence nukleotidů v [[DNA]] či [[mRNA]], je možné připravit označený kus sekvence (tzv. sondu/probu) komplementární k originální sekvenci nukleotidů. Na základě párování bazí pak přisedá označená proba na komplementární úsek DNA/mRNA a zviditelňuje jí. Užívá se pro i pro identifikaci [[chromosom]]ů v interfázi, velmi často jako FISH (fluorescenční in situ hybridizace). | ||
{{Podrobnosti|Hybridizace in situ|Vyšetření chromozomů}} | {{Podrobnosti|Hybridizace in situ|Vyšetření chromozomů}} | ||
Verze z 26. 8. 2015, 12:29
- Jedná se o histologickou metodu, při které prokazujeme ve vzorku pomocí chemické reakce přítomnost látek (např. enzymatická aktivita).
- Zabývá se morfologií buněk, ale navíc popisuje chemické látky v buňkách a prokazuje buněčné inkluze.
- Prokazujeme přítomnost např. polysacharidů, lipidů, enzymů.
Rozdělení a příklady
- Konvenční histochemie
- Průkazy anorganických iontů a sloučenin
- Perlsova reakce
- PAS reakce
- Feulgenova reakce
- Průkaz lipidů
- Katalytická histochemie
- Afinitní histochemie
- Imunohistochemie
- Lektinová histochemie
- In situ hybridizace
Konvenční histochemie
Průkazy anorganických iontů a sloučenin
Diagnosticky významné je prokazování určitých látek v těle ať už v případě soudního lékařství (zde např. kvůli otravám – As, Pb, Hg, Ag) nebo v patologii kvůli odchylkám od norem výskytu látek (Ca, Fe, Zn, Al).
- Ca se v těle vyskytuje v rozpustné, nerozpustné, ionizované i neionizované formě. Prokazuje se např. ionizovaný díky barvení HE modře v alkalické reakci (pH > 9).
- Fe3+ se prokazuje pomocí Perlsovy reakce (viz níže).
- Zn jako součást inzulinu, či jako kofaktor mnohých enzymů se prokazuje pomocí zinconu s modrým výsledkem, dithizonem s červeným výsledkem
Perlsova reakce
Perlsova reakce slouží k odlišení lipofuscinu, hematoidinu a hematinu, které jsou Perls negativní. Tato reakce se používá k průkazu hemosiderinu. Hemosiderin je zásobní forma železa, která je uložena ve formě depositů v buňkách zvaných siderofágy. Siderofágy (= makrofágy) jsou fagocytující buňky, které pohlcují počkozené nebo staré erytrocyty. A právě reakcí mezi železnatými ionty obsaženými v hemosiderinu a žlutou krevní solí v erytrocytech vzniká modrá sraženina tzv. Berlínská (pruská) modř.
- Metodika barvení
Složení barvícího roztoku
- ferrokyanid draselný
- destilovaná voda
- kyselina chlorovodíková (2%)
Řezy se umístí na 30 minut do barvícího roztoku při teplotě 60 °C. Poté jsou řezy vyjmuty z barvícího roztoku a dobarveny jádrovou červení nebo hematoxylinem.
PAS reakce
PAS (Periodic Acid Schiff) reakce je založena na oxidaci volných hydroxylových vazeb, např. 1,2-glykolová vazba mezi dvěma sousedními uhlíky v hexosách, pomocí kyseliny jodisté (HIO4). Vznikají aldehydové skupiny, které reagují s Schiffovým reagens ( bazický fuchsin + pyrosiřičitan sodný Na2S2O5) za vzniku nové komplexní sloučeniny, která má purpurovou barvu.
Struktury které lze touto metodou detekovat, označujeme jako PAS pozitivní (př. glykogen v játrech).
- Metodika barvení
Složení Schiffova reagens:
- bazický fuchsin (=pararosanilin)
- destilovaná voda
- pyrosiřičitan sodný
- koncentrovaná kyselina chlorovodíková
- pyrosiřičitan sodný
Tkáňový řez se oxiduje v 1% kyselině jodisté po dobu 10 minut. Poté je vyjmut, opláchnut ve vodě a následuje barvení Schiffovým reagens po dobu 10 minut. Nakonec se řez opláchne v destilované vodě a dobarví hematoxylinem (10 minut).
Bestův karmín se používá jako metoda průkazu glykogenu v místě s příliš vysokou koncentrací, kde PAS metoda není přehledná.
Feulgenova reakce
Jedná se o reakci, která prokazuje přítomnost DNA. Spočívá v hydrolýze DNA pomocí kyseliny chlorovodíkové, přičemž se odštěpí purinové báze od sacharidů a odhalí se tak aldehydové skupiny na deoxyribóze. Poté, podobně jako u průkazu polysacharidů, reagují aldehydové skupiny s Schiffovým činidlem za vzniku nerozpustné purpurové sraženiny.
Metoda se používá například v patologii v nádorové diagnostice k určení polyploidie buněk.
Průkaz lipidů
Lipidy se prokazují na zmražených řezech díky tomu, že barvivo má větší afinitu k tukům ve tkáni, než k látce ve které je rozpuštěno. Barviva se tedy rozpouštějí v organických rozpouštědlech (isopropanolol, propylen glykol atd), která ale musí být dostatečně naředěna. K barvivům, která jsou užívána ke znázornění tuků, patří Sudan III a IV (červené) a Sudanová čerň (černé), dále olejová červeň nebo nilská modř (rozlišení kyselých a neutrálních lipidů). Tuky se z tkání nesmí během zpracování vyplavit. Jako fixační prostředek používáme Bakerovu tekutinu (voda, formol,chlorid vápenatý) – redukuje solubilitu nepolárních lipidů.
Průkaz fosfolipidů – barvíme luxolovou modří. Metoda vhodná pro znázornění myelinové pochvy nervových vláken
Katalytická histochemie
Tato metoda je poměrně náročná, přičemž využívá základního principu, že enzym reaguje se substrátem, který je přeměn na konečný produkt histochemická reakce. Teprve tento produkt je poté přeměněn na barevnou sloučeninu (vizualizační reakce). Tento princip se využívá v mnoha aplikacích, tj. od markerů protilátek nebo hybridizačních sond (viz níže), přes detekce metabolických procesů v buňce, po patologie a soudního lékařství. Při všech těchto postupech se musí zachovat 4 základní pravidla pro uskutečnění katalytické histochemie:
- Přesnost – při zachování morfologie sledovaných buněk či tkání nesmí produkt difundovat a musí zůstat v místech s předpokládaným výskytem enzymu.
- Specifita – konečný produkt je výsledkem reakce pouze jednoho očekávaného enzymu. Toto se ověřuje na kontrolních řezech.
- Reprodukovatelnost – pokus se může zopakovat bez významných odchylek.
- Validita – při manipulaci s tkání nesmí být enzym ztracen, jeho distribuce a aktivita je zachovaná.
Pro zachování funkce enzymu nelze tkáň obvykle fixova
Afinitní histochemie
Jeden z mladších oborů, který je stále více využíván jak ve výzkumu, tak v diagnostice. Umožňuje prokázat v cílové tkáni velmi nepatrná množství látek.
Imunohistochemie
Využívá se základního principu interakce antigen–protilátka, kdy se protilátky specificky vážou na cílový antigen, proti kterému byly „vypěstovány“. Monoklonální protilátky jsou produkovány hybridomy. Polyklonální protilátky vznikají po imunizaci v organismu člověka nebo zvířete. V Imunohistochemii se využívají oba druhy protilátek. Přitom bývají nějakým způsoben značené, a tím dochází k vizualizaci místa interakce a průkazu antigenů.
Využívá se buď přímého značení protilátky nebo se neznačená protilátka vizualizuje pomocí jiné značené protilátky:
- Přímá reakce – v tomto případě nasedají primární protilátky, které jsou značené, na antigen. Označí tak místo interakce, avšak nevýhodou je nízká citlivost a nutnost použít zvýšené množství protilátek.
- Nepřímá reakce, ABC reakce, PAP reakce atd. – zamezuje nevýhodám přímé reakce a zvyšuje senzitivitu reakce. Primární protilátka přisedá na svůj antigen a sekundární protilátky se vážou na primární protilátky. Antigen je tak označen mnohem vyšším počtem molekul markerů, čímž se zvyšuje citlivost reakce.
Mezi markery (značky), které se používají k vizualizaci reakce, patří:
- fluorochromy – pro zviditelnění reakce ve fluorescenčním mikroskopu
- avidin–biotinový komplex – komplex často užívaný k amplifikaci signálu (ABC metoda)
- autoradiografie – protilátky nesou radioaktivní látky, které vysílají záření na fotografickou emulzi
- enzymy – využívá se katalytické histochemie; protilátka nesoucí enzym přisedá na antigen a po dodání substrátu jej enzym přemění na barevný produkt např. PAP(peroxidása- antiperoxidása) reakce
Použití imunohistochemie umožňuje například zviditelnění filament cytoskeletu, hormonů, receptorů apod.
Lektinová histochemie
Lektiny jsou proteiny (nebo glykoproteiny), kterých se využívá například k určování krevních skupin, mitogenních stimulací lymfocytů či normálních buněk. Váží se vysoce specificky na sacharidové části makromolekul.
In situ hybridizace
Pokud je známa určitá sekvence nukleotidů v DNA či mRNA, je možné připravit označený kus sekvence (tzv. sondu/probu) komplementární k originální sekvenci nukleotidů. Na základě párování bazí pak přisedá označená proba na komplementární úsek DNA/mRNA a zviditelňuje jí. Užívá se pro i pro identifikaci chromosomů v interfázi, velmi často jako FISH (fluorescenční in situ hybridizace).
Odkazy
Související články
- Principy konvenční histochemie ve světelné mikroskopii
- Barvení ve světelné mikroskopii
- Barvení hematoxylin-eosin
Použitá literatura
- MAŇÁKOVÁ, Eva a Alexandra SEICHERTOVÁ. Metody v histologii. 1. vydání. Praha : Karolinum, 2002. 54 s. ISBN 80-246-0230-X.
- JUNQUIERA, L. Carlos, José CARNEIRO a Robert O KELLEY, et al. Základy histologie. 1. vydání. Jinočany : H & H, 1997. 502 s. s. 14-25. ISBN 80-85787-37-7.