Histochemie: Porovnání verzí
m (úprava) |
m (→Průkaz lipidů: typo) |
||
| Řádek 57: | Řádek 57: | ||
===Průkaz lipidů=== | ===Průkaz lipidů=== | ||
[[Lipidy]] se prokazují na zmražených řezech ponořených do alkoholů s roztokem barviva. Tím bývá často Sudan III a IV (červené) a Sudanová čerň (černé), dále olejová červeň nebo nilská modř (rozlišení kyselých a neutrálních lipidů). Vždy se musí tuky zachovat ve tkáni. | [[Lipidy]] se prokazují na zmražených řezech ponořených do alkoholů s roztokem barviva. Tím bývá často Sudan III a IV (červené) a Sudanová čerň (černé), dále olejová červeň nebo nilská modř (rozlišení kyselých a neutrálních lipidů). Vždy se musí tuky zachovat ve tkáni. Jako fixační prostředek používáme Bakerovu tekutinu (voda ,formol ,chlorid vápenatý) – redukuje solubilitu nepolárních lipidů. Tkáň nesmí přijít do styku s organickými rozpouštědly (benzen, xylen) | ||
'''Průkaz fosfolipidů''' | '''Průkaz fosfolipidů''' – barvíme luxolovou modří. Metoda vhodná pro znázornění '''myelinové pochvy''' nervových vláken | ||
==Katalytická histochemie== | ==Katalytická histochemie== | ||
Verze z 13. 1. 2014, 16:56
- Jedná se o histologickou metodu, při které prokazujeme ve vzorku pomocí chemické reakce přítomnost látek (např. enzymatická aktivita).
- Zabývá se morfologií buněk, ale navíc popisuje chem. látky v buňkách a prokazuje buněčné inkluze.
- Prokazujeme přítomnost: polysacharidů, lipidů, enzymů.
Rozdělení
- Histochemie
- Průkazy anorganických iontů a sloučenin
- Perlsova reakce
- PAS reakce
- Feulgenova reakce
- Průkaz lipidů
- Katalytická histochemie
- Afinitní histochemie
- Imunohistochemie
- Lektinová histochemie
- In situ hybridizace
Histochemie
Průkazy anorganických iontů a sloučenin
Diagnosticky významné je prokazování určitých látek v těle ať už v případě soudního lékařství (zde např. kvůli otravám – As, Pb, Hg, Ag) nebo v patologii kvůli odchylkám od norem výskytu látek (Ca, Fe, Zn, Al).
- Ca přebývá v těle v rozpustné, nerozpustné, ionizované i neionizované formě. Prokazuje se např. ionizovaný díky barvení HE modře v alkalické reakci (pH > 9).
- Fe3+ se prokazuje pomocí Perlsovy reakce (viz níže), Fe2+ s modrým zbarvením pomocí Turnbullblue
- Zn jako součást inzulinu, či jako kofaktor mnohých enzymů se prokazuje pomocí zinconu s modrým výsledkem, dithizonem s červeným výsledkem
Perlsova reakce
Perlsova reakce slouží k odlišení lipofuscinu, hematoidinu a hematinu, které jsou Perls negativní. Tato reakce se používá k průkazu hemosiderinu. Hemosiderin je zásobní forma železa, která je uložena ve formě depositů v buňkách zvaných siderofágy. Siderofágy (= makrofágy) jsou fagocytující buňky, které pohlcují počkozené nebo staré erytrocyty. A právě reakcí mezi železnatými a železitými ionty obsaženými v hemosiderinu a žlutou krevní solí v erytrocytech vzniká modrá sraženina tzv. Berlínská modř.
- Metodika barvení
Složení barvícího roztoku
- ferokyanid draselný
- destilovaná voda
- kyselina chlorovodíková (2%)
Řezy se umístí na 30 minut do barvícího roztoku při teplotě 60°C. Poté jsou řezy vyjmuty z barvícího roztoku a dobarveny jádrovou červení nebo hematoxylinem.
PAS reakce
PAS (Periodic Acid Schiff) reakce je založena na oxidační reakci kyseliny jodisté (HIO4) na 1,2-glykolové skupiny, které jsou přítomné na glukózových zbytcích. Vznikají aldehydové skupiny, které reagují s činidlem (Schiffovým reagens) za vzniku nové komplexní sloučeniny, která má purpurovou až kaštanovou barvu.
Struktury které lze touto metodou detekovat, označujeme jako PAS pozitivní (př. glykogen v játrech)
- Metodika barvení
Složení Schiffova reagens
- pararosanilin
- absolutní alkohol
- destilovaná voda
- pyrosiřičitan sodný
- koncentrovaná kyselina chlorovodíková
- dithioničitan sodný
Tkáňový řez se oxiduje v 1% kyselině jodisté po dobu 10 minut. Poté je vyjmut opláchnut ve vodě a následuje barvení Schiffovým reagens po dobu 10-ti minut. Nakonec se řez opláchne v destilované vodě a dobarví hematoxylinem (10 minut).
Bestův karmín se používá jako metoda průkazu glykogenu v místě s příliš vysokou koncentrací, kde PAS metoda není přehledná.
Feulgenova reakce
Jedná se o reakci, která prokazuje přítomnost DNA. Spočívá v hydrolýze DNA pomocí kyseliny chlorovodíkové, kde se v tomto procesu odštěpí purinové báze od monosacharidu a odhalí se tak aldehydové skupiny na deoxyribóze. Poté, podobně jako u průkazu polysacharidů, reagují aldehydové skupiny s Schiffovým reagens za vzniku nerozpustné červené sraženiny.
Metoda se používá například v patologii v nádorové diagnostice, kde se určuje polyploidie buněk.
Průkaz lipidů
Lipidy se prokazují na zmražených řezech ponořených do alkoholů s roztokem barviva. Tím bývá často Sudan III a IV (červené) a Sudanová čerň (černé), dále olejová červeň nebo nilská modř (rozlišení kyselých a neutrálních lipidů). Vždy se musí tuky zachovat ve tkáni. Jako fixační prostředek používáme Bakerovu tekutinu (voda ,formol ,chlorid vápenatý) – redukuje solubilitu nepolárních lipidů. Tkáň nesmí přijít do styku s organickými rozpouštědly (benzen, xylen)
Průkaz fosfolipidů – barvíme luxolovou modří. Metoda vhodná pro znázornění myelinové pochvy nervových vláken
Katalytická histochemie
Tato metoda je poměrně náročná, přičemž využívá základního principu, že enzym reaguje se substrátem, který přemění na konečný produkt (histochemická reakce). Teprve tento produkt je posléze přeměněn na barevnou sloučeninu (vizualizační reakce). Využívá se toho v mnoha odvětvích, tj. od markerů protilátek nebo hybridizačních sond (viz níže), přes detekce metabolických procesů v buňce, do patologie a soudního lékařství. Při všech těchto postupech se musí zachovat 4 základní pravidla pro uskutečnění katalytické histochemie:
- Přesnost – při zachování morfologie sledovaných buněk či tkání nesmí produkt difundovat a je vázán na strukturách s předpokládaným výskytem enzymu.
- Specifita – konečný produkt je výsledkem reakce pouze jednoho očekávaného enzymu. Toto se ověřuje na kontrolních řezech bez substrátu, kdy se nesmí objevit barevný produkt.
- Reprodukovatelnost – pokus se může zopakovat bez významných odchylek.
- Validita – při manipulaci s tkání nesmí být enzym ztracen, jeho distribuce a aktivita je zachovaná.
Pro zachování funkcí enzymu nesmí být preparát fixován formaldehydem!
Afinitní histochemie
Jeden z mladších oborů, který je stále více využíván jak ve výzkumu, tak v diagnostice. Umožňuje prokázat v cílové tkáni velmi nepatrná množství látek.
Imunohistochemie
Toto odvětví využívá základního principu interakce antigen–protilátka, kdy monoklonální protilátky přisedají afinitně na cílový antigen, proti kterému byly „vypěstovány“. Monoklonální protilátky jsou produkovány hybridomy. Přitom bývají nějakým způsoben značené a tím dochází k vizualizaci místa interakce a průkazu antigenů.
Využívá se dvou základních metod:
- Přímá reakce – v tomto případě nasedají primární protilátky, které jsou značené, na antigen. Označí tak místo interakce, avšak nevýhodou je nízká citlivost a nutnost použít zvýšené množství protilátek.
- Nepřímá reakce – zamezuje nevýhodám přímé reakce, když primární protilátka přisedá na svůj antigen a s použitím sekundární protilátky tyto nasedají na protilátky primární. Sekundární protilátky jsou značené a může jich na primární přisednout mnohem více – tím se zvyšuje citlivost detekovatelné reakce.
Mezi markery (značky), které se používají k vizualizaci reakce, patří:
- fluorochromy – pro zviditelnění reakce ve fluorescenčním mikroskopu
- avidin–biotinový komplex – často užívaný komplex k amplifikaci signálu nepřímé metody
- autoradiografie – protilátky nesou radioaktivní látky, které vysílají záření na fotografickou emulzi
- enzymy – využívá se katalytické histochemie; protilátka nesoucí enzym přisedá na antigen a po dodání substrátu jej enzym přemění na barevný produkt
Použití imunohistochemie umožňuje například zviditelnění filament, hormonů, receptorů apod.
Lektinová histochemie
Lektiny jsou především rostliné proteiny (glykoproteiny), kterých se využívá například k určování krevních skupin, mitogenních stimulací lymfocytů či normálních buněk. Váží se vysoce specificky na sacharidové části makromolekul.
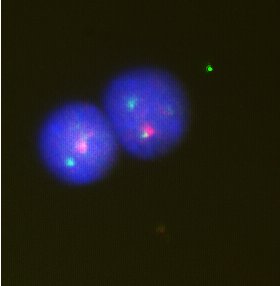
In situ hybridizace
Pokud je známa určitá sekvence nukleotidů v DNA či mRNA, je možné připravit označený kus sekvence (tzv. sondu/probu) komplementární k originální sekvenci nukleotidů. Na základě párování bazí pak přisedá označená proba na komplementární část DNA/mRNA a zviditelňuje jí. Užívá se zejména pro identifikaci chromosomů v interfázi, velmi často jako FISH (fluorescenční in situ hybridizace).
Odkazy
Související články
- Principy konvenční histochemie ve světelné mikroskopii
- Barvení ve světelné mikroskopii
- Barvení hematoxylin-eosin
Použitá literatura
- MAŇÁKOVÁ, Eva a Alexandra SEICHERTOVÁ. Metody v histologii. 1. vydání. Praha : Karolinum, 2002. 54 s. ISBN 80-246-0230-X.
- JUNQUIERA, L. Carlos, José CARNEIRO a Robert O KELLEY, et al. Základy histologie. 1. vydání. Jinočany : H & H, 1997. 502 s. s. 14-25. ISBN 80-85787-37-7.