Hybridizace (chemie)
Hybridizace orbitalů je jev energetického sjednocení energeticky různých orbitalů daného atomu. Hybridizace probíhá u těch orbitalů atomu, které poskytují své elektrony k vytvoření kovalentních vazeb. Koncept hybridizace orbitalů je velmi užitečný pro vysvětlení tvaru molekul. Pro každý druh hybridizace existuje charakteristické rozmístění hybridních orbitalů v prostoru, což určuje i prostorové uspořádání chemických vazeb.
| Druh hybridizace | Geometrie molekuly |
|---|---|
| sp | lineární |
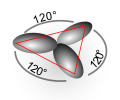
| sp2 | rovnostranný trojúhelník |
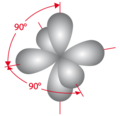
| sp3 | tetraedr |
| d2sp3 | oktaedr |
| dsp2 | čtverec |
| dsp3 | trigonální bipyramida nebo čtvercová pyramida |
- Prostorové uspořádání hybridizovaných orbitalů
Hybridizací vzniká ze souboru atomových orbitalů s rozdílnou energií soubor orbitalů se stejnou energií. Tím se dosahuje rovnocennosti vazeb mezi centrálním iontem kovu a ligandy. Geometrická struktura komplexu zobrazená koordinačním mnohostěnem, k jelikož vrcholům směřují vazby, odpovídá minimální energii systému.
Počet ligandů vázaných k centrálnímu atomu (iontu) je roven koordinačnímu číslu, které je shodné s počtem orbitalů účastnících se hybridizace. Při vytváření a zaplňování hybridních orbitalů směřuje centrální částice pokud možno k dosažení konfigurace vnější vrstvy atomů nejbližšího následujícího vzácného plynu v PSP (periodická soustava prvků).
O tom, že to vždy nemusí nastat, svědčí rámečkové diagramy komplexů [Fe(H2O)6]3+, [Ni(CN)4]2- a [Ag(NH3)2]+.
V následující tabulce najdeme běžné typy hybridizace, počet a uspořádání ligandů (koordinační mnohostěn) a také několik příkladů příslušných komplexů.
Dobrou představu o hybridizaci orbitalů můžete získat z následujícího videa:
<mediaplayer>https://www.youtube.com/watch?v=g1fGXDRxS6k</mediaplayer>