Elektrochemie
Elektrodové děje
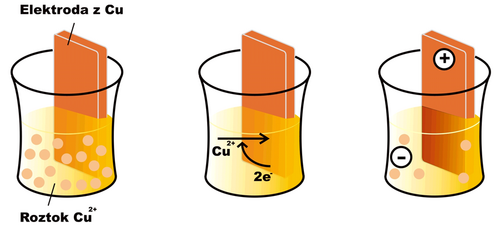
Ponoříme-li do roztoku kovového iontu (např. Cu2+) elektrodu ze stejného kovu (v daném případě mědi), začne na povrchu elektrody probíhat oxido-redukční reakce
- Cu2+ + 2 e− Cu
V případě mědi je za běžných podmínek rovnováha uvedené reakce posunuta poněkud doprava (u jiných látek, např. zinku, tomu může být opačně). Na povrchu elektrody se ukládá vrstvička vyredukované mědi a elektroda posupně získává kladný náboj, protože se z ní odčerpávají volné elektrony. Roztok, do nějž je elektroda ponořena, naopak získává záporný náboj, neboť z něj bez náhrady ubývají kationty Cu2+. Po určité době se reakce zastaví, neboť elektrostatické síly dalšímu přesunu nabitých částic brání, a ustaví se rovnováha charakterizovaná jistým elektrickým potenciálem na elektrodě. Snahu elektrody přijímat nebo odevzdávat elektrony charakterizuje tzv. redukční potenciál (Ered). Pokud mají všechny složky elektrodové reakce aktivitu rovnou jedné, nebo se nacházejí v podobě, na niž je standardní stav vztažen (např. pevné skupenství), mluvíme o standardním redukčním potenciálu (E0red).
Potenciál vzniklý výše popsaným způsobem na jedné elektrodě nedokážeme změřit přímo. Můžeme však vytvořit článek složený ze dvou různých elektrod – např. kovů (obecně poločlánků) a dvou odpovídajících elektrolytů. Příkladem může být tzv. Daniellův článek: Cu v roztoku Cu2+ a Zn v roztoku Zn2+. Podle toho, jestli mají jednotlivé kovy tendenci být spíš v oxidované nebo redukované podobě, je můžeme uspořádat do tzv. Beketovovy elektrochemické řady (K, Ca, Al, Zn, Fe, Ni, Pb, H, Bi, Cu, Hg, Ag, Au). Pro tyto účely se za nulu považuje elektrodový potenciál tzv. standardní vodíkové elektrody. Kovy, které mají záporný standardní redukční potenciál a tedy snadno odevzdávají elektron, jsou v řadě nalevo od vodíku (tj. draslík má snahu se oxidovat na K+). Ionty kovů, které jsou vpravo, naopak elektrony snadno přijímají (např. Ag+ se snadno redukuje na Ag) a jejich standardní redukční potenciál je kladný.
Výše zmíněný Daniellův článek se schematicky zapisuje Zn | Zn2+ || Cu2+ | Cu (negativnější kov se zapisuje vlevo). Na zinkové elektrodě probíhá redoxní reakce
- Zn2+ + 2 e− Zn,
která má rovnovážnou konstantu KZn a je charakterizovaná standardním redukčním potenciálem E0red(Zn); na měděné elektrodě probíhá výše uvedená reakce
- Cu2+ + 2 e− Cu
s rovnovážnou konstantou KCu a standardním redukčním potenciálem E0red(Cu). V daném případě platí, že KCu > KZn, resp. E0red(Cu) > E0red(Zn). Jinými slovy měď se bude redukovat a ukládat na elektrodě ochotněji, než zinek. Z měděné elektrody se tak spotřebuje více elektronů, než ze zinkové. V konečném důsledku bude mít měděná elektroda vůči zinkové kladné napětí, které můžeme změřit.
Necháme-li mezi elektrodami protékat proud, budou se „scházející" elektrony do měděné elektrody dodávat ze zinkové a výsledný děj bude možné zapsat takto:
- Zn → Zn2+ + 2e−
- Cu2+ + 2e− → Cu
Vodičem mezi elektrodami i solným můstkem poteče proud tak dlouho, dokud se nerozpustí zinková elektroda, nebo (což je pravděpodobnější) dokud se nespotřebuje Cu2+ z elektrolytu, popřípadě se druhý elektrolyt nenasytí ionty Zn2+ (vybití elektrochemického článku).
Napětí článku je rovno rozdílu potenciálu obou elektrod. Článek, na němž probíhají děje samovolně, spontánně („produkuje“ napětí) nazýváme článkem galvanickým (ΔG < 0). Pokud na něj napětí vkládáme a děje jsou „vynuceny“ vloženým napětím (ΔG > 0), nazýváme takovýto článek elektrolytickým.
Popsané elektrodové děje jsou poměrně obecné a obdobným způsobem probíhají v nejrůznějších soustavách složených z různých kovů a iontů.
.
pH-metrie
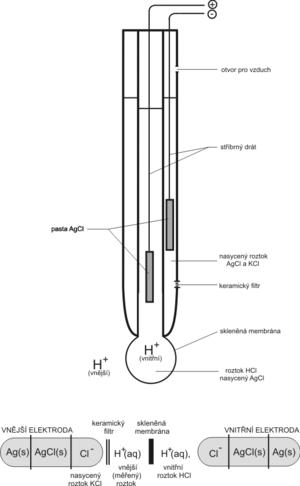
Nejstarší a dosud nejrozšířenější iontově selektivní elektrodou, která se používá k měření pH, je elektroda skleněná. Zpravidla se konstruuje v jednom těle přímo s vhodnou referentní elektrodou. Existuje řada modifikací; zde si ukážeme princip na základním provedení.
Schopnost skleněné elektrody indikovat koncentraci H+ si můžeme zjednodušeně vysvětlit tím, že skleněná membrána (banička s velmi tenkými stěnami vyfouknutá ze speciálního skla) je propustná pro H+ a nepropustná pro jiné ionty. Ve vnitřním elektrolytu je ponořený stříbrný drátek potažený vrstvou AgCl. Podle kyselosti měřeného roztoku se mění koncentrace H+ uvnitř baničky. Ionty Cl− membránou neprocházejí, a tak aby byla zachována elektroneutralita roztoku, dochází k reakci na elektrodě
- AgCl + e− Ag+ + Cl−.
Ponoříme-li elektrodu do kyselého roztoku, způsobí nadbytek H+ iontů, že se z pasty AgCl bude uvolňovat více iontů Cl−. Tím se spotřebuje více elektronů ze stříbrného drátku a elektroda získá vůči referentní kladnější napětí. Naopak v zásaditém prostředí bude nadbytek Cl− odevzdávat své elektrony a na elektrodě bude zápornější napětí.
Jako referentní elektroda se v pH-metrii nejčastěji používá opět stříbrný drát potažený pastou AgCl, tentokrát je však ponořený v roztoku KCl s přesnou koncentrací (tj. v roztoku s konstantní koncentrací Cl−, např. nasycený, 1 mol·l−1, 3 mol·l−1 apod.). Potenciál referentní elektrody není ovlivněn koncentrací H+ iontů. Elektrolyt referentní elektrody bývá s měřeným roztokem vodivě propojen pomocí můstku s keramickou přepážkou (fritou).
Uvedený popis pH-metrické elektrody je značně zjednodušený. Skutečné pochody na skleněné membráně jsou popsány na podstránce podrobnosti o skleněné elektrodě.
Elektrolýza
Ve výkladu elektrodových dějů jsme předpokládali, že soustava je v rovnovážném stavu. Zabývejme se nyní tím, co se stane, pokud na elektrody přivedeme napětí z vnějšího zdroje (elektrolytický článek, ΔG > 0). Probíhající děje se budou řídit Faradayovými zákony. K tomu, aby elektrolytické reakce začaly probíhat, musí napětí na elektrodách přesáhnout určitou hodnotu – rozkladné napětí (odpovídá součtu standardních elektrodových potenciálů pro jednotlivé reakce).
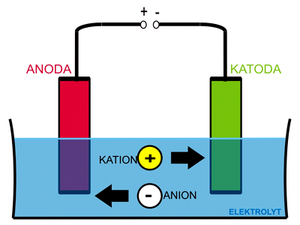
Jako příklad použijeme soustavu složenou z dvou inertních (platinových) elektrod ve vodném roztoku chloridu sodného.
Vložíme-li na elektrody napětí, začnou ionty v roztoku putovat podle svého náboje, kationty Na+ a H+ ke katodě a anionty Cl− a OH− k anodě. Na katodě (a v její těsné blízkosti) budou probíhat reakce:
- 2 H+ + 2 e− → H2 ↑
a (při vyšším napětí):
- Na+ + e− → Na
- 2 Na + 2 H2O → 2 Na+ + 2 OH− + H2 ↑
Na anodě bude probíhat reakce:
- 2 OH− → H2O + ½ O2 ↑ + 2 e−
a (při vyšším napětí):
- 2 Cl− → Cl2 + 2 e−
- Chlór se částečně uvolní jako plyn, částečně bude dále reagovat s vodou za vzniku kyseliny chlorovodíkové a kyseliny chlorné:
- Cl2 + H2O → H+ + Cl− + HClO
Vznikající plyny budou ze systému unikat (v tomto případě jde tedy o nevratný děj). Uvedený příklad známe i z praxe – všimněte si např. bublinek u elektrod při elektroforéze.
Využití
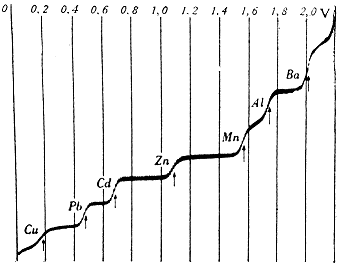
|
| Polarografická křivka, závislost proudu na napětí. Převzato z [1] |
Tohoto jevu se využívá např. i v polarografii. Zjednodušeně řečeno, pokud budeme postupně zvyšovat napětí na elektrodách, bude soustavou zpočátku protékat jen malý proud. Po dosažení rozkladného napětí, charakteristického pro příslušný redoxní pár, začnou probíhat elektrolytické děje na povrchu měrné elektrody a proud se prudce zvýší (vzestupná část polarografické křivky). Jelikož tato reakce je velmi rychlá, dojde záhy k vyčerpání iontů v okolí elektrody. Nové ionty se k povrchu elektrody dostávají difuzí, jejíž rychlost je omezená, takže se intenzita proudu příliš nemění (rovné plato). Sestrojíme-li graf závislosti proudu na vloženém napětí, dostaneme schodovitou polarografickou křivku.
- ↑ CANOV, Michael. Polarografie [online]. [cit. 2018-10-20]. <http://canov.jergym.cz/analchem/polar.htm>.