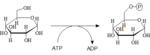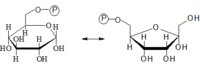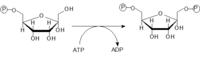Glykolýza
(přesměrováno z Anaerobní glykolysa)
Glykolýza je metabolický proces, který mění glukózu (resp. glukózu-6-fosfát) na dvě molekuly pyruvátu.[1]
Za anaerobních podmínek se pyruvát mění na laktát za katalýzy laktátdehydrogenázy. Pokud má buňka dostatek kyslíku a mitochondrií, pyruvát je přenesen do mitochondriální matrix a podléhá oxidační dekarboxylaci – reakce pyruvátdehydrogenázového komplexu. Regulačními enzymy jsou 6-fosfofrukto-1-kináza, pyruvátkináza (a do jisté míry i hexokináza/glukokináza).
Fosforylace glukózy
Glukózu musíme nejdříve aktivovat a navázat na ni fosfát. Glukóza-6-fosfát, je důležitým východiskem nejen pro glykolýzu, ale i pro pentosový cyklus a syntézu glykogenu. Reakce probíhá za katalýzy hexokinázy (většina buněk těla) nebo glukokinázy (hepatocyty, β-buňky pankreatu).
Hexokináza
Km pro tento enzym je rovna 0,1 mmol/l, to znamená, že reakce bude probíhat s dostatečnou rychlostí i při nízké koncentraci glukózy. Nebo jinými slovy – enzym bude téměř maximálně aktivní při dolní hranici normoglykémie (3,5 mmol/l).
Glukokináza
Km pro tento enzym je rovna 10 mmol/l což znamená, že funguje pouze při zvýšené hladině glukózy. Její umístění má funkční význam – β buňky takto dostávají signál k produkci inzulinu (po jídle glykémie výrazně narůstá, proto začíná glukokináza pracovat). Játra zase po zvýšení glykémie vychytávají glukózu, kterou využívají na syntézu glykogenu do zásoby.
Posloupnost enzymů a reakcí
Glukóza-6-fosfátizomeráza
Tato reakce je vratná, dává vznik molekule fruktóza-6-fosfát. Enzym působí pouze na α-anomer glukózy.
6-Fosfofrukto-1-kináza
Tato reakce je nevratná, aktivitu enzymu můžeme allostericky ovlivnit. Z toho vyplývá, že má podstatnou úlohu v regulaci glykolýzy. Jako kofaktor vystupuje Mg2+. Produktem reakce je fruktóza-1,6-bisfosfát.
Aldoláza
Fruktóza-1,6-bisfosfát podléhá štěpení na dva triozafosfáty, a sice glyceraldehyd-3-fosfát (GAP) a dihydroxyacetonfosfát (DAP). Jelikož další pokračování glykolýzy vyžaduje právě GAP, je nutné přeměnit DAP na GAP. Děje se tak prostřednictvím enzymu triozafosfátizomerázy.
Glyceraldehyd-3-fosfátdehydrogenáza
Tento enzym váže na GAP (za současné oxidace) volný (anorganický) fosfát (Pi). Oxidace je reakce exergonická. Uvolněná energie se uloží do makroergní vazby s fosfátem (zjednodušeně řečeno), produkt reakce je 1,3-bisfosfoglycerát a jedna molekula NADH + H+.
Fosfoglycerátkináza
Makroergní fosfát vznikající v předcházející reakci, je zachycen ve formě ATP (reakce s ADP). Jestliže ATP vzniká mimo dýchací řetězec, hovoříme o tzv. fosforylaci na substrátové úrovni. V reakci kromě ATP vzniká i 3-fosfoglycerát.
Fosfoglycerátmutáza
Fosfát je touto reakcí přesunut z pozice tři do pozice dva. Dostáváme tedy 2-fosfoglycerát (2-PG).
Enoláza
Enoláza způsobuje dehydrataci 2-PG, a tím povznesení fosfátu do vysokoenergetického stavu (resp. jeho odštěpení, ke kterému následně dojde). Vzniká fosfoenolpyruvát. Enoláza může být inhibována fluoridem (klinické využití: pokud chceme zabránit glykolýze v krvi před stanovením glykémie).
Pyruvátkináza
Pyruvátkináza odštěpí fosfát. Tím pádem dostáváme vysoce nestabilní sloučeninu – enol-pyruvát. Proč je zde taková nestabilita? Vodík navázaný na kyslík v rámci hydroxylové skupiny má tendence se přesouvat na uhlík. Tím se dvojná vazba mezi uhlíkem a kyslíkem přesmykne a dochází ke vzniku ketoskupiny (tzv. keto-enol tautomerie). Při přesmyku se uvolní energie, která je zachycena ve formě ATP (ADP reaguje s uvolněným fosfátem). Reakce je nevratná a tedy potenciálně regulační. Výsledkem je pyruvát (nebo keto-pyruvát).
Přeměny pyruvátu
Laktátdehydrogenáza
Laktátdehydrogenáza (LD nebo LDH, EC 1.1.1.27) je oxidoredukční enzym katalyzující reverzibilní přeměnu laktátu na pyruvát. Struktura molekuly je tvořena 4 podjednotkami o relativní molekulové hmotnosti 34 000. Každá z těchto podjednotek může být buď M (muscle) nebo H (heart), takže celkem existuje 5 izoenzymů označovaných LD1 (s podjednotkovým složením H4) až LD5 (M4). LD je přítomna v cytoplazmě buněk mnoha tkání. Do cirkulace se uvolňuje již při mírném tkáňovém poškození.
| isoenzym | podjednotky | výskyt |
|---|---|---|
| LD1 | H4 | myokard + erytrocyty |
| LD2 | H3M | myokard + erytrocyty |
| LD3 | H2M2 | kosterní svaly |
| LD4 | HM3 | játra + kosterní svaly |
| LD5 | M4 | játra + kosterní svaly |
Vyšetření
Zvýšení katalytické koncentrace celkové LD v séru doprovází řadu onemocnění. V současné době se stanovení celkové aktivity LD používá jako nespecifický marker rozpadu buněk, např. při nádorových onemocněních (leukémie, testikulární nádory). Charakteristické je také pozdní zvýšení celkové LD po infarktu myokardu, které může přetrvávat až 15 dní. Vzhledem k vysokému obsahu v erytrocytech může sérovou koncentraci falešně pozitivně zvýšit hemolýza. Použití LD a jejích izoenzymů pro diagnostiku akutního koronárního syndromu se dnes považuje za zastaralé.
Fyziologická horní hranice LD pro dospělé muže a ženy je 4,10 µkat/l.[2]
Pro stanovení se využívá optického testu. Zastoupení izoenzymů lze určit elektroforeticky.
Pyruvátdehydrogenáza
Pyruvát dehydrogenázový komplex je komplex tří enzymů uvnitř mitochondrie: pyruvát dekarboxylázy, dihydrolipoyltransacetylázy a dihydrolipoyldehydrogenázy. Komplex pracuje jako celek v přítomnosti koenzymů TDP, NAD+, lipoátu ve formě lipoamidu, FAD a koenzymu A. Pyruvát dekarboxyláza katalyzuje oxidativní dekarboxylaci pyruvátu s navázáním acetylu na TPP, dihydrolipoyltransacetyláza katalyzuje přenesení acetylu z TPP přes lipoamid na koenzym A a dihydrolipoyldehydrogenáza regeneruje lipoamid pomocí FAD, z něhož vzniká FADH2, které regeneruje zase pomocí NAD+, z něhož vzniká NADH + H+. Enzym je inhibován arsenem v oxidačním stavu AsIII (arsenitan), který blokuje lipoamid.
Energetická bilance
| Aerobní podmínky | --- | Anaerobní podmínky | ||
| aktivace | −2 ATP | --- | aktivace | -2 ATP |
| přímo v glykolýze | 2×2 ATP | --- | přímo v glykolýze | 2×2 ATP |
| redukované koenzymy (člunky) | 3–5 ATP | --- | redukované koenzymy | spotřebované pro LDH |
| PDH komplex | 5 ATP | --- | ||
| oxidace AcCoA | 20 ATP | --- | ||
| celkově | 30–32 ATP | --- | celkově | 2 ATP |
Aerobní podmínky
V případě dostatečného množství kyslíku v buňce spotřebovává dýchací řetězec redukované koenzymy. Citrátový cyklus běží naplno (dodávka redukovaných koenzymů) a potřebuje pro svou činnost acetylkoenzym A. Ten přichází z nevratné PDH reakce, která spotřebovává pyruvát vznikající v glykolýze. Malá poznámka ke člunkům: Redukované koenzymy, které vznikly v glykolýze, nedifundují přes mitochondriální membrány. K jejich transportu se využívají člunky – Malát-aspartátový (v konečném důsledku zisk 5 ATP v dýchacím řetězci) a Glycerol-fosfátový (v konečném důsledku zisk 3 ATP v dýchacím řetězci). Proto je v tabulce v kolonce „redukované koenzymy (člunky)“ uveden údaj 3–5 ATP.
Anaerobní podmínky
Pokud buňka nemá mitochondrie (erytrocyty, dřeň ledviny) nebo dostatek kyslíku (ischemická tkáň, kosterní sval při zátěži), dýchací řetězec funguje omezeně (resp. je zastaven). Současně s ním stagnují děje, které mu předcházejí (citrátový cyklus, PDH). LDH proto přeměňuje hromadící se pyruvát na laktát. Ten se postupně vylučuje do krve.
Při narušení cirkulace (infarkt myokardu, plicní embolie, šok) vysoké plazmatické hladiny laktátu způsobí pokles pH a rozvíjí se metabolická acidóza.
Anaerobní glykolýza probíhá i v buňkách orgánů, které nemají vyvinuté bohaté cévní zásobení např. čočka a rohovka.
Regulace
Odkazy
Související články
Reference
- ↑ ŠVÍGLEROVÁ, Jitka. Glykolýza [online]. Poslední revize 18.2.2009, [cit. 2010-12-25]. <http://wiki.lfp-studium.cz/index.php?title=Glykol%C3%BDza&oldid=359>.
- ↑ Jaroslav Racek et al.: Klinická biochemie, druhé, přepracované vydání, Galén, 2006
Použitá literatura
- DUŠKA, František. Biochemie v souvislostech, 1.díl – základy energetického metabolizmu. 1. vydání. Praha : Karolinum, 2006. ISBN 80-246-1116-3.
- MURRAY, Robert K.. Harperova biochemie. 2. vydání. Jinočany : H&H, 1998. ISBN 80-7319-013-3.