Adenosintrifosfát
Adenosintrifosfát (ATP, systematickým názvem ((2R,3S,4R,5R)-5-(6-amino-9H-purin-9-yl)-3,4-dihydroxytetrahydrofuran-2-yl)methylhydrogentrifosfát) je tzv. makroergní sloučenina, ze které lze uvolnit velké množství energie. Ta je v těle potřebná pro nejrůznější energeticky náročné děje (aktivní transport, svalová kontrakce atd.). Můžeme tak konstatovat, že molekula ATP slouží v těle jako univerzální zdroj energie.
Hydrolýzou ATP vzniká adenosindifosfát (ADP), který stále lze štěpit za účelem zisku energie. Jedná se o výrazně exergonní děj. Štěpením ADP vznikne, již neštěpitelná molekula, adenosinmonofosfát (AMP). Většina ATP vzniká v průběhu dýchacího řetěze, menší množství v průběhu jiných reakcí (tzv. na substrátové úrovni).
Struktura[upravit | editovat zdroj]
ATP je nukleotid, který patří do skupiny adenosinfosfátů. Je tvořen adeninem, ribózou a kyselinou trifosforečnou. Patří do skupiny tzv. 5' ribonukleotidů, což znamená, že se fosfátové skupiny vážou na 5' uhlík. Mezi adeninem a ribózou je N-glykosidická vazba, fosfátové skupiny jsou pospojovány anhydridovými vazbami, a k ribóze připojeny vazbou fosfodiesterovou.
Proces získávání energie[upravit | editovat zdroj]
Molekula ATP zajišťuje skladování a přenos chemické volné energie v buňce. Jeho štěpením (transferázami, hydrolázami a ligázami) vzniká ADP nebo AMP. Pokud je štěpen adenylátcyklázou, dochází ke vzniku cAMP, který je významný pro buněčnou signalizaci. ATP je také inhibitorem katabolických drah, zejména citrátového cyklu a glykolýzy.[2]
Energie se uvolňuje z anhydridových vazeb fosfátů. Nejprve dochází k fosforylaci substrátu, čímž se uvolní ADP. Fosforylovaný produkt je bohatý na energii. V další fázi reaguje s jiným reaktantem, za současného uvolnění fosfátového aniontu. Navázání anorganického monofosfátu H2PO4- (Pi) a difosfátu H2P2O72- (PPi) umožní aktivaci substrátů, které jsou schopny fosforylovat jiné sloučeniny.[3]
Adenosinová část ATP má funkci rozpoznávací. Slouží k vazbě na molekuly enzymů, které využívají ATP jako kofaktor.[1]
Nelze pochopit (syntaktická chyba): {\displaystyle ATP + H{2}O → ADP + P{i}}
Nelze pochopit (syntaktická chyba): {\displaystyle ΔG{0}= -30,5 kJ/mol}
Využití[upravit | editovat zdroj]
ATP se obvykle vyskytuje intracelulárně. Jeho koncentrace se liší dle energetické náročnosti tkáně. Obvykle se pohybuje kolem hodnot 1–10 mmol/l. V malé míře jí můžeme najít i v tkáňovém moku a krvi.
Slouží jako zdroj fosfátových skupin pro fosforylace, v počátečních fázích glykolýzy a jako nukleová báze pro syntézu nukleových kyselin. Zároveň je nezbytná pro spoustu energeticky náročných fyziologických procesů jako je např. aktivní transport, synaptický přenos nebo kontrakce svaloviny.[3]
Význam ATP a ostatních adenosinfosfátů (ADP, AMP) je pro energetické poměry buněk zásadní. Aktuálních intracelulárních koncentrací těchto molekul lze vypočítat tzv. energetický náboj (EN), který vyjadřuje energetický stav celé buňky. Hodnoty se pohybují v rozmezí od 0 do 1.[4]
Nelze pochopit (syntaktická chyba): {\displaystyle EN=\frac{[ATP] + ½[ADP]}{[ATP] + [ADP] + [AMP]}}
Syntéza ATP[upravit | editovat zdroj]
Molekula ATP vzniká z molekuly ADP a Pi. Mezi procesy, při kterých může vzniknout řadíme:
- oxidativní fosforylaci a fotofosforylaci (ADP + Pi → ATP + H2O);
- substrátovou fosforylaci při metabolismu sacharidů (substrát-OPO32- + ADP → substrát + ATP);* a adenylátkinázovou reakci (AMP je převáděn na ADP působením adenylátkinázy, za vzniku dvou molekul ADP, které jsou fosforylací přeměněny na ATP).[3]
Oxidativní fosforylace[upravit | editovat zdroj]
Tento termín se používá pro syntézu ATP na vnitřní membráně mitochondrií v průběhu dýchacího řetězce. Dochází k přenosu elektronů z Krebsova cyklu (NADH, FADH2) na kyslík. Elektrony jsou předávány spřaženým systémem oxidací a redukcí na komplexech oxidoreduktáz. Tyto komplexy zároveň slouží jako protonové pumpy. [5]
Přenos H+ z mitochondriální matrix přes vnitřní mitochondriální membránu, způsobí pokles pH na straně zvýšené koncentrace protonů.[6]
Tímto mechanismem vzniká elektrochemický protonový potenciál. Přenosem elektronů získaných z NADH' je takto přeneseno na zevní stranu vnitřní mitochondriální membrány 10 protonů (z FADH2 6 protonů). ATP-syntáza při syntéze nové molekuly spotřebuje 4 protony.
Z toho vyplývá, že:
- 1 NADH = 2,5 ATP (10:4)
- 1 FADH2 = 1,5 ATP (6:4).
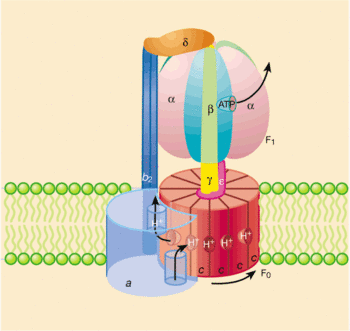
ATP-syntáza[upravit | editovat zdroj]
ATP-syntáza je složena ze 2 částí:
- F0 (protonový kanál) – zavzata do membrány mitochondrie, složena z několika podjednotek.
- Podjednotka a, která obsahuje 2 polokanálky, a z boku nasedá na hydrofobní válcovitý komplex podjednotek c. Tato podjednotka je vázána dalšími podjednotkami, které jí znemožňují pohyb, tudíž se chová jako stator.
- Komplex podjednotek c válcovitého tvaru, který se v lipidové dvojvrstvě otáčí kolem své podélné osy, a chová se jako rotor. Uprostřed každé podjednotky c se nachází molekula aspartátu, na kterou se vážou kanálky podjednotky a. [5]
- F1 (katalytické centrum ATP-syntázy).
- Tři podjednotky α a β tvoří jádro části F1. Podjednotky β mají katalytickou aktivitu, a během rotace hydrofobního válce cyklicky mění svou konformaci, čímž umožňují syntézu ATP.
- Podjednotka δ spojuje F1 se statorem.
- Podjednotka γ slouží jako prodloužení rotoru části F0, což umožňuje změnu konformace podjednotky β, a tím i přeměnu energie mechanické na energii makroergní sloučeniny.
- Konformace L (loose, uvolněná), na podjednotce β dochází k navázání ADP a anorganického fosfátu.
- Konformace T (tight, těsná), podjednotka β váže ADP + P tak silně, že je syntéza ATP urychlena.
- Konformace O (open, otevřená), podjednotka β uvolňuje nově vzniklý ATP.
Na části F0 jsou všechny aspartáty jednotek c hydrofóbní, a jsou umístěné v membráně, což znemožní disociaci jejich karboxylových skupin (-COOH). Aspartáty, které se dotýkají obou kanálků podjednotky a se chovají hydrofilně, a proto jsou disociovány (-COO-).
Díky protonovému gradientu prochází H+ z mezimembránového prostoru vnějším kanálkem podjednotky a. Váže se na aspartát, čímž mění jeho hydrofilní charakter na nedisociovaný (hydrofobní, -COOH), a celý válec je tak otočen o jednu podjednotku c po směru hodinových ručiček. Tím dojde k rotaci druhého disociovaného aspartátu, který se přemístí na místo toho prvního. K podjednotce a se mezitím natočí jeden nedisociovaný aspartát z druhé strany. H+ z karboxylu tohoto aspartátu se disociuje, a prochází druhým kanálkem do mitochondriální matrix (s nižší koncentrací protonů). To způsobí průchod jednoho protonu zevním kanálkem podjednotky a, který se váže na další aspartát a obíhá spolu s rotorem o 360°. Po jednom otočení rotoru projde vnitřním kanálkem podjednotky a, a dostane se do mitochondriální matrix. Tímto mechanismem dochází k neustálému otáčení rotoru, až do stavu vyrovnání koncentrací protonů na obou stranách membrány. [5]
ATP je uvolněna do nitra mitochondriální matrix, a následně transportována do cytoplazmy. Toho je docíleno přenašečem (ADP-ATP-translokáza) uvnitř membrány mitochondrií. Spolu s ADP dochází k symportu Pi a H+ do mitochondriální matrix. Na jednu molekulu ATP v cytosolu musí protonový gradient poskytnout celkem čtyři protony (3 protony na syntézu ATP a 1 proton při symportu Pi− a H+).
Z jedné molekuly NADH, která poskytne 10 protonů tedy vznikne 2,5 ATP (10 : 4), a šest protonů vzniklých oxidací. Molekula FADH2 dodá energii na syntézu 1,5 ATP (6 : 4).[5]
Zásoby v organismu[upravit | editovat zdroj]
Molekula ATP není schopna sama od sebe tvořit zásoby, z důvodu vysoké nestability. Rychlým zdrojem energie pro organismus je stabilnější molekula kreatinfosfát, který lze v případě potřeby snadno štěpit na molekuly ATP. Kreatinfosfát se tvoří při nadměrném množství energie, a ukládá se do svalů. Pokud jeho okamžitá hodnota nestačí energeticky náročným procesům, organismus získává rychle dostupnou energii ze svalového, či jaterního glykogenu.[3]
Odkazy[upravit | editovat zdroj]
Související články[upravit | editovat zdroj]
Literatura[upravit | editovat zdroj]
- ↑ Skočit nahoru k: a b VODRÁŽKA, Zdeněk. Biochemie. 2. vydání. Praha : Academia, 2007. ISBN 978-80-200-0600-4.
- ↑ KODÍČEK, Milan. Biochemické pojmy : výkladový slovník. 1. vydání. Praha : VŠCHT, 2004. 171 s. ISBN 80-7080-551-X.
- ↑ Skočit nahoru k: a b c d KLOUDA, Pavel. Základy biochemie. 2. vydání. Ostrava : Pavel Klouda, 2005. ISBN 80-86369-11-0.
- ↑ PEČ, Pavel. Obecný metabolismus Energetický metabolismus (obecně) (1) [přednáška k předmětu Biochemie, obor Obor biochemie, Přírodovědecká fakulta UPOL]. Olomouc. 2.2.2000. Dostupné také z <https://www.prf.upol.cz/fileadmin/userdata/PrF/katedry/biochemie/Dokumenty/Materialy_k_vyuce/KBC-OMET_01_EnergmetabOBECNE.pdf>. }
- ↑ Skočit nahoru k: a b c d e MATOUŠ, Bohuslav, et al. Základy lékařské chemie a biochemie. 2010. vydání. Praha : Galen, 2010. 0 s. ISBN 978-80-7262-702-8.
- ↑ KOOLMAN, Jan a Klaus-Heinrich RÖHM. Barevný atlas biochemie. 1. vydání. Praha : Grada, 2012. ISBN 978-80-247-2977-0.