1. termodynamický zákon
1. termodynamický zákon vyjadřuje zákon zachování energie v termodynamickém systému. Matematicky:
kde je celkový přírůstek vnitřní energie dané soustavy, je celkové teplo, přijaté systémem od okolí, a je celková práce, kterou systém vykonal na okolí.
Často se setkáme s vyjádřením v diferenciálním tvaru:
U rovnice v diferenciálním tvaru se nejedná o hodnoty změněné za dobu trvání celého děje, ale za nekonečně krátký časový úsek.
Fyzikální interpretace[upravit | editovat zdroj]
Jedná se o případ zákon zachování energie:
Energie, o kterou vnitřní energie systému vzroste, nemůže vzniknout z ničeho, ale musí být systému dodána zvenčí (tj. jeho okolím), a to ve formě tepla Q nebo mechanické práce W. Anebo, jinak řečeno, při výměně energie mezi systémem a okolím energie nevzniká ani nezaniká:
Aplikace 1. termodynamického zákona[upravit | editovat zdroj]
První termodynamický zákon má veliké užití při popisu dějů v ideálním plynu, ve kterém mohou probíhat různé (v praxi využívané) děje. Aby byl jejich popis co nejsnazší a podstata co nejzřetelnější, zavedeme obecné parametry soustavy, na které budou jednotlivé děje popisovány:
Soustava je
- uzavřená (nemůže s okolím vyměňovat hmotu)
- neizolovaná (může s okolím vyměňovat energii)
- obsahuje 1 mol ideálního plynu.
Díky prvním dvěma podmínkám můžeme uvažovat formulaci 1.TZ uvedenou výše, díky třetí podmínce můžeme zanedbat člen - tj. látkové množství (protože ) - a díky poslední podmínce nemusíme uvažovat ztráty způsobené vnitřním třením.
Uvažujme speciální děje, během kterých tato soustava nemění jednu ze svých stavových veličin, tj. , kde je daná stavová veličina.
Izochorický děj[upravit | editovat zdroj]
Děj, při němž nedochází ke změně objemu, tj. , nazýváme izochorický (z řec. isos - stejný a choros - prostor).
Platí . Z prvního termodynamického zákona po dosazení vyplývá
a tedy vešekeré dodané teplo se spotřebuje na zvýšení vnitřní energie .
Křivku závislosti při ději izochorickém nazýváme izochora.
Izotermický děj[upravit | editovat zdroj]
Děj, při němž nedochází ke změně teploty, tj. , nazýváme izotermický (z řec. isos - stejný a therme - teplo).
Platí , kde je molární tepelná kapacita daného plynu za konstatního objemu.
Z prvního termodynamického zákona po dosazení vyplývá
a tedy vešekeré dodané teplo se spotřebuje na vykonání práce.
Křivku závislosti při ději izotermickém nazýváme izoterma.
Izobarický děj[upravit | editovat zdroj]
Děj, při němž nedochází ke změně tlaku, se jmenuje děj izobarický (z řec. "isos" - stejný a "baros" - tíha). Tedy .
Ze stavové rovnice nám vychází matematický popis izobarického děje v ideálním plynu , což je tzv. Gay-Lussacův zákon.
Pro výpočet práce vykonané plynem platí , po dosazení do rovnice prvního termodynamického zákona dostaneme jeho podobu pro izobarický děj.
Křivku závislosti při izobarickém ději nazýváme izobara. Vzhledem ke konstantní hodnotě tlaku, práce vykonaná plynem se dá odečíst z grafu jako plocha pod křivkou ohraničená začáteční a výslední hodnotou objemu plynu. Tato plocha je grafickým zobrazením rovnice .
Teplo přijaté ideálním plynem při izobarickém ději se rovná součtu přírůstku jeho vnitřní energie a práce, kterou plyn vykoná.
Z hlediska platnosti prvního termodynamického zákona je tento děj nejkomplikovanější. Žádná z veličin vystupujících v prvním termodynamickém zákoně nebude nulová (u izochorického děje je nulová práce vykonaná ideálním plynem, u izotermického děje je nulová změna vnitřní energie plynu během daného děje). Praktické využití izobarického děje stejně jako ostatních termodynamických dějů najdeme například u vznětových motorů (Dieselův cyklus).
Adiabatický děj[upravit | editovat zdroj]
Při ději adiabatickém platí , tedy mezi plynem a okolím buď neprobíhá tepelná výměna (jako v izolovaných soustavách), nebo děj proběhne tak rychle, že se žádná tepelná výměna nestihne uskutečnit. Tudíž je děj velmi komplikovaný na uskutečnění. Reálné děje bývají na pomezí mezi dějem izotermickým a adiabatickým (Polytropický děj). Entropie se u adiabatického děje nemění.
Po dosazení do rovnice prvního termodynamického zákona
je vidět, že soustava koná práci na úkor vnitřní energie.
Tato rovnice by se dala dále upravovat, z čeho bychom dostali konst.
Přičemž je Poissonova konstanta a dá se vyjadřit z rovnice .
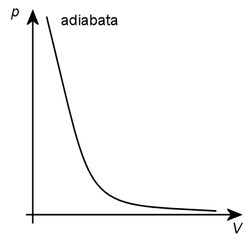
Takové vyjádření stanovuje závislost mezi proměnnými a a tím pádem dovoluje adiabatický děj vyjádřit také na diagramu (p, V). Tato křivka se jmenuje adiabata. Podobá se izotermě, má však strmější průběh, který odvodíme z rovnice izotermy konst. přičemž Poissonova konstanta je větší než jedna.
Při adiabatickém stlačování plynu v nádobě se působením vnější síly na píst koná práce, teplota plynu a jeho vnitřní energie se zvětšuje. Při adiabatickém rozpínání koná práci plyn, teplota plynu i jeho vnitřní energie se zmenšuje. Adiabatického rozpínání se používá k dosažení nízkých teplot, adiabatického stlačování se používá u vznětových motorů: adiabatickou kompresí se zvýší teplota vzduchu na zápalnou teplotu nafty, která se po vstříknutí do tohoto vzduchu sama vznítí.
Odkazy[upravit | editovat zdroj]
Související články[upravit | editovat zdroj]
Zdroje[upravit | editovat zdroj]
- MARŠÁK, Zlatěk. Termodynamika a statistická fyzika. 3. vyd. Praha: Vydavatelství ČVUT, 1995, s. 23-25. ISBN 80-01-01401-0.
- Multimediální encyklopedie fyziky (MEF), 2006-2013, Jaroslav Reichl, Martin Všetička http://fyzika.jreichl.com/