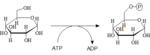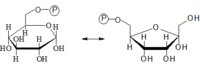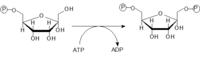Glykolýza
Glykolýza je metabolický proces, ktorý premieňa glukózu (resp. glukózu-6-fosfát) na dve molekuly pyruvátu.[1]
Za anaeróbnych podmienok sa pyruvát mení na laktát za katalýzy laktátdehydrogenázy. Ak má bunka dostatok kyslíku a mitochondrií, pyruvát je prenesený do mitochondriálnej matrix a podlieha oxiadačnej dekarboxylácii – reakcie pyruvátdehydrogenázového komplexu. Regulačnými enzýmami sú 6-fosfofrukto-1-kináza, pyruvátkináza (a do istej miery aj hexokináza/glukokináza).
Fosforylácia glukózy
Glukózu musíme najskôr aktivovať a naviazať na ňu fosfát. Glukóza-6-fosfát, je dôležitým východiskom nielen pre glykolýzu, ale aj pre pentózofosfátovu dráhu a syntézu glykogénu. Reakcia prebieha za katalýzy hexokinázy (väčšina buniek tela) alebo glukokinázy (hepatocyty, β-bunky pankreatu).
Hexokináza
Km pre tento enzým je rovná 0,1 mmol/l, to teda znamená, že reakcia bude dostatočne rýchlo prebiehať aj pri nízkej koncentrácii glukózy. Alebo inými slovami – enzým bude takmer maximálne aktívny pri dolnej hranici normálnej glykémie (3,5 mmol/l).
Glukokináza
Km pre tento enzým je rovná 10 mmol/l čo znamená,že funguje iba pri zvýšenej hladine glukózy. Jej umiestnenie má funkčný význam – β bunky takto dostávajú signál k produkcii inzulínu (po jedle glykémia výrazne narastá, preto začne glukokináza pracovať). Pečeň zase po zvýšení glykémie vychytáva glukózu ktorú využíva na syntézu glykogénu do zásoby.
Postupnosť enzýmov a reakcií
Glukóza-6-fosfátizomeráza
Táto reakcia je vratná, dáva vznik fruktóze-6-fosfátu. Enzým pôsobí len na α-anomér glukózy.
6-Fosfofrukto-1-kináza
Táto reakcia je nevratná, aktivitu enzýmu môžeme allostericky ovplyvniť. Z toho vyplýva, že má podstatnú úlohu v regulácii glykolýzy. Ako kofaktor vystupuje Mg2+. Produktom reakcie je fruktóza-1,6-bisfosfát.
Aldoláza
Fruktóza-1,6-bisfosfát podlieha štiepeniu na dva triózafosfáty, a síce glyceraldehyd-3-fosfát (GAP) a dihydroxyacetónfosfát (DAP). Kedže ďalšie pokračovanie glykolýzy vyžaduje práve GAP, je nutné premieňať DAP na GAP. Deje sa tak prostredníctvom enzýmu triózafosfátizomeráry.
Glyceraldehyd-3-fosfátdehydrogenáza
Tento enzým viaže na GAP (za súčasnej oxidácie) voľný (anorganický) fosfát (Pi). Oxidácia je reakcia exergonická. Uvoľnená energia sa uloží do makroergickej väzby s fosfátom (zjednodušene…), produkt reakcie je 1,3-bisfosfoglycerát a jedna molekula NADH + H+
Fosfoglycerátkináza
Makroergický fosfát vzniknuvší v predchádzajúcej reakcii je zachytený vo forme ATP (reakcia s ADP). Kedže ATP vzniká mimo dýchací reťazec, hovoríme o tzv. fosforylácii na substrátovej úrovni. Reakciou okrem ATP vzniká 3-fosfoglycerát.
Fosfoglycerátmutáza
Fosfát je touto reakciu presunutý z pozície ’tri’ na pozíciu ’dva’. Dostávame teda 2-fosfoglycerát (2-PG).
Enoláza
Enoláza spôsobuje dehydratáciu 2-PG a tým pozdvihnutie fosfátu do vysokoenergetického stavu (resp. jeho odštiepenie, ako sa tomu za chvíľu stane, bude mať vážne následky). Vzniká fosfoenolpyruvát. Enoláza môže byť inhibována fluoridom (klinické využitie: ak chceme zabrániť glykolýze v krvi pred stanovením glykémie)
Pyruvátkináza
Pyruvátkináza odštiepi fosfát. Tým pádom dostávame prudko nestabilnú zlúčeninu – enol-pyruvát. Prečo tá nestabilita? Vodík, naviazaný na kyslíku v rámci hydroxyskupiny, má tendencie presunúť sa na uhlík, tým sa dvojitá väzba prešmykne medzi uhlík a kyslík, čim vznikne ketoskupina (tzv. keto-enol tautoméria). Pri prešmyku sa uvoľní energia, ktorá je zachytená vo forme ATP (ADP reaguje s uvoľneným fosfátom). Reakcia je nevratná, a teda potenciálne regulačná. Výsledkom je pyruvát (alebo teda keto-pyruvát).
Premeny pyruvátu
Laktátdehydrogenáza
Laktátdehydrogenáza (LD nebo LDH, EC 1.1.1.27) je oxidoredukční enzym katalyzující reverzibilní přeměnu laktátu na pyruvát. Struktura molekuly je tvořena 4 podjednotkami o relativní molekulové hmotnosti 34 000. Každá z těchto podjednotek může být buď M (muscle) nebo H (heart), takže celkem existuje 5 izoenzymů označovaných LD1 (s podjednotkovým složením H4) až LD5 (M4). LD je přítomna v cytoplazmě buněk mnoha tkání. Do cirkulace se uvolňuje již při mírném tkáňovém poškození.
| isoenzym | podjednotky | výskyt |
|---|---|---|
| LD1 | H4 | myokard + erytrocyty |
| LD2 | H3M | myokard + erytrocyty |
| LD3 | H2M2 | kosterní svaly |
| LD4 | HM3 | játra + kosterní svaly |
| LD5 | M4 | játra + kosterní svaly |
Vyšetření
Zvýšení katalytické koncentrace celkové LD v séru doprovází řadu onemocnění. V současné době se stanovení celkové aktivity LD používá jako nespecifický marker rozpadu buněk, např. při nádorových onemocněních (leukémie, testikulární nádory). Charakteristické je také pozdní zvýšení celkové LD po infarktu myokardu, které může přetrvávat až 15 dní. Vzhledem k vysokému obsahu v erytrocytech může sérovou koncentraci falešně pozitivně zvýšit hemolýza. Použití LD a jejích izoenzymů pro diagnostiku akutního koronárního syndromu se dnes považuje za zastaralé.
Fyziologická horní hranice LD pro dospělé muže a ženy je 4,10 µkat/l.[2]
Pro stanovení se využívá optického testu. Zastoupení izoenzymů lze určit elektroforeticky.
Pyruvátdehydrogenáza
Pyruvát dehydrogenázový komplex je komplex tří enzymů uvnitř mitochondrie: pyruvát dekarboxylázy, dihydrolipoyltransacetylázy a dihydrolipoyldehydrogenázy. Komplex pracuje jako celek v přítomnosti koenzymů TDP, NAD+, lipoátu ve formě lipoamidu, FAD a koenzymu A. Pyruvát dekarboxyláza katalyzuje oxidativní dekarboxylaci pyruvátu s navázáním acetylu na TPP, dihydrolipoyltransacetyláza katalyzuje přenesení acetylu z TPP přes lipoamid na koenzym A a dihydrolipoyldehydrogenáza regeneruje lipoamid pomocí FAD, z něhož vzniká FADH2, které regeneruje zase pomocí NAD+, z něhož vzniká NADH + H+. Enzym je inhibován arsenem v oxidačním stavu AsIII (arsenitan), který blokuje lipoamid.
Energetická bilancia
| Aeróbne podmienky | --- | Anaeróbne podmienky | ||
| aktivácia | −2 ATP | --- | aktivácia | -2 ATP |
| priamo v glykolýze | 2 x 2 ATP | --- | priamo v glykolýze | 2 x 2 ATP |
| redukované koenzýmy (člnky) | 3–5 ATP | --- | redukované koenzýmy | spotrebované pre LDH |
| PDH komplex | 5 ATP | --- | ||
| oxidácia AcCoA | 20 ATP | --- | ||
| celkovo | 30–32 ATP | --- | celkovo | 2 ATP |
Aeróbne podmienky
V prípade dostatočného množstva kyslíku v bunke spotrebuváva dýchací reťazec redukované koenzýmy. Citrátový cyklus beží naplno (dodávka redukovaných koenzýmov) a potrebuje pre svoju činnosť acetylkoenzým A. Ten prichádza z nevratnej PDH reakcie, ktorá spotrebuváva pyruvát vznikajúci v glykolýze. Malá poznámka k člnkom: Redukované koenzýmy, ktoré vznikli v glykolýze, nedifundujú cez mitochondriálne membrány. K ich transportu sa používajú člnky – Malátaspartátový (v konečnom dôsledku prínos 5 ATP v dýchacom reťazci) a Glycerolfosfátový (v konečnom dôsledku prínos 3 ATP v dýchacom reťazci). Preto je v tabuľke v kolonke „redukované koenzýmy (člnky)“ uvedený údaj 3–5 ATP.
Anaeróbne podmienky
Keď bunka nemá mitochondrie (Erytrocyty, dreň obličky) alebo dostatok kyslíku (ischemické tkanivo, kostrový sval pri záťaži), dýchací reťazec funguje obmedzene (resp. je zastavený). Súčasne s ním stagnujú deje, ktoré mu predchádzajú (citrátový cyklus, PDH). LDH preto premieňa hromadiaci sa pyruvát na laktát. Ten sa postupne vylučuje do krvi.
Pri narušení cirkulácie (infarkt myokardu, pľúcna embólia, šok) vysoké plazmatické hladiny laktátu spôsobia pokles pH a rozvíja sa Respiračná acidóza.
Anaeróbna glykolýza prebieha aj v bunkách orgánov, ktoré nemajú vyvinuté bohaté cievne zásobenie: šošovka, rohovka.
Regulácia
Odkazy
Související články
Reference
- ↑ ŠVÍGLEROVÁ, Jitka. Glykolýza [online]. Poslední revize 18.2.2009, [cit. 2010-12-25]. <http://wiki.lfp-studium.cz/index.php?title=Glykol%C3%BDza&oldid=359>.
- ↑ Jaroslav Racek et al.: Klinická biochemie, druhé, přepracované vydání, Galén, 2006
Použitá literatura
- DUŠKA, František. Biochemie v souvislostech, 1.díl – základy energetického metabolizmu. 1. vydání. Praha : Karolinum, 2006. ISBN 80-246-1116-3.
- MURRAY, Robert K.. Harperova biochemie. 2. vydání. Jinočany : H&H, 1998. ISBN 80-7319-013-3.