Metabolismus nukleotidů: Porovnání verzí
m (Náhrada zastaralých názvů látek za aktuálnější) |
m (pravopis) |
||
| Řádek 3: | Řádek 3: | ||
=== Biosynthesa purinových nukleotidů === | === Biosynthesa purinových nukleotidů === | ||
Puriny nejsou v potravě esenciální a lidský organismus je dokáže synthesovat. [[Dusíkatá báze|Dusíkatá base]] není synthesována samostatně a připojena k pentózafosfátu, nýbrž se vždy synthesují celé nukleotidy.<br /> | Puriny nejsou v potravě esenciální a lidský organismus je dokáže synthesovat. [[Dusíkatá báze|Dusíkatá base]] není synthesována samostatně a připojena k pentózafosfátu, nýbrž se vždy synthesují celé nukleotidy.<br /> | ||
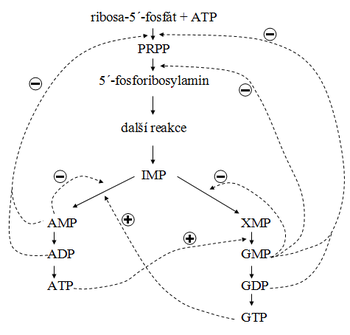
Synthesa purinových nukleotidů vychází z ribosa-5´-fosfátu, který se fosforyluje na 5´-fosforibosyl-1´-difosfát (PRPP). Následuje řada reakcí, kterými vzniká inosinmonofosfát (IMP), což je společný | Synthesa purinových nukleotidů vychází z ribosa-5´-fosfátu, který se fosforyluje na 5´-fosforibosyl-1´-difosfát (PRPP). Následuje řada reakcí, kterými vzniká inosinmonofosfát (IMP), což je společný prekurzor pro guanosinmonofosfát (GMP) i adenosinmonofosfát (AMP). Viz obr. 1.<br /> | ||
==== Vznik AMP z IMP ==== | ==== Vznik AMP z IMP ==== | ||
IMP reaguje s aspartátem za přítomnosti adenylsukcinátsynthetasy, spotřebuje se molekula GTP a uvolní se molekula vody. Vzniklý adenylsukcinát účinkem adenylsukcinasy (adenylsukcinátlyasy) odštěpuje molekulu fumarátu a vzniká AMP. AMP se jednoduše fosforyluje nespecifickými kinázami na ADP a posléze na [[Adenosintrifosfát|ATP]]. Viz obr. 1. | IMP reaguje s aspartátem za přítomnosti adenylsukcinátsynthetasy, spotřebuje se molekula GTP a uvolní se molekula vody. Vzniklý adenylsukcinát účinkem adenylsukcinasy (adenylsukcinátlyasy) odštěpuje molekulu fumarátu a vzniká AMP. AMP se jednoduše fosforyluje nespecifickými kinázami na ADP a posléze na [[Adenosintrifosfát|ATP]]. Viz obr. 1. | ||
| Řádek 30: | Řádek 30: | ||
=== Biosynthesa pyrimidinů === | === Biosynthesa pyrimidinů === | ||
[[Soubor:Pyrimidiny1.png | thumb | right | 400px | Obr. 5 - synthesa pyrimidinových nukleotidů]] | [[Soubor:Pyrimidiny1.png | thumb | right | 400px | Obr. 5 - synthesa pyrimidinových nukleotidů]] | ||
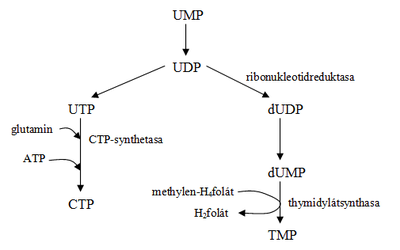
Stejně jako u purinů i zde platí, že je synthesován hotový nukleotid, nikoliv samostatná dusíkatá organická base s následným připojením pentózy a fosfátu. Biosynthesa probíhá v cytosolu a prvním krokem je synthesa karbamoylfosfátu cytosolovou karbamoylfosfátsynthetasou (mitochondriální karbamoylfosfátsynthetasa funguje při [[Močovinový cyklus|synthese močoviny]]). Karbamoylfosfát vzniká reakcí glutaminu s CO<sub>2</sub> za spotřeby ATP. Několika reakcemi se cyklisací karbamoylfosfátu s aspartátem odštěpí voda a následnou dehydrogenací se vytvoří [[kyselina orotová]] (orotát). Následnou reakcí s PRPP vzniká orotidin-5´-fosfát (orotidinmonofosfát, OMP), který se dekarboxylací mění na uridin-5´-fosfát (UMP). Část enzymů je při synthese pyrimidinů umístěna na jediném proteinovém enzymovém řetězci, což výrazně urychluje chod reakcí. UMP je společným | Stejně jako u purinů i zde platí, že je synthesován hotový nukleotid, nikoliv samostatná dusíkatá organická base s následným připojením pentózy a fosfátu. Biosynthesa probíhá v cytosolu a prvním krokem je synthesa karbamoylfosfátu cytosolovou karbamoylfosfátsynthetasou (mitochondriální karbamoylfosfátsynthetasa funguje při [[Močovinový cyklus|synthese močoviny]]). Karbamoylfosfát vzniká reakcí glutaminu s CO<sub>2</sub> za spotřeby ATP. Několika reakcemi se cyklisací karbamoylfosfátu s aspartátem odštěpí voda a následnou dehydrogenací se vytvoří [[kyselina orotová]] (orotát). Následnou reakcí s PRPP vzniká orotidin-5´-fosfát (orotidinmonofosfát, OMP), který se dekarboxylací mění na uridin-5´-fosfát (UMP). Část enzymů je při synthese pyrimidinů umístěna na jediném proteinovém enzymovém řetězci, což výrazně urychluje chod reakcí. UMP je společným prekurzorem pro TTP, CTP a UTP (viz obr. 5). Z CDP působením ribonukleotidreduktázy vzniká dCDP, následnou fosforylací dCTP. | ||
==== Šetřící dráha ==== | ==== Šetřící dráha ==== | ||
V metabolismu pyrimidinů má význam také šetřící dráha. Její princip je stejný jako u purinových nukleotidů. | V metabolismu pyrimidinů má význam také šetřící dráha. Její princip je stejný jako u purinových nukleotidů. | ||
Verze z 10. 8. 2020, 10:32
Metabolismus nukleotidů pojednává o trávení, biosynthese a katabolismu purinových a pyrimidinových nukleotidů a o vybraných chorobách souvisejících s genetickými defekty uvedených procesů.
Metabolismus purinových nukleotidů
Biosynthesa purinových nukleotidů
Puriny nejsou v potravě esenciální a lidský organismus je dokáže synthesovat. Dusíkatá base není synthesována samostatně a připojena k pentózafosfátu, nýbrž se vždy synthesují celé nukleotidy.
Synthesa purinových nukleotidů vychází z ribosa-5´-fosfátu, který se fosforyluje na 5´-fosforibosyl-1´-difosfát (PRPP). Následuje řada reakcí, kterými vzniká inosinmonofosfát (IMP), což je společný prekurzor pro guanosinmonofosfát (GMP) i adenosinmonofosfát (AMP). Viz obr. 1.
Vznik AMP z IMP
IMP reaguje s aspartátem za přítomnosti adenylsukcinátsynthetasy, spotřebuje se molekula GTP a uvolní se molekula vody. Vzniklý adenylsukcinát účinkem adenylsukcinasy (adenylsukcinátlyasy) odštěpuje molekulu fumarátu a vzniká AMP. AMP se jednoduše fosforyluje nespecifickými kinázami na ADP a posléze na ATP. Viz obr. 1.
Vznik GMP z IMP
IMP se účinkem IMP-dehydrogenázy (kofaktorem je NAD+) oxiduje na xanthosinmonofosfát (XMP). XMP v následující reakci reaguje s glutaminem za spotřeby ATP. Z XMP vzniká GMP, z glutaminu vzniká glutamát. Prostou fosforylací GMP vzniká GDP a GTP. Viz obr. 1.
Regulace biosynthesy purinů
Hlavním faktorem, který řídí synthesu purinových nukleotidů, je dostupnost PRPP.
Pro rychlost synthesy je také důležitý negativní a positivní zpětnovazebný mechanismus v některých stupních biosynthesy, které vyvolávají AMP, ADP, GMP a GDP (viz obr. 1). Výsledkem vzájemné koordinace je to, že když je dostatek GTP, urychlí se přeměna IMP na AMP. Je-li dostatek ATP, urychlí se konverse XMP na GMP. Tento vztah zaručuje synthesu téměř stejného množství GMP jako AMP.
Šetřící dráha (salvage pathway)
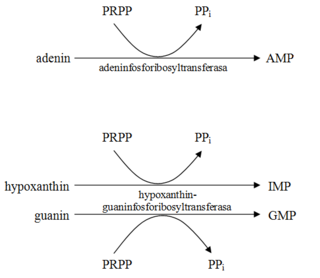
Metabolismem se v těle neustále uvolňují purinové base a nukleosidy. Byla prokázána jejich recyklace, hovoříme o šetřící dráze. Skrze ni jsou hypoxanthin (i adenin) a guanin v játrech enzymaticky převáděny na monofosfáty až trifosfáty (viz obr. 2). Tyto reakce jsou energeticky méně náročné než synthesa de novo.
Synthesa purinových deoxyribonukleotidů
Deoxyribonukleotidy vznikají z ribonukleotidů. Redukcí D-ribosy na druhém uhlíku ribonukleosiddifosfátu (např. ADP) vzniká 2´-deoxyribonukleosiddifosfát (dADP). Tuto reakci katalysují ribonukleotidreduktázy využívající NADPH a thioredoxin (viz obr. 3). Podobně jako v případech výše, dNTP vzniká fosforylací dNDP nespecifickými kinázami. Thioredoxinreduktáza obsahuje v aktivním centru selenocystein.
Katabolismus purinových nukleotidů
Štěpením nukleových kyselin vznikají volné nukleotidy. Tyto se účinkem nukleotidas mění na nukleosidy. Už zmíněnou šetřící dráhou jsou některé molekuly purinových basí schopné reakce s PRPP a mohou znovu vytvořit příslušné nukleosidmonofosfáty (AMP, GMP).
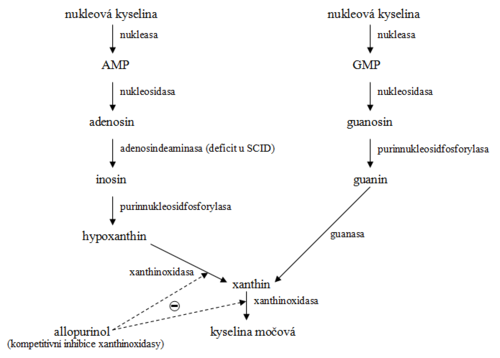
Schéma degradace je na obr. 4. U člověka je konečným produktem metabolismu purinů kyselina močová, která se vylučuje do moči. U většiny savců se kyselina močová dále štěpí urikasou (urátoxidázou) za tvorby allantoinu. U člověka je však jeho tvorba nepatrná.
Onemocnění spojená s metabolismem purinů
Deficit hypoxanthin-guaninfosforibosyltransferasy vyvolává genetické onemocnění, Lesch-Nyhanův syndrom. Při tomto onemocnění je omezen chod šetřící dráhy. To se projeví zvýšenou tvorbou urátu (hyperurikemií) a zvýšeným intracelulárním množstvím PRPP.
Deficit adenosindeaminasy podmiňuje těžkou kombinovanou imunodeficienci (SCID).
Hyperurikemie způsobuje dnu (arthritis uratica). Toto závažné kloubní onemocnění nemá jednotnou příčinu, bylo prokázáno několik odchylek metabolismu purinů. Nejčastější a nejběžnější příčinou je defekt v synthese PRPP. U pacientů se hromadí velké množství kyseliny močové v měkkých tkáních, čímž vznikají tzv. tofy. Běžným důsledkem je též nephrolithiasis. Hlavním příznakem dny jsou velmi bolestivé akutní záchvaty v kloubech.
Metabolismus pyrimidinových nukleotidů
Biosynthesa pyrimidinů
Stejně jako u purinů i zde platí, že je synthesován hotový nukleotid, nikoliv samostatná dusíkatá organická base s následným připojením pentózy a fosfátu. Biosynthesa probíhá v cytosolu a prvním krokem je synthesa karbamoylfosfátu cytosolovou karbamoylfosfátsynthetasou (mitochondriální karbamoylfosfátsynthetasa funguje při synthese močoviny). Karbamoylfosfát vzniká reakcí glutaminu s CO2 za spotřeby ATP. Několika reakcemi se cyklisací karbamoylfosfátu s aspartátem odštěpí voda a následnou dehydrogenací se vytvoří kyselina orotová (orotát). Následnou reakcí s PRPP vzniká orotidin-5´-fosfát (orotidinmonofosfát, OMP), který se dekarboxylací mění na uridin-5´-fosfát (UMP). Část enzymů je při synthese pyrimidinů umístěna na jediném proteinovém enzymovém řetězci, což výrazně urychluje chod reakcí. UMP je společným prekurzorem pro TTP, CTP a UTP (viz obr. 5). Z CDP působením ribonukleotidreduktázy vzniká dCDP, následnou fosforylací dCTP.
Šetřící dráha
V metabolismu pyrimidinů má význam také šetřící dráha. Její princip je stejný jako u purinových nukleotidů.
Katabolismus pyrimidinových nukleotidů
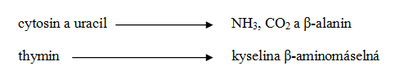
Katabolismus pyrimidinů probíhá převážně v játrech. Jednotlivé pyrimidinové base vznikají degradací nukleových kyselin podobně, jako purinové (viz obr. 4). Degradační pochody jednotlivých pyrimidinových basí jsou přibližně obrácenou synthesou. Konečné produkty degradace jsou (na rozdíl od degradace purinů) vesměs dobře rozpustné ve vodě (viz obr. 6).
Odkazy
Související články
Použitá literatura
- LEDVINA, Miroslav, et al. Biochemie pro studující medicíny 1. díl. 2. vydání. Praha : Karolinum, 2009. 269 s. s. 248 - 258. ISBN 978-80-246-1416-8.
- MURRAY, Robert K., Daryl K. GRANNER a Peter A. MAYES, et al. Harperova biochemie. 4. vydání. Jinočany : H & H, 2002. 872 s. s. 379 - 393. ISBN 80-7319-013-3.
- MATOUŠ, Bohuslav, et al. Základy lékařské chemie a biochemie. 2010. vydání. Praha : Galen, 2010. 517 s. s. 257 - 280. ISBN 978-80-7262-702-8.