Enzýmy (cvičenie z biochémie)
(přesměrováno z Enzýmy (Cvičenie z biochémie))
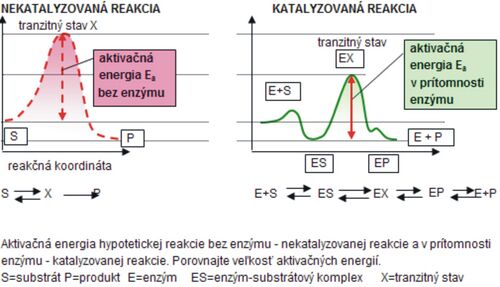
Enzýmy sú katalyzátory biochemických procesov prebiehajúcich v živých organizmoch, a preto sú často nazývané biokatalyzátory. Keďže ide o látky bielkovinovej povahy, vznikajú rovnako ako iné proteíny proteosyntézou, ktorá je regulovaná podľa požiadaviek bunky a organizmu. Enzýmy sú štiepené proteinázami a majú svoj biologický polčas života. Molekuly enzýmu majú definované priestorové usporiadanie – konformáciu. Tá umožňuje, aby určité bočné reťazce aminokyselín sa dostali do vzájomnej blízkosti a vytvorili tzv. aktívne miesto enzýmu. Na toto miesto sa viaže substrát (S) (látka, ktorá sa má premieňať), vzniká labilný medziprodukt – komplex enzým – substrát (ES), ktorý sa samovoľne rozpadá na produkt (P) reakcie a enzým (E). Enzýmy urýchľujú ustálenie chemickej rovnováhy reakcie znížením aktivačnej energie – Ea (obr. 1).
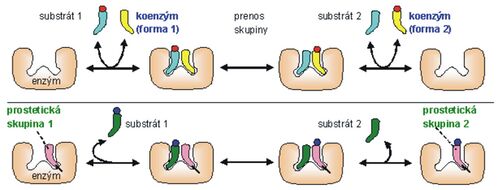
Enzýmy obsahujú často aj nebielkovinovú zložku, prostetickú skupinu alebo koenzým (obr. 2). Bielkovinová zložka enzýmu (holoenzýmu) sa nazýva apoenzým. Koenzým sa slabo viaže na apoenzým a môže od neho oddisociovať. Prostetická skupina sa z apoenzýmu neuvoľňuje, ale je na neho pevne naviazaná. V súčasnosti sa často používa všeobecnejší pojem kofaktor, ktorý nerozlišuje spôsob väzby.
Enzým (holoenzým) = apoenzým + kofaktor (prostetická skupina, koenzým)
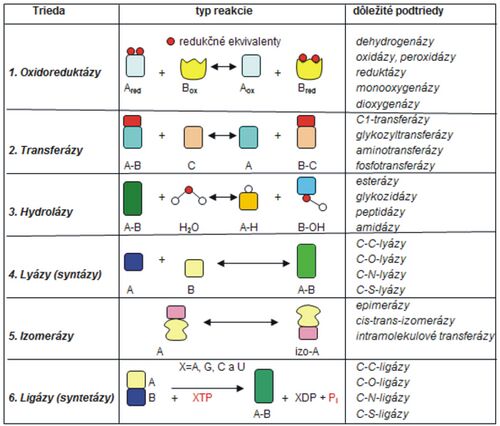
Rozdelenie a katalytická aktivita enzýmov[upravit | editovat zdroj]
V nasledujúcej tabuľke (tab. 1) sú prehľadne uvedené jednotlivé triedy enzýmov a schematicky zobrazené ich účinky (typ reakcie, ktorú jednotlivé enzýmy katalyzujú). V tabuľke sú uvedené aj príklady niekoľkých konkrétnych kofaktorov.
Vyjadrenie enzýmovej aktivity[upravit | editovat zdroj]
Aktivity enzýmov sú vyjadrované v jednotkách podľa medzinárodnej sústavy jednotiek (Systeme International d´Unides – SI) a doporučenia IFCC (International Federation of Clinical Chemistry). Jednotkou na vyjadrovanie enzýmovej aktivity v sústave SI je katal (kat), ktorý je najčastejšie používaný v prepočte na 1 liter biologickej tekutiny.
Definícia: 1 kat je taká aktivita enzýmu, ktorá premení 1 mol substrátu za 1 s.
V odbornej biochemickej ako aj medicínskej praxi sa stále stretávame s medzinárodnou jednotkou U, ktorá sa oficiálne používala do roku 1980. Medzinárodnou jednotka U bola definovaná ako aktivita enzýmu, ktorá premení 1 µmol substrátu za 1 min pri 25 °C. Keďže sa stále používa uvádzame základný vzájomný prepočet týchto jedotiek:
1 kat = 1 mol · s−1 = 60 mol · min−1 = 60,106 mmol · min−1 = 6,107 U
Kinetika enzýmových reakcií[upravit | editovat zdroj]
Michaelisová konštanta (Km) je definovaná ako koncentrácia substrátu, pri ktorej je rýchlosť enzýmovo katalyzovanej reakcie polovičná. Km je základnou kinetickou konštantou, ktorá je pri daných podmienkach (pH, teplota, zloženie reakčnej zmesi a pod.) pre každú dvojicu enzým – substrát charakteristická. Je vyjadrená vzťahom upravenej rovnice Michaelisa-Mentenovej:
Stanovenie Km[upravit | editovat zdroj]
Km môžeme stanoviť (obr. 3):
- z grafického znázornenia závislosti reakčnej rýchlosti od koncentrácie substrátu, pričom určitú ťažkosť spôsobuje určenie maximálnej rýchlosti s dostatočnou presnosťou
- úpravou rovnice Michaelisa-Mentenovej, v ktorej hyperbolická závislosť je premenená na priamkovú, získavame presnejší vzťah pre výpočet Km. Najbežnejšia je úprava podľa Lineweavera a Burka, v ktorej sa vyhodnocujú prevrátené hodnoty rýchlosti a koncentrácie substrátu.
(Vmax – maximálna rýchlosť, Km – Michaelisova konštanta – predpokladom je, že [E] = konšt.)
Typy inhibície enzýmovej aktivity[upravit | editovat zdroj]
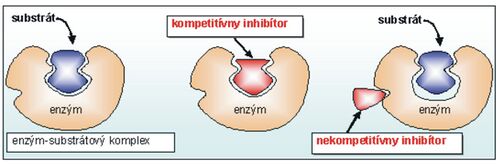
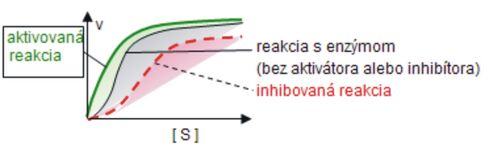
Enzýmy sa vyznačujú vysokou špecifickosťou voči substrátu (substrátová špecifickosť) i typu katalyzovanej reakcie (účinková špecifickosť). Ich aktivita sa môže rýchlo meniť v závislosti od potrieb bunky i celého organizmu. Aktivátory stimulujú a inhibítory inhibujú rýchlosť enzýmových reakcií. Inhibícia môže byť reverzibilná a ireverzibilná. Pri reverzibilnej inhibícii sa jedná na rozdiel od ireverzibilnej inhibície o nekovalentnú väzbu inhibítora, pričom poznáme inhibíciu kompetitívnu, nekompetitívnu a akompetitívnu. Na obr. 4 je znázornené rozlíšenie medzi kompetitívnym a nekompetitívnym inhibítorom.
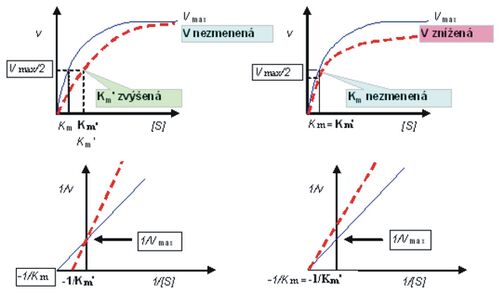
Na nasledujúcom obrázku (obr. 5) je vplyv koncentrácie substrátu (S) na rýchlosť (v) enzýmovej reakcie v závislosti od inhibítora a závislosť Km od typu inhibície:
(modrá čiara bez inhibítora, červená s inhibítorom – vľavo kompetitívnym a vpravo nekompetitívnym)
Faktory ovplyvňujúce rýchlosť enzýmovej reakcie[upravit | editovat zdroj]
V živej bunke sú enzýmy usporiadané tak, aby jednotlivé reakcie na seba plynulo nadväzovali, takže často vytvárajú tzv. multienzýmové komplexy. V porovnaní s anorganickými katalyzátormi sú enzýmy omnoho účinnejšie, ale aj citlivejšie na vonkajšie vplyvy (teplotu, pH a pod.). Enzýmovo katalyzované reakcie prebiehajú v živom organizme (i v skúmavke) rôznou rýchlosťou, ktorá závisí od:
- koncentrácie substrátu
- koncentrácie enzýmu
- teploty
- reakčného prostredia (pH)
- prítomnosti aktivátorov a inhibítorov
Koncentrácia substrátu[upravit | editovat zdroj]
Koncentrácia substrátu, pri ktorej reakčná rýchlosť enzýmom katalyzovanej reakcie zodpovedá polovičnej hodnote maximálnej rýchlosti sa nazýva Michaelisova konštanta – Km enzýmu danej reakcie (obr. 3).
Koncentrácia enzýmu[upravit | editovat zdroj]
Pre rýchlosť Vmax enzýmovej reakcie pri vysokých koncentráciach substrátu platí:
Vmax = k · [E]T = konšt.
Všetky experimenty pre zistenie vplyvu koncentrácie enzýmu na rýchlosť reakcie sa musia robiť pri nadbytku substrátu, kedy už reakcia nie je závislá na vplyve jeho koncentrácie.
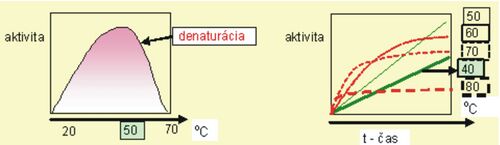
Vplyv teploty na aktivitu enzýmov[upravit | editovat zdroj]
Ďalším významným faktorom, který ovplyvňuje katalytickú aktivitu enzymu je teplota (obr. 6). So zvyšovaním teploty sa zvyšuje aktivita enzýmov (v rozmedzí od 20–50 °C) približne dvojnásobne. Pri vyšších teplotách sa postupne rýchlosť reakcie znižuje, pretože enzýmy denaturujú (až na výnimky – napr. enzýmy termostabilných baktérií). Teplota, pri ktorej enzým vykazuje maximálnu aktivitu sa nazýva teplotné optimum enzýmu. Pre väčšinu enzýmov je teplotné optimum v rozmedzí 35–45 °C. Pri teplotách okolo bodu mrazu reakcie takmer neprebiehajú. K uchovávaniu biologického materiálu sa využívá hlbokého zmrazenia na −20 °C, kedy sa enzýmové reakcie úplne zastavujú.
Vplyv pH na aktivitu enzýmov[upravit | editovat zdroj]
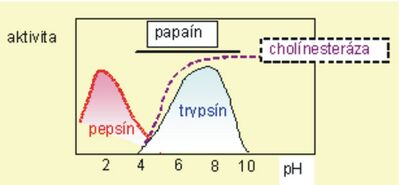
Jedním z faktorů, který výrazně ovlivňuje aktivitu enzymu je hodnota pH prostředí. Použitie silne kyslých alebo silne alkalických roztokov môže zapríčiniť až denaturáciu enzýmu a tým stratu biologických vlastností. Menej drastické zmeny pH prostredia ovplyvňujú aktivitu zmenou stupňa disociácie funkčných skupín enzýmu a substrátu, prípadne k zmenou konformácie molekuly enzýmu. To zmení schopnosť substrátu viazať sa s enzýmom. Väčšina enzýmov vykazuje maximálnu aktivitu v rozmedzí hodnôt pH 5–8 a táto oblasť sa nayýva optimum pH. Pochopitelne existujú výnimky a niektoré enzýmy majú pH-optimum pri značne odlišných hodnotách, napr. pre pepsin je to pH 1,5–2,5 alebo pre alkalickú fosfatázu 9,5–9,7. Graficky vyjadrená závislosť rýchlosti reakcie od pH má obvykle tvar zvonovitej krivky s vrcholom pri optimálnom pH (obr. 7).
Katalytickú aktivitu enzýmu taktiež ovplyvňuje zmena iónovej sily roztoku a zloženie pufru, oxidoredukčné podmienky, ionizujúce žiarenie alebo prídavok inhibítorov či aktivátorov.
Enzýmy v klinickej diagnostike[upravit | editovat zdroj]
Enzýmy v bunkách ovplyvňujú biologické pochody tým, že sa zúčastňujú regulácie metabolických a funkčných procesov. Poškodenie buniek môže viesť k zmenám v aktivitách enzýmov a po poškodení buniek sa enzýmy môžu uvoľniť do krvi. Z hľadiska samotných biochemických metód je u pacienta potrebné hodnotiť dynamiku zistených zmien a nie je možné sa spoliehať len na posúdenie jedného vyšetrovaného parametra.
Izoformy enzýmov[upravit | editovat zdroj]
Stanovenie izoenzýmov má význam pre zvýšenie diagnostickej špecifity. Rozlišujeme pravé izoenzýmy, ktoré sú kódované rôznymi štruktúrnymi génmi a pseudoizoenzýmy, ktoré majú rovnaký genetický základ, ale líšia sa posttranslačnými úpravami (posttranslačné varianty napr. ALP – pseudoizoenzýmy žlčových ciest, nádorových buniek). Pravé izoenzýmy vznikajú:
- modifikáciou génov v rôznych lokusoch (rovnaké u všetkých ľudí, vznikli v priebehu evolúcie), napr. izoenzýmy AST – mitochondriálne, cytoplazmatické alebo ALP – črevné, tkanivovo nešpecifické (pečeň, kosť, obličky), placentárne, fetálne;
- modifikáciou génov v rovnakom lokuse, rôznej alely (vrodené variácie génu), napr. glukóza-6-P-dehydrogenáza bola z erytrocytov rôznych ľudí izolovaná vo viac ako 150 izoformách;
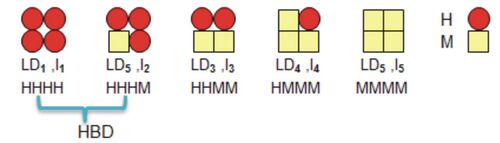
- ako tzv. hybridné izoenzýmy kombináciou minimálne 2 podjednotiek kódovaných odlišnými štruktúrnymi génmi, napr. laktátdehydrogenáza (LD, obr. 8) obsahujúca podjednotky H (heart) a L (muscle) alebo kreatínkináza (CK, obr. 9) zložená z podjednotiek B (brain) a M (muscle).
Využitie stanovenia izoenzýmov v sére
Izoenzýmy katalyzujú rovnakú reakciu, ale ich molekuly sa líšia svojimi fyzikálno chemickými, kinetickými a imunologickými vlastnosťami. Tieto rozdiely sa môžu prejaviť napríklad vzťahom izoenzýmov k inhibítorom, v špecificite katalyzovaných reakcií, v rôznej odolnosti voči denaturačným vplyvom, majú rôzne pH optimá a líšia sa v bielkovinovej zložke.
Enzýmy v krvi[upravit | editovat zdroj]
Stanovenie aktivít enzýmov v sére patrí spolu s ďalšími metódami klinickej biochémie medzi dôležité vyšetrenia, ktoré pomáhajú lekárovi určiť či potvrd iť diagnózu a informujú o priebehu ochorenia. Aby boli správne interpretované hodnoty enzýmových aktivít, je potrebné poznať faktory, ktoré ich aktivitu v sére ovplyvňujú a ktoré určujú aj vhodnosť vyšetrenia určitých enzýmov v priebehu ochorenia.
Faktory ovplyvňujúce aktivitu enzýmov v krvi[upravit | editovat zdroj]
Pôvod a úloha enzýmov
Enzýmy, ktoré sa nachádzajú v plazme môžeme rozdeliť na sekréčne a bunkové. Sekréčne enzýmy sa uvoľňujú do prostredia a možeme ich rozdeliť na:
- funkčné enzýmy plazmy – ich úlohou je katalyzovať reakcie prebiehajúce v krvnom riečišti. Patria sem napr enzýmové komplexy zúčastňujúce sa na zrážaní krvi. Niektoré z týchto enzýmov vznikajú v pečeni a preto ich aktivita v plazme pri jej poškodení klesá.
- funkčné enzýmy GIT (špecifické) – katalyzujú reakcie prebiehajúce v GIT a tým umožňujú trávenie a vstrebávanie zložiek prijatej potravy. Do tejto skupiny patria napr. pankreatické enzýmy (napr. amyláza, lipáza, trypsín). Pri prekážke v cestách, ktorými sa tieto enzýmy dostávajú do tráviacej rúry, alebo pri väčšom poškodení buniek v ktorých sa tvoria, aktivita týchto enzýmov v sére stúpa.
Bunkové enzýmy predstavujú veľkú skupinu enzýmov, ktoré majú svoju úlohu v metabolizme buniek a do krvného riečišťa sa dostávajú pri ich rozpade alebo poškodení. Výrazne stúpa ich aktivita v sére pri poškodení orgánov z ktorých pochádzajú. Patria sem napr. tranaminázy, kreatínkináza, glutamátdehydrogenáza. Malá časť týchto enzýmov sa uvoľňuje do krvného riečišťa aj za fyziologických podmienok.
Aktivity jednotlivých enzýmov v bunkách Špecifické úlohy orgánov a buniek úzko súvisia s ich metabolizmom. Rozličné orgány a bunky preto obsahujú aj rozdielne množstvá enzýmov (tab. 2). Rozličné aktivity enzýmov v orgánoch patria medzi hlavné faktory, od ktorých závisí aj zmena ich aktivít v sére. Vzhľadom na neustálu prestavbu orgánov, môžeme ich aktivitu v sére dokázať aj za fyziologických podmienok.
Tab. 2 Aktivity vybraných enzýmov
| Enzým | Pečeň | Srdce | Kostrový sval | Erytrocyty | Sérum |
|---|---|---|---|---|---|
| nkat.g-1 | nkat.ml-1 | ||||
| AST | 980 | 870 | 600 | 13,34 | 0,4 |
| ALT | 580 | 48 | 57 | 1,7 | 0,4 |
| LD | 2 420 | 2 068 | 2 450 | 600 | 4 |
| CK | 12 | 5 830 | 33 840 | < 0,1 | 0,83 |
| GMD | 630 | 18 | 8 | < 0,1 | 0,06 |
| Aldoláza | 95 | 82 | 800 | 16,7 | 0,07 |
Ďalším faktorom, ktorý vplýva na hladinu enzýmov v krvi je rýchlosť uvoľňovania enzýmov do séra, ktorá môže byť ovplyvnená predovšetkým väzbou enzýmu na bunkové častice, fyzikálno chemickými vlastnosťami molekuly enzýmu a lokalizáciou enzýmu v bunke. Enzýmy, nachádzajúce sa v cytoplazme sa pri poškodení bunkovej membrány môžu uvoľniť do prostredia skôr ako napr. enzýmy viazané v mitochondriách. Enzýmy sa do krvného riečišťa dostávajú nielen pri rozpade bunky, ale aj po jej poškodení napr. nedostatkom kyslíka, či škodlivými látkami. Tieto procesy môžu zvýšiť priepusnosť bunkovej membrány a za týchto podmienok zohrávajú dôležitú úlohu aj veľkosť, náboj a tvar bielkovinovej molekuly enzýmu ako aj jeho lokalizácia.
K rozhodujúcim faktorom, ktoré ovplyvňujú úroveň aktivity enzýmu v sére a čas trvania jej vzostupu po uvoľnení do krvi, patria inaktivácia a eliminácia enzýmov.Obidva faktory závisia od vlastností molekúl enzýmov a systémov, ktoré enzýmy eliminujú. Na vyjadrenie poklesu aktivity enzýmov v sére používame ako ukazovateľ rýchlosť inaktivácie alebo eliminácie – biologický polčas rozpadu enzýmu (t1/2), ktorý vyjadruje za aký čas poklesne aktivita enzýmu na polovičnú hodnotu. Biologický polčas patrí medzi faktory, ktoré bezprostredne vplývajú na diagnostické využitie jednotlivých enzýmov (vhodnosť ich vyšetrenia v priebehu ochorenia). V nasledujúcej tabuľke sú uvedené vybrané polčasy eliminácie niektorých dôležitých enzýmov v sére.
| Enzým | t1/2 | Enzým | t1/2 |
|---|---|---|---|
| amyláza | 3–6 h | ALT | 47 h |
| lipáza | 3–6 h | LD1 | 113 h |
| LD5 | 10 h | HBD | 113 h |
| CK | 15 h | GMT | 3–4 dni |
| AST | 17 h | ALP | 3–7 dni |
| GMD | 18 h | CHS | 10 dní |
Nie zanedbateľný vplyv na aktivitu enzýmov v krvi má aj charakter chorobného procesu. Fáza a rozsah poškodenia tkaniva chorobným procesom určuje i množstvo uvoľnených enzýmov z buniek do plazmy. Tento pochod môže byť ovplyvnený stupňom cievneho zásobenia v mieste patologických zmien, rýchlosťou cirkulácie v tejto oblasti a prítomnosťou/chýbaním zápalovej bariéry, ktorá ohraničuje poškodenú časť tkaniva od okolia.
Pri interpretácii zvýšených hladín enzýmov v sére je dôležité posúdiť aj ďalšie faktory ako sú napr. vek, pohlavie, telesná aktivita, bilancia tekutín, lieky, alkohol, ale aj interferencia z hľadiska orgánových zmien, či interferencie z metodických príčin – tzv. nešpecifické ovplyvňovanie aktivity enzýmov.
Diagnosticky významné enzýmy[upravit | editovat zdroj]
V nasledujúcej tabuľke sú uvedené vybrané klinicky významné enzýmy.
| Enzým (skratka) | Zvýšené hodnoty | Znížené hodnoty |
|---|---|---|
| Alanínaminotransferáza (ALT) | rôzne ochorenia pečene | |
| Alkalická fosfatáza (ALP) | fyziologické v období rastu a v gravidite, ochorenia pečene a žlčových ciest, ochorenia kostí, rekonvalescencia po zlomeninách, niektoré nádory | znížená funkcia štítnej žľazy, Wilsonova choroba, nedostatok zinku |
| Amyláza (AMS) | zápal pankreasu, zápal gl. parotis, rôzne ochorenia orgánov v brušnej dutine | |
| Aspartátaminotransferáza (AST) | ochorenia pečene, poškodenie priečne pruhovaného svalu, poškodenie srdcového svalu | zlyhanie pečene |
| Elastáza | ochorenia pankreasu | |
| 3-hydroxybutyrátdehydrogenáza (HBDH) | sledovanie priebehu ochorenia infarktu myokardu | |
| Glutamyltransferáza (GMT) | ochorenie žlčových ciest a pečene (najmä toxické poškodenie – lieky, alkohol) | |
| Cholínesteráza (CHS) | ochorenia pečene, intoxikácia organofosfátmi, hyperkatabolizmus | |
| Kreatínkináza (CK) | infarkt myokardu (CK-MB), ochorenia kostrového svalstva, intramuskulárne injekcie, telesná aktivita (CK-MM), ochorenia mozgu, niektoré nádory (CK-BB) | |
| Kyslá fosfatáza (ACP) | nadprodukcia parathormónu, nádory prostaty, nádory kostí | |
| Laktátdehydrogenáza (LD) | infarkt myokardu, anémie (LD1,2), pľúcne embólie (LD3), ochorenia pečene, ochorenia kostrového svalstva (LD4,5), nádory (LD3–5) | |
| Lipáza (LPS) | zápal pankreasu | |
| Trypsín | ochorenia pankreasu | juvenilný diabetes, cystická fibróza |
| Tymidínkináza | nádory, vírusové infekcie | |
| Väčšina koagulačných faktorov | poruchy koagulácie | poruchy koagulácie |
Distribúcia diagnosticky významných enzýmov v tkanivách[upravit | editovat zdroj]
V nasledujúcej tabuľke je uvedená distribúcia vybraných klinicky významných enzýmov.
| Enzým | ACP | ALP | AMS | ALT | AST | CK | GMT | CHS | LD | LPS |
|---|---|---|---|---|---|---|---|---|---|---|
| Erytrocyty | ** | * | * | |||||||
| Kosti | * | ** | ||||||||
| Kostrový sval | * | * | ** | * | ||||||
| Myokard | * | ** | * | |||||||
| Obličky | * | * | * | * | ||||||
| Pankreas | ** | * | ** | *** | ||||||
| Pečeň | * | * | *** | *** | * | |||||
| Prostata | *** | |||||||||
| Žlčové cesty | ** |
LD je príkladom enzýmu, ktorý sa vyskytuje nielen v tkanivách schopných anaeróbneho metabolizmu (erytrocyty, svaly), ale aj v orgánoch, v ktorých dochádza k oxidácii laktátu cez pyruvát a acetylCoA (srdce, neuróny) alebo glukoneogenéze (pečeň). Zvýšená hladina LD v plazme môže indikovať poškodenie takéhoto orgánu, čo môžeme využiť v diagnostike. CK séra pochádza z 96 % z kostrového svalstva a 4 % z myokardu. Pri poškodení kostrového svalstva stúpa celková aktivita CK. Pri podozrení na infarkt myokardu je dôležité vylúčiť poškodenie kostrového svalstva.



![{\displaystyle K_{m}=[S]\cdot [{\frac {V_{max}}{V-1}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/058d1ccfd1bc1c9855369d0e0978eb1d4ebe7b5c)
![Obr. 3 Saturačná krivka - vplyv koncentrácie substrátu [S] na rýchlosť enzýmovej reakcie](/thumb.php?f=StanovenieKM.jpg&width=500)