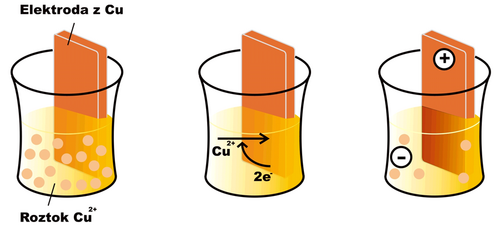
Elektrodové děje
Ponoříme-li do roztoku kovového iontu (např. Cu2+) elektrodu ze stejného kovu (v daném případě mědi), začne na povrchu elektrody probíhat oxido-redukční reakce
- Cu2+ + 2 e− Cu
V případě mědi je za běžných podmínek rovnováha uvedené reakce posunuta poněkud doprava (u jiných látek, např. zinku, tomu může být opačně). Na povrchu elektrody se ukládá vrstvička vyredukované mědi a elektroda posupně získává kladný náboj, protože se z ní odčerpávají volné elektrony. Roztok, do nějž je elektroda ponořena, naopak získává záporný náboj, neboť z něj bez náhrady ubývají kationty Cu2+. Po určité době se reakce zastaví, neboť elektrostatické síly dalšímu přesunu nabitých částic brání, a ustaví se rovnováha charakterizovaná jistým elektrickým potenciálem na elektrodě. Snahu elektrody přijímat nebo odevzdávat elektrony charakterizuje tzv. redukční potenciál (Ered). Pokud mají všechny složky elektrodové reakce aktivitu rovnou jedné, nebo se nacházejí v podobě, na niž je standardní stav vztažen (např. pevné skupenství), mluvíme o standardním redukčním potenciálu (E0red).
Potenciál vzniklý výše popsaným způsobem na jedné elektrodě nedokážeme změřit přímo. Můžeme však vytvořit článek složený ze dvou různých elektrod – např. kovů (obecně poločlánků) a dvou odpovídajících elektrolytů. Příkladem může být tzv. Daniellův článek: Cu v roztoku Cu2+ a Zn v roztoku Zn2+. Podle toho, jestli mají jednotlivé kovy tendenci být spíš v oxidované nebo redukované podobě, je můžeme uspořádat do tzv. Beketovovy elektrochemické řady (K, Ca, Al, Zn, Fe, Ni, Pb, H, Bi, Cu, Hg, Ag, Au). Pro tyto účely se za nulu považuje elektrodový potenciál tzv. standardní vodíkové elektrody. Kovy, které mají záporný standardní redukční potenciál a tedy snadno odevzdávají elektron, jsou v řadě nalevo od vodíku (tj. draslík má snahu se oxidovat na K+). Ionty kovů, které jsou vpravo, naopak elektrony snadno přijímají (např. Ag+ se snadno redukuje na Ag) a jejich standardní redukční potenciál je kladný.
Výše zmíněný Daniellův článek se schematicky zapisuje Zn | Zn2+ || Cu2+ | Cu (negativnější kov se zapisuje vlevo). Na zinkové elektrodě probíhá redoxní reakce
- Zn2+ + 2 e− Zn,
která má rovnovážnou konstantu KZn a je charakterizovaná standardním redukčním potenciálem E0red(Zn); na měděné elektrodě probíhá výše uvedená reakce
- Cu2+ + 2 e− Cu
s rovnovážnou konstantou KCu a standardním redukčním potenciálem E0red(Cu). V daném případě platí, že KCu > KZn, resp. E0red(Cu) > E0red(Zn). Jinými slovy měď se bude redukovat a ukládat na elektrodě ochotněji, než zinek. Z měděné elektrody se tak spotřebuje více elektronů, než ze zinkové. V konečném důsledku bude mít měděná elektroda vůči zinkové kladné napětí, které můžeme změřit.
Necháme-li mezi elektrodami protékat proud, budou se „scházející" elektrony do měděné elektrody dodávat ze zinkové a výsledný děj bude možné zapsat takto:
- Zn → Zn2+ + 2e−
- Cu2+ + 2e− → Cu
Vodičem mezi elektrodami i solným můstkem poteče proud tak dlouho, dokud se nerozpustí zinková elektroda, nebo (což je pravděpodobnější) dokud se nespotřebuje Cu2+ z elektrolytu, popřípadě se druhý elektrolyt nenasytí ionty Zn2+ (vybití elektrochemického článku).
Napětí článku je rovno rozdílu potenciálu obou elektrod. Článek, na němž probíhají děje samovolně, spontánně („produkuje“ napětí) nazýváme článkem galvanickým (ΔG < 0). Pokud na něj napětí vkládáme a děje jsou „vynuceny“ vloženým napětím (ΔG > 0), nazýváme takovýto článek elektrolytickým.
Popsané elektrodové děje jsou poměrně obecné a obdobným způsobem probíhají v nejrůznějších soustavách složených z různých kovů a iontů.
.