Elektrolýza: Porovnání verzí
(členění; nadpisy) |
(popisek obrázku) |
||
| Řádek 3: | Řádek 3: | ||
;Příklad: | ;Příklad: | ||
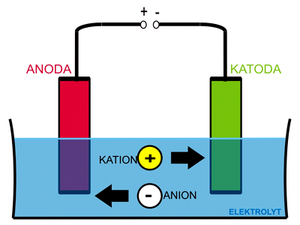
Jako příklad použijeme soustavu složenou z dvou inertních (platinových) elektrod ve vodném roztoku chloridu sodného. | Jako příklad použijeme soustavu složenou z dvou inertních (platinových) elektrod ve vodném roztoku chloridu sodného. | ||
[[Soubor:elektrolyza.png|right|thumb| | [[Soubor:elektrolyza.png|right|thumb|Obecné schéma elektrolýzy.]] | ||
Vložíme-li na elektrody napětí, začnou ionty v roztoku putovat podle svého náboje, kationty <chemform>Na+</chemform> a <chemform>H+</chemform> ke katodě a anionty <chemform>Cl-</chemform> a <chemform>OH-</chemform> k anodě. Na katodě (a v její těsné blízkosti) budou probíhat reakce | Vložíme-li na elektrody napětí, začnou ionty v roztoku putovat podle svého náboje, kationty <chemform>Na+</chemform> a <chemform>H+</chemform> ke katodě a anionty <chemform>Cl-</chemform> a <chemform>OH-</chemform> k anodě. Na katodě (a v její těsné blízkosti) budou probíhat reakce | ||
Verze z 24. 11. 2010, 19:23
Ve výkladu elektrodových dějů jsme předpokládali, že soustava je v rovnovážném stavu. Zabývejme se nyní tím, co se stane, pokud na elektrody přivedeme napětí z vnějšího zdroje (elektrolytický článek, ΔG > 0). Probíhající děje se budou řídit Faradayovými zákony. K tomu, aby elektrolytické reakce začaly probíhat, musí napětí na elektrodách přesáhnout určitou hodnotu – rozkladné napětí (odpovídá součtu standardních elektrodových potenciálů pro jednotlivé reakce, v daném případě bude asi 1,4 V).
- Příklad
Jako příklad použijeme soustavu složenou z dvou inertních (platinových) elektrod ve vodném roztoku chloridu sodného.
Vložíme-li na elektrody napětí, začnou ionty v roztoku putovat podle svého náboje, kationty <chemform>Na+</chemform> a <chemform>H+</chemform> ke katodě a anionty <chemform>Cl-</chemform> a <chemform>OH-</chemform> k anodě. Na katodě (a v její těsné blízkosti) budou probíhat reakce
- 2H+ + 2e− → H2 ↑
a (při vyšším napětí)
- Na+ + e− → Na
- 2Na + 2H2O → 2Na+ + 2OH− + H2 ↑ .
Na anodě bude probíhat reakce
- 2Cl− → Cl2 ↑ + 2e− .
Plynný vodík i chlor budou ze systému unikat (v tomto případě jde tedy o nevratný děj). Uvedený příklad známe i z praxe – všimněte si např. bublinek u elektrod při elektroforéze.
Využití
Tohoto jevu se využívá např. i v polarografii. Zjednodušeně řečeno, pokud budeme postupně zvyšovat napětí na elektrodách, bude soustavou zpočátku protékat jen malý proud. Po dosažení rozkladného napětí, charakteristického pro příslušný redoxní pár, začnou probíhat elektrolytické děje na povrchu měrné elektrody a proud se prudce zvýší (vzestupná část polarografické křivky). Jelikož tato reakce je velmi rychlá, dojde záhy k vyčerpání iontů v okolí elektrody. Nové ionty jsou dopravovány k povrchu elektrody difuzí (v důsledku rozdílu koncentrací mezi vnitřkem roztoku a povrchem elektrody), jejíž rychlost je omezená, a proto se velikost proudu pomalu blíží určité hodnotě (rovné plato). Sestrojíme-li graf závislosti proudu na vloženém napětí, dostaneme schodovitou polarografickou křivku.