Skleněná elektroda/podrobnosti: Porovnání verzí
(doplnění) |
značka: editace z Vizuálního editoru |
||
| (Není zobrazeno 14 mezilehlých verzí od 10 dalších uživatelů.) | |||
| Řádek 1: | Řádek 1: | ||
{{ | <noinclude>{{Zkontrolováno | 20160621222128 | [[Soubor:Martin Vejražka.jpg | 30px | link=Uživatel:Mvejr]] [[Uživatel:Mvejr|MUDr. Martin Vejražka, PhD.]] -- [[WikiSkripta:Organizace|redakce WikiSkript]] |365689|20170106004523}}</noinclude> | ||
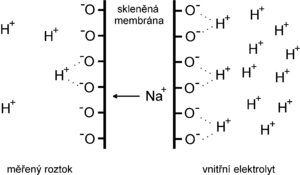
[[Soubor:Membrána skleněné elektrody.png | thumb | Pochody na membráně skleněné elektrody]] | |||
'''Skleněná elektroda''' je iontově selektivní elektroda (ISE), která se používá pro měření aktivity iontů vodíku H<sup>+</sup>, v praxi tedy ke stanovení [[PH prostředí|pH]] [[Roztok|roztoku]]. | |||
Na poměrně pravidelnou křemičitanovou krystalovou mřížku skla se [[Elektrostatické pole|elektrostatickými silami]] váží ionty, především vodíku a alkalických kovů (zejména sodíku). Při styku s roztokem se na povrchu vytváří solvatovaná vrstvička, ve které dochází k výměně vodíkových iontů (ale také např. sodíku) mezi roztokem a sklem. Skleněná elektroda se tedy liší od většiny ISE tím, že u ní vznik potenciálu není výsledkem redoxních pochodů, nýbrž dějů výměnných, probíhajících mezi ionty v krystalové mřížce skla a ionty v roztoku. | |||
Jak již bylo řečeno, nejvýznamněji se na dějích na povrchu skleněné elektrody podílejí ionty vodíku a sodíku. Ponoříme-li elektrodu do určitého roztoku a vyčkáme ustavení rovnováhy, můžeme rovnovážný stav popsat vztahem | |||
:<math>K_s = \frac{a_{H^+}^* \cdot a_{Na^+}}{a_{Na^+}^* \cdot a_{H_2O}}</math> | |||
:<math>K_s = \frac{a_{H^+}^* a_{Na^+}}{a_{Na^+}^* a_{H_2O}}</math> | |||
:(* značí fázi skla) | |||
K<sub>s</sub> je tzv. ''konstanta selektivity'', která ukazuje, jak selektivně elektroda reaguje na jeden nebo druhý iont. | |||
Ze vztahu uvedeného výše vyplývá, že pro potenciál indikační elektrody bude (zjednodušeně) platit: | |||
:<math> E = \text{konst} + \frac{RT}{F} \cdot \ln(a_{H_3O^+} + K_S \cdot a_{Na}) \;\dot=\; \text{konst} + \frac{RT}{F} \cdot \ln a_{H_3O^+} </math> | |||
( | („''konst''“ neodpovídá přesně standardnímu redukčnímu potenciálu, ale zahrnuje v sobě i druh a složení skla, způsob přípravy elektrody, kvalitu povrchu i vnitřní náplň elektrody). | ||
Úpravou dostaneme | Úpravou dostaneme | ||
:<math> E = \text{konst} - 2,303 \cdot pH </math>. | |||
== Závislost potenciálu elektrody na pH, chyby měření == | |||
Potenciál indikační elektrody je tedy lineárně závislý na [[pH]] měřeného roztoku. V reálných podmínkách poroste napětí na elektrodě s rostoucím pH o něco pomaleji, než by odpovídalo teoretickým předpokladům. Pro korekci takovýchto odchylek se provádí u pH-metrů kalibrace (ve dvou či více hodnotách pH) a automaticky se podle ní vypočítává ''směrnice kalibrační přímky'' (angl. ''slope'', citlivost elektrody). Současně se provádí i korekce na teplotu. Poměr skutečné a teoretické směrnice se za optimálních podmínek pohybuje kolem 98 %, s opotřebením a znečištěním elektrody klesá. Při hodnotách pod 95 % je třeba elektrodu vyčistit a stanoveným postupem ošetřit. | |||
Známe-li funkci skleněné elektrody, je snadné vysvětlit některé chyby měření s ní. '''Alkalická (pozitivní) chyba''' je způsobená tím, že selektivita skleněné elektrody není ideální. Při velmi nízkých koncentracích H<sup>+</sup>, tj. v silně alkalické oblasti, začnou hrát roli i přítomné ionty Na<sup>+</sup>. Podle použitého skla a kvality jeho zpracování se sodíková chyba projevuje při pH roztoku nad 8–14; změřené pH bude nižší, než skutečné. Uvádí se, že při práci s roztoky o pH kolem 10 a s koncentrací Na<sup>+</sup> 0,1 mol · l<sup>−1</sup> se změřená hodnota může lišit od skutečného pH až o 0,4. V silně kyselém prostředí (pH pod l–2) naopak dojde k nasycení povrchu skla protony a elektroda přestane být k dalšímu snižování pH citlivá, tj. naměříme vyšší výsledek něž by tomu mělo být ve skutečnosti; v tomto případě mluvíme o '''kyselé (negativní) chybě''' (pH < 1). | |||
Je také zřejmé, že přesuny iontů na membráně jsou relativně pomalé, zvláště za přítomnosti koloidních látek v měřeném roztoku, z čehož vyplývá poměrně dlouhá doba do ustálení elektrody | Je také zřejmé, že přesuny iontů na membráně jsou relativně pomalé, zvláště za přítomnosti koloidních látek v měřeném roztoku, z čehož vyplývá poměrně dlouhá doba do ustálení elektrody – zpravidla kolem 15 až 60 s (v kyselých roztocích jsou odezvy rychlejší než v alkalických). | ||
Další chyby měření mohou být způsobené vlastnostmi měřených roztoků a manipulací s elektrodou. Pokud elektroda oschne, poškodí se povrchová vrstvička hydratovaného gelu a její obnovení trvá řadu hodin. Rovněž některé látky se mohou na gel vázat a ovlivnit jeho vlastnosti („otrávení elektrody“). Důsledky mechanických nečistot na membráně není třeba rozebírat. | Další chyby měření mohou být způsobené vlastnostmi měřených roztoků a manipulací s elektrodou. Pokud elektroda oschne, poškodí se povrchová vrstvička hydratovaného gelu a její obnovení trvá řadu hodin. Rovněž některé látky se mohou na gel vázat a ovlivnit jeho vlastnosti („otrávení elektrody“). Důsledky mechanických nečistot na membráně není třeba rozebírat. | ||
<noinclude> | |||
== Odkazy == | |||
=== Související články === | |||
* [[Skleněná elektroda]] | |||
* [[Elektrodový potenciál]] | |||
* [[Elektrodové děje]] | |||
* [[Standardní vodíková elektroda]] | |||
</noinclude> | |||
[[Kategorie:Biochemie]] | |||
[[Kategorie:Chemie]] | |||
[[Kategorie:Biofyzika]] | |||
Aktuální verze z 9. 1. 2024, 06:32
Skleněná elektroda je iontově selektivní elektroda (ISE), která se používá pro měření aktivity iontů vodíku H+, v praxi tedy ke stanovení pH roztoku.
Na poměrně pravidelnou křemičitanovou krystalovou mřížku skla se elektrostatickými silami váží ionty, především vodíku a alkalických kovů (zejména sodíku). Při styku s roztokem se na povrchu vytváří solvatovaná vrstvička, ve které dochází k výměně vodíkových iontů (ale také např. sodíku) mezi roztokem a sklem. Skleněná elektroda se tedy liší od většiny ISE tím, že u ní vznik potenciálu není výsledkem redoxních pochodů, nýbrž dějů výměnných, probíhajících mezi ionty v krystalové mřížce skla a ionty v roztoku.
Jak již bylo řečeno, nejvýznamněji se na dějích na povrchu skleněné elektrody podílejí ionty vodíku a sodíku. Ponoříme-li elektrodu do určitého roztoku a vyčkáme ustavení rovnováhy, můžeme rovnovážný stav popsat vztahem
- (* značí fázi skla)
Ks je tzv. konstanta selektivity, která ukazuje, jak selektivně elektroda reaguje na jeden nebo druhý iont.
Ze vztahu uvedeného výše vyplývá, že pro potenciál indikační elektrody bude (zjednodušeně) platit:
(„konst“ neodpovídá přesně standardnímu redukčnímu potenciálu, ale zahrnuje v sobě i druh a složení skla, způsob přípravy elektrody, kvalitu povrchu i vnitřní náplň elektrody).
Úpravou dostaneme
- .
Závislost potenciálu elektrody na pH, chyby měření[upravit | editovat zdroj]
Potenciál indikační elektrody je tedy lineárně závislý na pH měřeného roztoku. V reálných podmínkách poroste napětí na elektrodě s rostoucím pH o něco pomaleji, než by odpovídalo teoretickým předpokladům. Pro korekci takovýchto odchylek se provádí u pH-metrů kalibrace (ve dvou či více hodnotách pH) a automaticky se podle ní vypočítává směrnice kalibrační přímky (angl. slope, citlivost elektrody). Současně se provádí i korekce na teplotu. Poměr skutečné a teoretické směrnice se za optimálních podmínek pohybuje kolem 98 %, s opotřebením a znečištěním elektrody klesá. Při hodnotách pod 95 % je třeba elektrodu vyčistit a stanoveným postupem ošetřit.
Známe-li funkci skleněné elektrody, je snadné vysvětlit některé chyby měření s ní. Alkalická (pozitivní) chyba je způsobená tím, že selektivita skleněné elektrody není ideální. Při velmi nízkých koncentracích H+, tj. v silně alkalické oblasti, začnou hrát roli i přítomné ionty Na+. Podle použitého skla a kvality jeho zpracování se sodíková chyba projevuje při pH roztoku nad 8–14; změřené pH bude nižší, než skutečné. Uvádí se, že při práci s roztoky o pH kolem 10 a s koncentrací Na+ 0,1 mol · l−1 se změřená hodnota může lišit od skutečného pH až o 0,4. V silně kyselém prostředí (pH pod l–2) naopak dojde k nasycení povrchu skla protony a elektroda přestane být k dalšímu snižování pH citlivá, tj. naměříme vyšší výsledek něž by tomu mělo být ve skutečnosti; v tomto případě mluvíme o kyselé (negativní) chybě (pH < 1).
Je také zřejmé, že přesuny iontů na membráně jsou relativně pomalé, zvláště za přítomnosti koloidních látek v měřeném roztoku, z čehož vyplývá poměrně dlouhá doba do ustálení elektrody – zpravidla kolem 15 až 60 s (v kyselých roztocích jsou odezvy rychlejší než v alkalických).
Další chyby měření mohou být způsobené vlastnostmi měřených roztoků a manipulací s elektrodou. Pokud elektroda oschne, poškodí se povrchová vrstvička hydratovaného gelu a její obnovení trvá řadu hodin. Rovněž některé látky se mohou na gel vázat a ovlivnit jeho vlastnosti („otrávení elektrody“). Důsledky mechanických nečistot na membráně není třeba rozebírat.